玉米芯诱导里氏木霉Rut C30 产纤维素酶的分析
马立娟,蔡 瑞,崔有志,赫荣琳,陈树林,肖冬光
(1.天津科技大学生物工程学院,天津 300457;2.中国科学院天津工业生物技术研究所,天津 300308)
里氏木霉(Trichoderma reesei)是一种噬温的腐生真菌,被广泛应用于纤维素和半纤维素水解酶类的生产和研究中[1].T.reesei 产生的纤维素酶是一类诱导酶类,其合成和表达必须在诱导物的作用下才能进行.已报道的诱导T.reesei 产纤维素酶的物质主要是一些糖类,包括聚糖、寡糖和单糖,其中,以纤维素、槐糖的诱导效果最好,但是,由于槐糖价格昂贵无法作为工业化生产纤维素酶的诱导原料[2–4].作为纤维素酶分解的底物,天然纤维素本身即是良好的诱导剂[5].目前,关于T.reesei 纤维素酶诱导方面的研究大部分针对乳糖和纤维素开展[6–9].对于复合诱导物木质纤维素诱导T.reesei 产纤维素酶的过程分析方面的报道较少.2013 年,Bischof 等[10]比较分析了天然纤维素小麦秸秆和乳糖诱导里氏木霉合成纤维素酶的转录组,揭开了天然纤维素诱导T.reesei 合成纤维素酶的分子机理研究的序幕.
本研究以T.reesei 为研究对象,分别比较了不同诱导碳源诱导T.reesei 的产酶水平.以玉米芯为诱导物得到的酶液对玉米芯进行水解,采用高效液相色谱(HPLC)法分析水解过程中糖的组成及变化.最后分析比较水解得到的部分糖对T.reesei 纤维素酶诱导合成的影响.
1 材料与方法
1.1 菌种
里氏木霉(T.reesei)Rut C30 ATCC56765 由中国工业微生物菌种保藏管理中心(CICC)购得.
1.2 培养基与培养方法
1.2.1 斜面培养基及培养方法
斜面培养基为PDA 培养基(g/L):马铃薯的煮汁200,葡萄糖20,琼脂20,115,℃灭菌20,min.将保存菌种接入PDA 培养基,28,℃恒温培养6,d.
1.2.2 菌丝体培养基及培养方法
菌丝体培养基(g/L):葡萄糖3,(NH4)2,SO41.4,KH2,PO42,CaCl2·2H2O 0.3,MgSO4·7H2O 0.3,多聚蛋白胨1,酵母提取物0.5,吐温80 1,mL/L,微量元素溶液1,mL/L,用pH 4.8 的50,mmol/L 柠檬酸钠缓冲液体系配制.微量元素溶液(mg/L):FeSO4·7H2O 5,MnSO4·H2O 1.6,ZnSO4·7H2O 1.4,CoCl22,115,℃灭菌20,min.
将斜面上培养好的新鲜孢子制备成孢子悬液,接种于装有50,mL 培养基的250,mL 三角瓶中,孢子的接种量为108,L–1,28,℃、180,r/min 恒温培养24,h.
1.2.3 诱导培养基及诱导培养方法
诱导培养基(g/L):(NH4)2SO40.35,KH2PO40.5,CaCl2·2H2O 0.075,MgSO4·7H2O 0.075,吐温80 0.25,mL/L,微量元素溶液0.25,mL/L,诱导物10(其中,玉米芯粒度为80 目),用pH 5.0 的50,mmol/L 柠檬酸钠缓冲液体系配制.微量元素溶液组成同上.121,℃灭菌20,min.
将上述预培养好的菌丝体过滤,用0.9%的NaCl溶液洗涤2 次后,接种于诱导培养基,接种量(以干质量计)为2.0,mg/mL,26,℃、200,r/min 条件下恒温培养,并于不同诱导时刻取样进行酶活测定.
1.3 玉米芯水解
水解所用粗酶液为T.reesei Rut C30 以玉米芯为底物发酵所得.底物玉米芯质量浓度为100,g/L,酶的转载量为10,FPU/g;水解过程在50,℃、150,r/min的水浴摇床中进行;水解体系为30,mL,0.05,mol/L pH 4.8 柠檬酸钠缓冲液为缓冲体系,同时添加0.02‰叠氮化钠抑制杂菌生长.分别于不同水解时刻取样进行糖组分的测定.
1.4 分析方法
1.4.1 酶活测定
滤纸酶活(filter paper activity,FPA)的测定采用国际理论与应用化学协会(IUPAC)推荐的标准测定方法[11].以葡萄糖作标准曲线,FPA 酶活力单位定义:在pH 4.8、温度为50,℃的条件下,1,mL 酶液1,min 水解50,mg Waterman No.1 滤纸条(1,cm×6,cm)产生1,µmol 葡萄糖当量的还原糖的酶用量为1个酶活力单位,用FPU/mL 表示.
β–葡萄糖苷酶酶活的测定也采用IUPAC 推荐的标准方法[11],其酶活力单位定义:在pH 4.8、50,℃条件下,1,mL 酶液1,min 水解1,µmol 纤维二糖产生2,µmol 葡萄糖当量的还原糖的酶用量为1 个酶活力单位,用IU/mL 表示.
木聚糖酶的活力单位定义:在0.05,mol/L pH 5.3柠檬酸钠缓冲液、温度为50,℃的条件下,1,mL 酶液1,min 水解木聚糖产生1,µmol 葡萄糖当量的还原糖的酶用量为1 个酶活力单位,用IU/mL 表示.
1.4.2 可溶性蛋白的测定
可溶性蛋白的测定采用Bradford 法[12],以牛血清蛋白作标准曲线.将诱导上清液稀释至适当的浓度,取稀释后的酶液200,µL 加入2,mL Bradford 工作液并振荡混匀,5~10,min 内于595,nm 处测定吸光度,代入标准曲线,计算蛋白质质量浓度.
1.4.3 玉米芯水解液糖的分析
玉米芯水解液中各种糖的测定采用高效液相色谱分析仪结合示差检测器进行测定,色谱柱分别为Aminex HPX-87(300,mm×7.8,mm)碳水化合物分析柱和Aminex HPX-42A(300,mm×7.8,mm)碳水化合物分析柱,流动相均为去离子水,流量为0.6,mL/min,柱温为75,℃.
2 结果与讨论
2.1 不同诱导物对T.reesei Rut C30 产酶的影响
2.1.1 对主要木质纤维素降解酶产量的影响
分别比较了木质纤维素类诱导碳源纤维素、玉米芯、麸皮、小麦秸秆、玉米秸秆诱导T.reesei Rut C30的产酶情况.诱导120,h 后,主要木质纤维素降解酶纤维素酶、β–葡萄糖苷酶和木聚糖酶的产量(分别以滤纸酶活、β–葡萄糖苷酶酶活和木聚糖酶活计)见表1.
由表1 可知:在相同的诱导浓度(10,g/L)下,以玉米芯为诱导物时,120,h 后诱导液中纤维素酶、β–葡萄糖苷酶和木聚糖酶的酶活分别达到1.53,FPU/mL、0.61,IU/mL 和72.86,IU/mL,三者的产量均高于其他几种诱导物.以纤维素为诱导碳源时3 种酶的产量仅次于玉米芯.文献[7]报道,槐糖是诱导里氏木霉合成纤维素酶最好的碳源,但是,对于不可溶性的诱导碳源,一般认为纤维素是最好的选择,但都是在诱导浓度较高的时候,与本研究前期的结果一致[13].然而,在低的诱导浓度时,有半纤维素成分的玉米芯却表现出较好的诱导能力,这在刘超纲等[14]用玉米芯诱导产木聚糖酶的研究中也有类似的结论,这可能与玉米芯的组成成分和结构有关.
2.1.2 对可溶性蛋白产量的影响
不同诱导碳源对T.reesei Rut C30 分泌的可溶性蛋白的影响如图1 所示.

图1 不同诱导物对T.reesei Rut C30 分泌蛋白的影响Fig.1 Effects of different inducers on protein secretion with T.reesei Rut C30
由图1 可知:诱导120,h 后,以玉米芯为诱导碳源时T.reesei Rut C30 分泌到胞外的可溶性蛋白质质量浓度最高,为2.09,g/L;其次为纤维素、小麦秸秆和玉米秸秆;麸皮诱导所产生的分泌蛋白质质量浓度最低.该结果与产酶结果一致.玉米芯、小麦秸秆和玉米秸秆均为含有半纤维素类的木质纤维素原料,由于半纤维素成分可诱导半纤维素酶的表达,因此以该类碳源为诱导物时T.reesei Rut C30 合成的蛋白的种类较以纯纤维素为诱导碳源时多.Bischof 等[10]比较分析了不同诱导碳源小麦秸秆和乳糖诱导里氏木霉合成纤维素酶的转录组,1,619 个基因在以小麦秸秆为底物时表达,而以乳糖为底物时不表达,这些基因主要编码木聚糖酶、几丁质酶和甘露糖苷酶等.同时,由于玉米芯与秸秆类纤维素原料相比较在结构上的疏松性以及其高含量的半纤维素成分,导致以其为碳源时更容易被T.reesei Rut C30 利用分解为可溶性诱导糖进行诱导产酶.
2.2 玉米芯水解过程糖组分及含量分析
经HPLC 检测玉米芯水解液中的糖,可检测到的单糖包括:葡萄糖、木糖、阿拉伯糖、甘露糖和半乳糖;寡糖包括:槐糖、纤维二糖、纤维三糖、纤维四糖、纤维五糖、木二糖、木三糖等.由于标准品原因,该过程中只定量分析了纤维二糖和单糖,结果如图2所示.
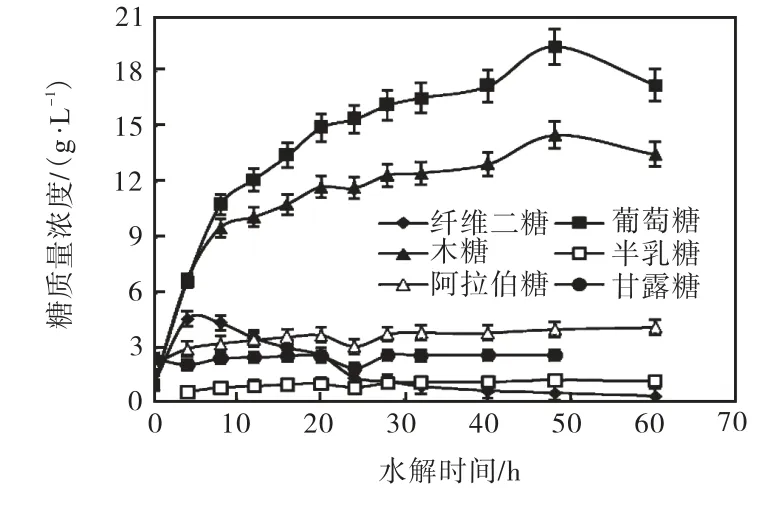
图2 玉米芯水解过程中单糖和纤维二糖的含量Fig.2 Cotents of monosaccharide and cellobiose during the enzymatic hydrolysis of corn cob
由图2 可知:葡萄糖和木糖的质量浓度均是随着水解时间的延长不断增加直至水解50,h,质量浓度分别达到19.3,g/L 和14.6,g/L.但是,其他几种单糖如半乳糖、阿拉伯糖和甘露糖的质量浓度随水解时间的延长增加不明显.对于纤维二糖,则是随着水解时间的延长其质量浓度先上升后下降,这是由于水解生成纤维二糖的同时,其又被β–葡萄糖苷酶水解为葡萄糖.
2.3 玉米芯水解物对T.reesei Rut C30 产纤维素酶的影响
以玉米芯经酶水解后得到的不同组分为诱导物对T.reesei Rut C30 进行诱导产酶,结果如图3 和图4 所示.
由于以玉米芯水解物诱导里氏木霉时β–葡萄糖苷酶产量特别小,计算酶活误差较大,因此这里在β–葡萄糖苷酶酶活测定方法的基础上,以1,mL 酶液30,min 水解15,µmol 纤维二糖底物所释放的葡萄糖的质量浓度来表示诱导过程中产生的β–葡萄糖苷酶.单独以木聚糖、甘露糖和阿拉伯糖为诱导物时,不能直接诱导纤维素酶和β–葡萄糖苷酶的合成.而以低浓度的半乳糖为诱导物时,纤维素酶和β–葡萄糖苷酶均可得到低水平的诱导表达.这与文献[15]报道“以乳糖为诱导物时添加低水平的半乳糖可以诱导外切酶CBH1 和CBH2 的表达”的结果一致.但是,其诱导合成纤维素酶和β–葡萄糖苷酶的量远远低于以纤维素和玉米芯为诱导物时的产量.

图3 不同诱导物诱导T.reesei Rut C30 产纤维素酶情况Fig.3 Effects of different inducers on cellulase production with T.reesei Rut C30

图4 不同诱导物诱导T.reesei Rut C30 产β–葡萄糖苷酶的情况Fig.4 Effects of different inducers on β-glucosidase production with T.reesei Rut C30
为了进一步研究玉米芯水解物对T.reesei Rut C30 产酶的影响,将几种单糖和木聚糖以相同的浓度与1%的纤维素混合作为诱导物进行诱导产酶,结果如图5 和图6 所示.添加甘露糖和阿拉伯糖时,纤维素酶和β–葡萄糖苷酶的产量均下降,结合前面的结果可知,甘露糖和阿拉伯糖抑制T.reesei Rut C30 产酶.而添加半乳糖时,纤维素酶产量上升,但β–葡萄糖苷酶的产量下降.添加木聚糖时,60,h 后纤维素酶和β–葡萄糖苷酶的产量高于纤维素诱导.同时,各种诱导物以相同浓度诱导T.reesei Rut C30 时,玉米芯诱导产纤维素酶、β–葡萄糖苷酶和木聚糖酶的水平是最高的.由此结果可以进一步证实,含有半纤维素成分的玉米芯诱导T.reesei Rut C30 产纤维素酶的过程是一个非常复杂的过程,并且其调控过程可能呈复杂的网络状.

图5 添加不同水解物对T.reesei Rut C30 产纤维素酶的影响Fig.5 Effects of different hydrolysate addition on cellulase production with T.reesei Rut C30

图6 添加不同水解物对T.reesei Rut C30 产β–葡萄糖苷酶的影响Fig.6 Effects of different hydrolysate addition on β-glucosidase production with T.reesei Rut C30
3 结论
比较不同木质纤维素类诱导碳源诱导里氏木霉Rut C30 产酶的情况,结果表明:以玉米芯为诱导碳源诱导120,h 后,纤维素酶、β–葡萄糖苷酶和木聚糖酶的酶活分别为 1.53,FPU/mL、0.61,IU/mL 和72.86,IU/mL.采用HPLC 法分析玉米芯酶解过程中单糖的组成为葡萄糖、木糖、阿拉伯糖、甘露糖和半乳糖等.诱导产酶实验表明半乳糖可诱导纤维素酶的合成,甘露糖和阿拉伯糖抑制T.reesei Rut C30 产纤维素酶和β–葡萄糖苷酶.而木聚糖与纤维素混合时有助于诱导产酶.由此可见,玉米芯诱导的实质仍然是其水解后的可溶性寡糖及半乳糖的共同作用,并且该过程是一个非常复杂的过程.因此,需要进一步从酶的基因表达以及转录调控因子表达的水平上对其诱导机理进行研究.
[1]Peterson R,Nevalainen H.Trichoderma reesei RUTC30:Thirty years of strain improvement[J].Microbiology,2012,158(1):58-68.
[2]Schuster A,Schmoll M.Biology and biotechnology of Trichoderma[J].Applied Microbiology and Biotechnology,2010,87(3):787-799.
[3]Zhang Y H P,Himmel M E,Mielenz J R.Outlook for cellulase improvement:Screening and selection strategies[J].Biotechnology Advances,2006,24(5):452-481.
[4]谢天文,刘晓风,袁月祥,等.真菌产纤维素酶的诱导物及其调控机理研究进展[J].应用与环境生物学报,2010,16(3):440-444.
[5]Suto M,Tomita F.Induction and catabolite repression mechanisms of cellulase in fungi[J].Journal of Bioscience and Bioengineering,2001,92(4):305-311.
[6]李辉,王义强,陈介南,等.里氏木霉产纤维素酶的诱导和合成机理研究进展[J].中国酿造,2011(6):8-12.
[7]张晓萍.低聚糖和纤维类碳源对里氏木霉合成纤维素酶的诱导作用[D].南京:南京工业大学,2010.
[8]Sternberg D,Mandels G R.Induction of cellulolytic enzymes in Trichoderma reesei by sophorose[J].Journal of Bacteriology,1979,139(3):761-769.
[9]Morikawa Y,Ohashi T,Mantani O.Cellulase induction by lactose in Trichoderma reesei PC-3-7[J].Applied Microbiology and Biotechnology,1995,44(1/2):106-111.
[10]Bischof R,Fourtis L,Limbeck A,et al.Comparative analysis of the Trichoderma reesei transcriptome during growth on the cellulase inducing substrates wheat straw and lactose[J].Biotechnology for Biofuels,2013,6(1):127-141.
[11]Ghose T K.Measurement of cellulase activities[J].Pure and Applied Chemistry,1987,59(2):257-268.
[12]Bradford M M.A rapid and sensitive method for the quantitation of micro-gram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[13]Ma L J,Li C,Yang Z H,et al.Kinetic studies on batch cultivation of Trichoderma reesei and application to enhance cellulase production by fed-batch fermentation[J].Journal of Biotechnology,2013,166(4):192-197.
[14]刘超纲,勇强,余世袁.里氏木霉诱导合成木聚糖酶的调控[J].南京林业大学学报,1999,23(3):29-32.
[15]Karaffa L,Fekete E,Gamauf C,et al.D-Galactose induces cellulase gene expression in Hypocrea jecorina at low growth rates[J].Microbiology,2006,152(5):1507-1514.

