三七中总皂苷闪式提取工艺
冯素香, 史晶晶, 吴兆宇, 周悌强, 李建生, 王蒙蒙, 郝 蕊, 李 先
(河南中医学院呼吸疾病诊疗与新药研发河南省协同创新中心,河南郑州450046)
三七(Notoginseng Radix et Rhizoma)为五加科植物三七的干燥根和茎,又名田七、金不换等,是我国名贵的传统中药。其性温,味甘、微苦,归肝、胃经,含皂苷、多糖等有效成分,有散瘀止血、消肿定痛之功效,用于治疗咯血、崩漏、外伤出血、胸腹刺痛、跌扑肿痛等[1],其中三七皂苷是主要有效成分。现代药理研究表明,该成分能改善脑缺血后脑组织的能量代谢[2]、抗帕金森病等神经系统疾病、抗肾间质纤维化[3]、抗糖尿病肾病,抗肾小球纤维化等泌尿系统疾病、抗肝纤维化等作用[4]。目前,三七的提取方法有渗漉法[5]、醇回流提取法、超声提取法[6]等,而最近又有闪式提取法对三七有效成分进行研究的报道[7-8],但尚未将该方法应用于三七总皂苷。闪式提取法是一种在常温下快速提取的方法,具有高效、节能等特点,本实验以三七提取物中三七皂苷R1和人参皂苷Rg1、Re、Rb1、Rd 这五种皂苷含有量的总和作为总皂苷含有量,以三七提取物的出膏率和总皂苷含有量为指标,采用正交试验设计,对该方法进行优化,用以探讨不同提取方法对三七总皂苷提取率的影响,为其提取提供新方法。
1 材料
JHBE-50 闪式提取器(河南金鼎科技发展有限公司);Waters e2695 HPLC 色谱仪,包括Waters 2998 紫外检测器、Empower 色谱工作站 (美国Water 公司);KH2200DB 超声波清洗器(昆山市超声仪器有限公司);XS105 电子分析天平(瑞士梅特勒-托利多公司);SHE-D (III)循环水式真空泵(巩义市予华仪器有限责任公司)。
三七皂苷R1(批号110745-200617)、人参皂苷Rg1(批号110703-201128)、人参皂苷Re (批号110754-200421)、人参皂苷Rb1(批号110704-201223)、人参皂苷Rd (批号111818-201001)对照品(中国食品药品检定研究院)。乙腈为色谱纯(美国Fisher 公司);水为超纯水(自制)。三七饮片购自河南张仲景大药房股份有限公司,由河南中医学院药学院陈随清教授鉴定为五加科植物三七Panax notoginseng (Burk.)F. H. Chen 的干燥根。
2 方法与结果
2.1 三七提取物中总皂苷的HPLC 测定
2.1.1 供试品溶液的制备 精密称取三七提取物20 mg,置10 mL 量瓶中,加70%甲醇溶解并稀释至刻度,摇匀,0.45 μm 微孔滤膜过滤,即得。
2.1.2 色谱条件 Venusil XBP-C18色谱柱(4.6 mm×250 mm,5 μm);流动相为水(A)-乙腈(B),梯度洗脱0 →12 min→60 min→70 min,81%A →81% A →64% A →81% A[1];检 测 波 长203 nm;进样量10 μL;柱温25 ℃,三七混合对照品及供试品色谱图见图1。
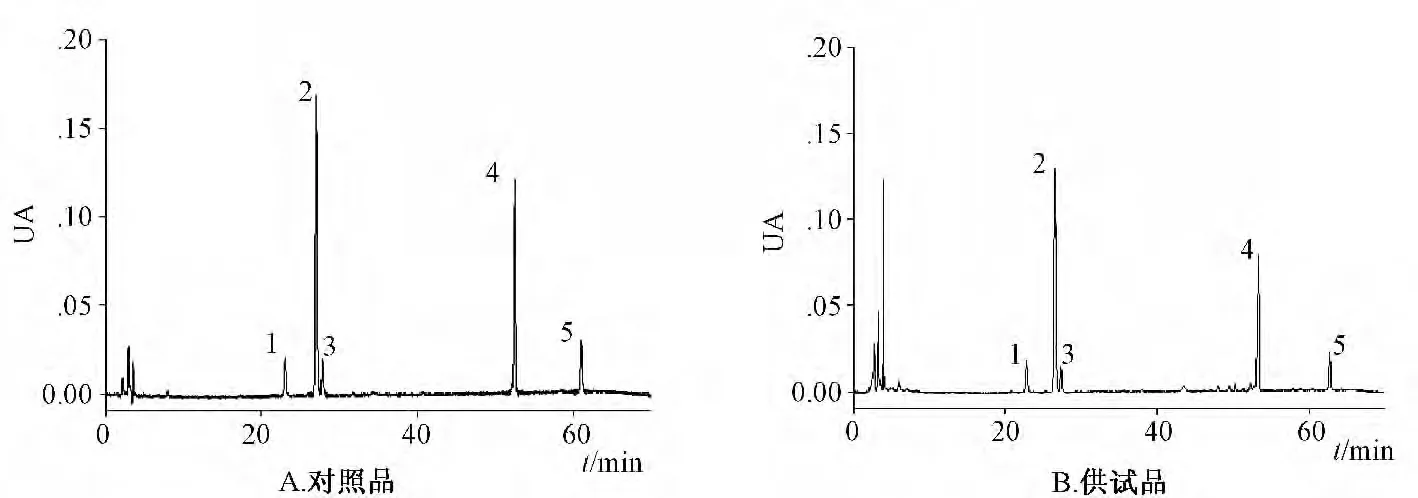
图1 HPLC 色谱图Fig.1 High performance liquid chromatography
2.1.3 标准曲线 精密称取三七皂苷R1、人参皂苷Rg1、Re、Rb1及Rd 对照品适量,加甲醇溶解,制成质量浓度分别为 0.174、0.512、0.105、0.446、0.151 mg/mL 的混合对照品溶液。然后,精密量取0.5、1、2、4、5、10 mL,分别置于10 mL 量瓶中,加甲醇稀释至刻度线,摇匀。在“2.1.2”项色谱条件下进行测定,以进样量(mg/mL)为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线,得到各组分的回归方程,见表1。

表1 各组分标准曲线Tab.1 Standard curves of various constituents
2.1.4 精密度试验 精密吸取“2.1.3”项下混合对照品溶液适量,在“2.1.2”项色谱条件下重复进样6 次进行测定,每次10 μL,记录峰面积RSD。结果,三七皂苷R1、人参皂苷Rg1、Re、Rb1和Rd 的RSD 值分别为1.31%、1.54%、1.29%、1.63%和1.40%,表明仪器精密度良好。
2.1.5 稳定性试验 精密吸取“2.1.3”项下同一对照品溶液适量,分别于配制后0、2、4、6、8、12、24 h 进样测定,记录峰面积RSD。结果,三七皂苷R1、人参皂苷Rg1、Re、Rb1、Rd 的RSD 值分别为1.61%、1.53%、1.39%、1.86%和1.09%,说明对照品溶液在常温下24 h 内稳定。
2.1.6 重复性试验 精密称取提取物6 份,按“2.1.1”项下方法制备供试品溶液,并在“2.1.2”项色谱条件下测定。结果,以上5 种皂苷含有量的RSD 值分别为1.41%、0.94%、1.76%、1.35%和1.83%,表明该方法重复性良好。
2.1.7 加样回收率实验 精密称取三七皂苷质量分数已知的提取物样品6 份,每份10 mg,分别精密加入混合对照品溶液(三七皂苷R1、人参皂苷Rg1、Re、Rb1、Rd 的质量浓度分别为0.569、2.947、0.432、1.925、0.711 mg/mL)1 mL,加甲醇溶解,定容于10 mL 量瓶中,制备供试品溶液,并在“2.1.2”项色谱条件下测定。结果,三七皂苷R1、人参皂苷Rg1、Re、Rb1、Rd 的平均加样回收率分别为100.1%、98.7%、99.7%、98.9%、99.7%,RSD 值分别为1.89%、1.03%、0.89%、1.98%、1.02%,表明该方法回收率良好。
2.2 试验设计 称取三七药材粗粉适量,按L9(34)正交表,选取乙醇体积分数(A)、物料比(B)和提取时间(C)为考察因素,在120 V 电压下进行闪式提取,以三七总皂苷的含有量和出膏率为考察指标,进行正交试验,因素水平见表2。然后,再称取三七药材适量,在120 V 电压下闪式提取2 次,合并滤液,浓缩至无醇味,用等体积石油醚萃取2 次,收集下层水液,水浴中挥去石油醚,水液用等体积水饱和正丁醇萃取数次,至正丁醇层无色,水浴中挥至无正丁醇味,冷冻干燥,即得三七总皂苷提取物。

表2 因素水平Tab.2 Factors and levels
2.3 正交试验方案及结果 根据L9(34)表安排实验,测定提取物中总皂苷的含有量和出膏率,以上述两个指标的综合评分对结果进行方差分析,见表3 和表4。设定满分为100,权重系数分别为0.7和0.3,计算公式为综合评分= (0.7 ×X/Xmax×100 +0.3 ×Y/Ymax) ×100%,其中X 为提取物中总皂苷含有量,Y 为出膏率[9-10]。由表4 可知,因素A 和B 对结果均有非常显著的差异(P <0.01),三个因素的影响大小顺序是乙醇体积分数>料液比>提取时间。综合以上分析结果,优选出三七总皂苷的闪提最佳工艺是A2B3C1,即加12 倍量70%乙醇,闪式提取1 min。
2.4 验证试验 为验证正交设计试验中最优工艺的重复性和可靠性,用闪式提取最优工艺提取三七,平行3 份,结果见表5,可见其可靠性和重复性良好。
2.5 两种提取方法的比较 根据文献[11-12],设计乙醇回流提取三七总皂苷的最优工艺,即70%乙醇回流提取两次,每次2 h,物料比1 ∶10,结果见表6。由表可知,闪式提取法所得三七总皂苷的量远高于回流提取法,而且提取物的出膏率也略高于后者,表明闪式提取法提取总皂苷的量高于回流提取法。

表3 正交试验设计与结果Tab.3 Design and result of orthogonal experiment

表4 综合评分方差分析Tab.4 Variance analysis of fingerprint

表5 闪式提取优化工艺验证试验Tab.5 Experiment verifying optimized smashing tissue extraction method
表6 闪式提取法和回流提取法的比较(±s,n=3)Tab.6 Comparison between smashing tissue extraction and reflux extraction method (±s,n=3)

表6 闪式提取法和回流提取法的比较(±s,n=3)Tab.6 Comparison between smashing tissue extraction and reflux extraction method (±s,n=3)
注:提取率= (总皂苷提取量/药材中总皂苷量) ×100%
提取方法 乙醇/% 料液比 提取时间/min 总皂苷/ (mg·g -1) 提取率/% 出膏率/%70 1 ∶12 1 651.6 ±10.1 72.60 ±1.13 11.49 ±0.11回流提取闪式提取70 1 ∶10 120 567.3 ±8.4 63.21 ±0.94 11.93 ±0.22
3 讨论
3.1 三七总皂苷提取工艺的比较 本实验采用闪式提取法,对三七提取物中三七皂苷R1和人参皂苷Rg1、Re、Rb1、Rd 进行研究,得出最佳工艺,即加12 倍量70%乙醇,提取1 min。同时,与回流提取法进行对比,发现闪式提取法所得三七总皂苷的含有量高于回流提取法,而且提取效率较高。
3.2 流动相的考察 本实验通过对不同流动相比例和梯度进行考察,发现以水 (A)-乙腈 (B)梯度洗脱(81%A→81%A→64%A→81%A,相应时间周期为0→12 min→60 min→70 min)时,色谱峰的峰形及分离度均良好,而且保留时间适宜。
闪式提取法的主要原理是通过高速机械力对植物组织进行破坏,使有效成分迅速溶出转移,从而达到有效成分快速提取的目的[13-14]。研究表明[15-16],它较于回流提取等传统方法,具有操作简便、快速高效等特点。而且,闪式提取法在室温下操作,可避免高温破坏有效成分,是一种可靠并有发展潜力的提取技术。
[1] 国家药典委员会. 中华人民共和国药典:2010 年版一部[S]. 北京:中国医药科技出版社,2010:11-12.
[2] 黄小平,王 蓓,邱咏园,等. 黄芪甲苷和三七的主要有效成分配伍对小鼠脑缺血再灌注后脑组织能量代谢的影响[J]. 中草药,2014,45(2):220-226.
[3] 赵宗江,张新雪,张学凯,等. 三七总皂苷防治大鼠腺嘌呤肾间质纤维化作用的实验研究[J]. 世界科学技术:中医药现代化,2008,10(2):74-77.
[4] 姜 辉,高家荣,张家富,等. 三七总皂苷对肝纤维化大鼠的保护作用及机制[J]. 中药药理与临床,2013,29(3):71-73.
[5] 谭朝阳,尤昭玲,袁宏佳,等. 三七渗漉提取工艺的研究[J]. 中国中医药信息杂志,2010,17(4):51-52.
[6] 欧小宏,王 晓,杨 雁,等. 正交试验法优选三七皂苷成分超声提取工艺[J]. 中国现代中药,2012,14(4):48-52.
[7] 时圣明,王文倩,袁永兵,等. 三七果中有效成分的闪式提取工艺研究[J]. 药物评价研究,2013,36(2):135-137.
[8] 周 湛,刘延泽. 三七芦头和根须总皂苷的闪式提取及纯化工艺研究[J]. 中国现代中药,2009,11(3):34-36.
[9] 胡晓燕,刘桥春,孙 琴,等. 正交试验法优选板蓝根药材闪式提取工艺[J]. 中国医院药学杂志,2011,31(23):1919-1922.
[10] Shi S M,Liu Y Z,Tai W,et al. Smashing tissue extraction and HPLC determination of active saponins from different parts of Panax notoginseng[J]. Chin Tradit Herb Drugs,2012,4(4):340-344.
[11] 魏凤玲,高 娟. 三七总皂苷含量测定及提取工艺优选[J]. 中国现代应用药学,2008,25(7):623-625.
[12] 瞿林海,郑 明,楼宜嘉,等. 三七总皂苷提取工艺研究[J]. 中药材,2006,29(6):593-595.
[13] 吴冬梅. 闪式提取器在中药研究中的应用[J]. 中国实验方剂学杂志,2006,12(7):34-37.
[14] 刘延泽. 植物组织破碎提取法及闪式提取器的创制与实践[J]. 中国天然药物,2007,5(6):401-407.
[15] 杨炳川,方应权. 马尾松松针总黄酮的闪式提取研究[J].中成药,2014,36(6):1309-1311.
[16] 谢 霞,李 芝,黄玮超,等. 细柱五加茎多糖闪式提取工艺优化及其免疫活性研究[J]. 中草药,2013,44(20):2859-2863.

