减压提取对板蓝根提取液中告依春及核苷类成分热稳定性和药效的影响
兰继平, 王雅琪 , 黄丽琴, 汪 旋, 郑 琴, 杨 明
(江西中医药大学,江西 南昌330004)
板蓝根为十字花科植物菘蓝Isatis indigotica Fort 的干燥根,始载于《神农本草经》,具有清热解毒,凉血利咽之功效,为临床常用的抗病毒中草药[1]。近年来大量药理研究表明,板蓝根的抗病毒机制主要与其生物碱及核苷类成分密切相关,不仅具有免疫调节、抗病毒、消炎抗菌等药理活性[2-3],而且作为广谱抗病毒药物,被用于SARS、流感等疫情的候选药物,正日益受到重视,同时其抑制SARS 病毒的作用已被相关研究证实[4-5]。
红细胞凝集反应是红细胞表面颗粒型凝集原与外源凝集素结合并凝集成团的现象[6],血红细胞表面存在对各种病毒的受体,病毒与受体结合,以红细胞为桥梁,从而引起凝集,如果存在抗病毒成分时,则由病毒所引起的凝集作用将被抑制,故利用此反应可进行抗病毒成分效价的检测。大量文献资料证实,红细胞凝集活性与抑制流感病毒、免疫应答及抗肿瘤相关[7-8],而且该方法与传统神经氨酸酶抑制活性测定结果之间的相关性良好,方法简便、安全[9-12]。
前期实验及文献调研发现,板蓝根提取液中告依春和核苷类成分(化学结构式见图1)存在热不稳定性,传统热回流提取时易降解损失,故前期采取减压提取法,以最大限度保护热敏性成分,避免热分解。为保证后续制剂的稳定有效,本实验一方面通过热稳定性测试,从动力学角度测算中间体溶液的半衰期,而另一方面结合红细胞凝集活性测试,为其工艺研究和质量控制提供多维的评价指标,进一步验证该提取工艺的合理性。
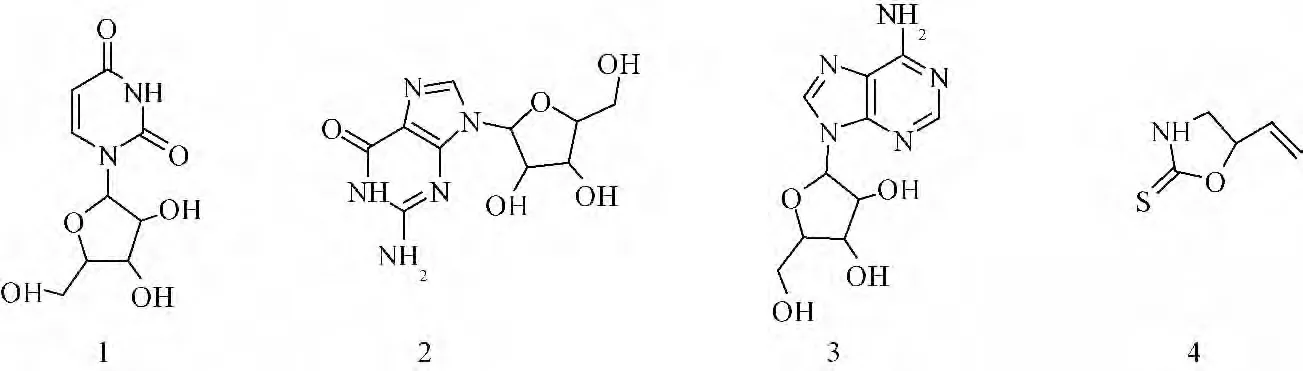
图1 化合物的化学结构Fig.1 Chemical structures of compounds
1 仪器与试剂
Agilent1200 系列HPLC 色谱仪(美国安捷伦公司);TG328A 电子天平(十万分之一,德国Startorious 公司);UV2550 紫外分光光度计(日本岛津公司);V850 压力控制器、Rotavapor R-200 旋转蒸发器(瑞士Buchi 公司);OLYMPUS U-TVIXC电子显微镜(广州市明美科技有限公司);96 孔微量板(V 型、底角呈90°)、TDZ4A-WS 台式离心机(湖南湘仪实验室仪器开发有限公司)。
板蓝根药材(批号1404004,江西樟树天齐堂中药饮片有限公司);尿苷对照品(批号NO. 8-130416,纯度≥98%,50 mg)、鸟苷对照品(批号NO.7-110416,纯度≥98%,50 mg)(中国固体制剂制造技术国家工程研究中心);腺苷对照品(批号X-022-121108,纯度≥98%,50 mg,成都瑞芬思生物科技有限公司);PBS 缓冲液 (批号I110417,北京全式金生物技术有限公司)。水为双蒸水(自制);乙腈、甲醇均为色谱纯(美国Tedia 公司);其他试剂均为分析纯。
2 方法与结果
2.1 供试品溶液的制备
2.1.1 常压回流提取液的制备 参照《中国药典》2010 版一部中板蓝根颗粒的制备工艺,称取板蓝根药材15 g,20 倍量水提取2 次,第1 次2 h,第2 次1 h,提取液过滤后合并,定容于1 000 mL量瓶中,即得。
2.1.2 减压回流提取液的制备 参照前期优选的减压提取工艺条件,按“2.1.1”项下方法,将药材置于减压提取装置中[13],调节体系压力为196 MPa,60 ℃下低温沸腾提取2 次,第1 次2 h,第2 次1 h,提取液过滤后合并,定容于1 000 mL 量瓶中,即得。
2.2 对照品溶液的制备 分别精密称取尿苷、鸟苷、腺苷、告伊春对照品适量,甲醇定容于10 mL量瓶中,摇匀,制成尿苷、鸟苷、腺苷、告伊春质量浓度分别为10.5、10、10、20 μg/mL 的混合对照品溶液,即得。
2.3 色谱条件及方法学考察
2.3.1 色谱条件 Phenomenex Gemini C18色谱柱(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-水(B),梯度洗脱(0 ~10 min,2% A;10 ~20 min,2% ~15%A;20 ~25 min,15% ~100%A;25 ~35 min,100% A);检测波长245 nm;柱温30 ℃;进样量20 μL。
2.3.2 线性关系考察 分别精密量取混合对照品溶液1、3、5、8、10 mL,分别置于10 mL 量瓶中,甲醇定容至刻度线,摇匀,0.45 μm 微孔滤膜滤过,在“2.3.1”项色谱条件下分别进样20 μL,在245 nm 波长处测定其峰面积。然后,以质量浓度(μg/mL)为横坐标(X),峰面积值为纵坐标(Y),进行线性回归,得到尿苷回归方程Y =0.916 1X + 4.290 3 (r=0.999 1)、鸟苷回归方程Y=1.393 7X + 3.769 8 (r =0.999 3)、腺苷回归方程Y=1.656 4X + 10.032 (r =0.999 8)、告伊春回归方程Y=3.514 4X-0.274 1 (r =0.999 6)。结果表明,尿苷在1.05 ~10.50 μg/mL、鸟苷和腺苷在1.00 ~10.00 μg/mL、告伊春在2.00 ~20.00 μg/mL 范围内线性关系均良好。
2.3.3 精密度试验 取供试品溶液适量,注入HPLC 色谱仪,在“2.3.1”项色谱条件下连续测定6 次,每次20 μL,记录峰面积,计算相对标准偏差。结果,尿苷、鸟苷、腺苷、告伊春的峰面积RSD 值分别为0.67%、0.98%、1.03%、0.59%,说明仪器精密度良好。
2.3.4 重复性试验 按照“2.1.2”项下方法,制备供试品溶液6 份,分别进样测定,记录峰面积,计算相对标准偏差。结果,尿苷、鸟苷、腺苷、告伊春的峰面积RSD 值分别为1.32%、2.61%、0.74%、1.09%,说明该方法重复性良好。
2.3.5 稳定性试验 精密吸取供试品溶液适量,分别于0、2、4、6、8、10、12、24 h 进样测定,记录峰面积,计算相对标准偏差。结果,尿苷、鸟苷、腺苷、告伊春的峰面积RSD 值分别为1.72%、1.31%、2.12%、0.79%,说明供试品溶液在24 h内稳定性良好。
2.3.6 加样回收率试验 分别精密称取尿苷、鸟苷、腺苷、告伊春对照品适量,加入含有量已知的供试品溶液中,在“2.3.1”项色谱条件下测定,记录峰面积,计算回收率。结果,这4 种成分的平均回收率RSD 值均小于5.0%,说明该方法回收率良好。
2.4 不同提取工艺中有效成分的比较 分别精密吸取各供试品溶液20 μL,注入HPLC 色谱仪,在“2.3.1”项色谱条件下测定尿苷、鸟苷、腺苷和告伊春的含有量。在常规提取法中,这4 种成分的含有量分别为0.7、0.77、0.57、0.84 mg/g;在减压提取法中,这4 种成分的含有量分别为0.78、1.07、0.8、1.12 mg/g。
与常规提取法相比,减压提取法中尿苷的提取率提高了11.4%,鸟苷的提取率提高了38.9%,腺苷的提取率提高了40.4%,告依春的提取率提高了33.3%,表明该方法的提取效率优于常规提取法,推测可能在减压状态下,一方面,借助一定程度的真空度辅助,可促进药材内部细胞间质药效成分得以快速溶出,加速提取传质过程的进行,提高提取效率;另一方面,加热时对系统抽真空,当达到有效成分溶解最适宜温度所对应的真空度时,溶液即可沸腾,由于此温度低于溶剂本身在常压下的沸点,故可避免药材有效成分受高温破坏,而且,核苷类成分大多含酰胺基团,在高温和酸性条件下易分解。结果证实,减压提取法能显著提高板蓝根中主要有效成分告依春及核苷类成分的提取率,最大限度地保护热敏性有效成分,避免热解。
2.5 热稳定性试验 分别量取各供试品溶液100 mL,每组平行3 次,置于60 ℃水浴中,分别在第0、0.5、1、2、3、5、8、10 天取样(取样前用空白溶剂补足减失质量),离心处理后,0.22 μm 微孔滤膜过滤,在“2.3.1”项色谱条件下进行分析测定,结果见表1。由表可知,随着热处理时间的延长,不同方式板蓝根提取液中告依春及核苷类药效成分的含有量有明显变化,呈下降趋势。经10 d高温处理后,常规提取液中尿苷的含有量下降约30%,而减压提取液中下降约32.1%;鸟苷的含有量下降约22.1%,而减压提取液中下降约9.3%;腺苷的含有量下降约19.3%,而减压提取液中下降约18.7%;告依春的含有量下降约36.9%,而减压提取液中下降约27.7%。
表1 不同方式和时间处理后告依春及核苷类成分的保留率(±s,n=3)Tab.1 Retention rates of epigoitrin and nucleoside by different extraction techniques and heating time (±s,n=3)
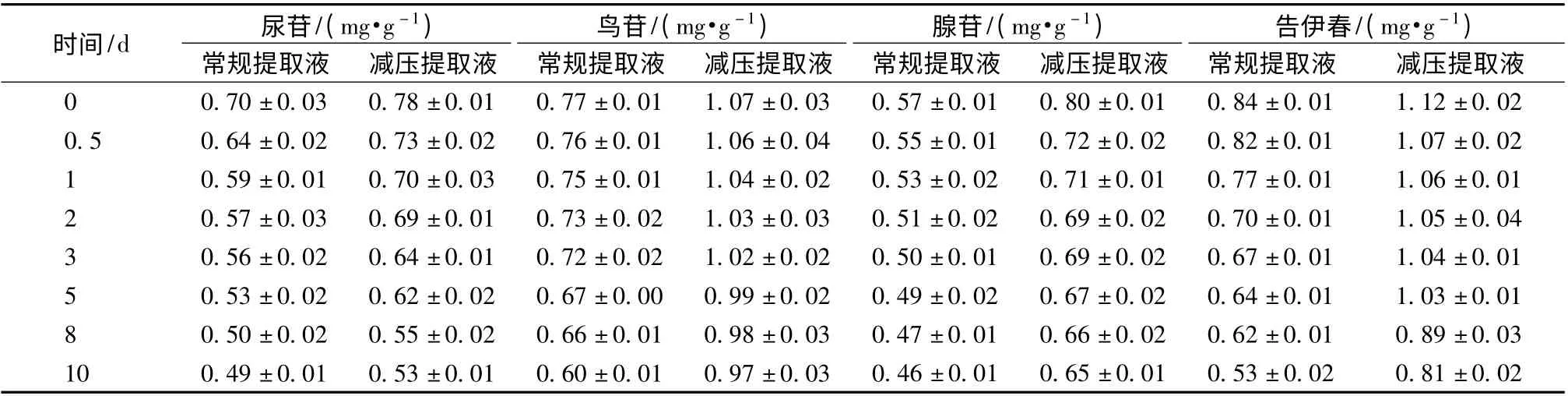
表1 不同方式和时间处理后告依春及核苷类成分的保留率(±s,n=3)Tab.1 Retention rates of epigoitrin and nucleoside by different extraction techniques and heating time (±s,n=3)
时间/d 尿苷/(mg·g -1鸟苷/(mg·g -1))腺苷/(mg·g -1)告伊春/(mg·g -1)常规提取液 减压提取液 常规提取液 减压提取液 常规提取液 减压提取液 常规提取液 减压提取液57 ±0.01 0.80 ±0.01 0.84 ±0.01 1.12 ±0.02 0.5 0.64 ±0.02 0.73 ±0.02 0.76 ±0.01 1.06 ±0.04 0.55 ±0.01 0.72 ±0.02 0.82 ±0.01 1.07 ±0.02 1 0.59 ±0.01 0.70 ±0.03 0.75 ±0.01 1.04 ±0.02 0.53 ±0.02 0.71 ±0.01 0.77 ±0.01 1.06 ±0.01 2 0.57 ±0.03 0.69 ±0.01 0.73 ±0.02 1.03 ±0.03 0.51 ±0.02 0.69 ±0.02 0.70 ±0.01 1.05 ±0.04 3 0.56 ±0.02 0.64 ±0.01 0.72 ±0.02 1.02 ±0.02 0.50 ±0.01 0.69 ±0.02 0.67 ±0.01 1.04 ±0.01 5 0.53 ±0.02 0.62 ±0.02 0.67 ±0.00 0.99 ±0.02 0.49 ±0.02 0.67 ±0.02 0.64 ±0.01 1.03 ±0.01 8 0.50 ±0.02 0.55 ±0.02 0.66 ±0.01 0.98 ±0.03 0.47 ±0.01 0.66 ±0.02 0.62 ±0.01 0.89 ±0.03 10 0.49 ±0.01 0.53 ±0.01 0.60 ±0.01 0.97 ±0.03 0 0 0.70 ±0.03 0.78 ±0.01 0.77 ±0.01 1.07 ±0.03 0..46 ±0.01 0.65 ±0.01 0.53 ±0.02 0.81 ±0.02
2.6 热降解动力学分析 告依春及核苷类成分的保留率可看做其在溶液中的降解反应,按照积分法来求热解反应动力学方程及反应级数,而且文献表明,在储藏过程中,大多数与质量有关的品质变化都遵循零级或一级反应动力学规律[14]。根据化学动力学中的Arrhenius 公式,绘制反应动力曲线,得到动力学方程,推算其速率常数及半衰期,结果见表2。从表可知,不同温度下热处理方程的线性关系均良好(r >0.9),表明回归方程具有较高的拟合度,并表现出一级反应特征。而且,常规提取液中反应速率常数(K)普遍高于减压提取液,说明这些成分在较高温度下长时间受热时,易发生降解,同时前者中各指标成分的热降解速度明显高于后者,而后者的热稳定性优于前者,提示在生产过程中应尽量避免高温处理,低温有利于保持其稳定性。综上所述,减压(低温沸腾)提取有助于延长热敏性有效成分的半衰期,增加药液贮存期,保持药物稳定性。
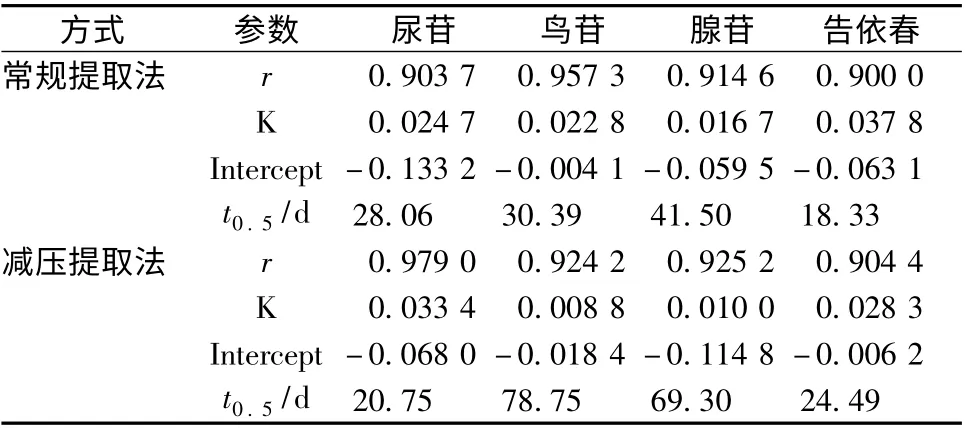
表2 不同方式提取液中化学动力学参数Tab.2 Kinetic parameters of epigoitrin and nucleoside by different extraction techniques
2.7 红细胞凝集活性测试 研究表明,板蓝根抑制流感病毒作用的强弱与其红细胞凝集活性成正比,因此通过红细胞凝集试验,可表征板蓝根抗病毒作用的效果,并应用于其药效评价和质量控制。据此,本实验建立基于红细胞凝集活性检测的板蓝根药效考察方法。
2.7.1 红细胞凝集样品溶液的制备 分别取按“2.1”项下方法制成的不同方式供试品溶液100 mL,减压浓缩至干,加PBS 缓冲液20 mL 溶解,无菌过滤,滤液置于4 ℃冰箱中保存备用,即得。
2.7.2 红细胞凝集活性检测 参照文献[9] 报道的方法,在V 型、底脚成90°的96 孔微量板上,PBS 缓冲液将供试品溶液稀释2 倍,分别加入不同浓度的提取液50 μL,注入微量板中,平行2 束,在每排最后一孔中加入PBS 缓冲液50 μL,作为阴性对照,再向每孔中加入1%兔红细胞混悬液50 μL,轻拍微量板,4 ℃下静置2 h 后观察结果。
2.7.3 红细胞凝集活性判断标准与效价计算 参照文献[9]判定凝集结果,将微量板置于白色背景上,将供试品孔与阴性对照孔进行比较,红细胞沉于底部成一规则的圆点,而孔壁未粘有红细胞者判为阴性(-);孔壁上均匀附着一层红细胞,或红细胞未全部沉于底部,部分附着于孔壁上者判为阳性(+),以供试品出现阳性的最高稀释倍数为判定终点,若同批供试品溶液前后排结果相差1 个以上稀释度时应重试,而相差1 个时,则以两排结果中出现阳性反应较少的稀释度为本品的判定终点。然后,计算各样品的凝集效价,计算公式为U=n-Log2C,其中U 表示每1 g 供试品中含凝集活性单位的量;n 表示出现阳性反应的最高稀释倍数;C 表示供试品溶液的初始质量浓度(g/mL),两种不同方式提取液的红细胞凝集效价结果见表3,显微示意图见图2。结果,所测样品均呈阳性反应,即不同方式的提取液均具有一定程度的抗病毒活性,而且减压提取液的红细胞凝集效价大于常规提取液,与效应成分变化规律一致,进一步证实由于长时间热处理可能加速效应成分(告依春及核苷类)的降解损失过程,导致其含有量下降,药效降低。

表3 不同方式提取液红细胞凝集活性检测数据结果Tab.3 Determination result of hemagglutination activity by different extraction techniques
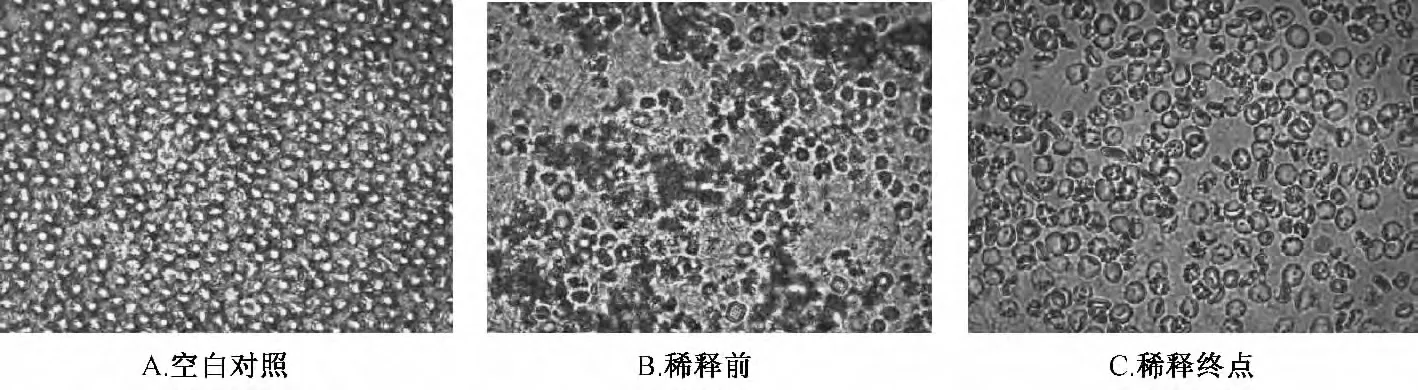
图2 不同方式提取液红细胞凝集活性显微示意图(放大倍数:40 ×10)Fig.2 Observation of hemagglutination activity by different extraction techniques (Image Magnification:40 ×10)
3 讨论
文献表明,告伊春及核苷类成分为板蓝根制剂中主要的抗病毒有效成分[15-16],而其大多含有酰胺基团,在高温和酸性条件下易分解,导致有效成分的保留率下降。传统板蓝根制剂往往要经历漫长的热处理过程,而指标性成分的热稳定性将直接关系到中药生产过程信息链的传递,故将严重影响后续制剂的质量和临床疗效。本实验前期采用减压提取法,在保证体系负压的状态下进行回流提取,达到药效成分溶解最适温度所对应的真空度时,溶液即可沸腾,一方面可避免药效成分受热降解,而另一方面可降低体系压力。在气压和温度的同时作用下,溶剂内部分子不断汽化,气泡迅速升腾膨胀,不断向四周稀溶液主体扩散,加速传质扩散过程,进一步提高提取效率。通过比较不同方式提取液的热稳定性,结合药效学试验,发现对板蓝根药材采用低温沸腾减压提取法时,与常规提取法相比,可增加效应成分的提取率、减缓受热降解的速度、延长中间体药液的储存期和最终产品的有效期,以及提高药效学活性等。
本实验通过对不同方式提取液热稳定性的平行比较,结合药效分析,考察了减压提取技术应用于板蓝根制剂的合理性,可为其综合开发利用提供参考。实验结果表明,减压提取法对含热敏性成分药材的提取具有广泛的应用前景。
[1] 国家药典委员会. 中华人民共和国药典:2010 年版一部[S]. 北京:中国医药科技出版社,2010:964.
[2] Chung Y C,Tang F Y,Liao J W,et al. Isatis indigotica induces hepatocellular cancer cell death via caspase-independent apoptosis-inducing factor translocation apoptotic pathway in vitro and in vivo[J]. Integr Cancer Ther,2011,10(2):201-214.
[3] Mak N K,Leung C Y,Wei X Y,et al. Inhibition of RANTES expression by indirubin in influenza virus-infected human bronchial epithelial cells[J]. Biochem Pharmacol,2004,67(1):167-174.
[4] Lin C W,Tsai F J,Tsai C H. Inhibition of SARS coronavirus 3C-like protease by Isatis indigotica root and plant-derived phenolic compounds[J]. Int J Antimicrob Agents,2005,26(S1):S79.
[5] Lin C W,Tsai F J,Tsai C H,et al. Anti-SARS coronavirus 3C-like protease effects of Isatis indigotica root and plant-derived phenolic compounds[J]. Antiviral Res,2005,68(1):36-42.
[6] 任永申,鄢 丹,张 萍,等. 基于微量量热法检测板蓝根的血红细胞凝集活性的评价研究[J]. 药学学报,2010,45(8):1028-1034.
[7] 宋振玉,刘耕陶. 当代药理学[M]. 北京:人民卫生出版社,1997:408-409.
[8] 孙秀霞,张丽莉,孙翠兰. 板蓝根抗病毒有效部位研究[J]. 中国药理学通报,2007,23(6):835-836.
[9] 唐慧英,鄢 丹,张少峰,等. 基于凝集活性检测的板蓝根颗粒质量生物测定方法研究[J]. 药学学报,2010,45(4):479-483.
[10] 孙 琴,马 丽,李 兰,等. 板蓝根中红细胞凝集效应组分的谱效关系研究[J]. 中草药,2012,43(1):125-130.
[11] 李寒冰,鄢 丹,武彦舒,等. 基于抗病毒活性检测的板蓝根质量生物评价方法及优化研究[J]. 中草药,2011,42(8):1560-1565.
[12] 罗 君,王惟惟,赵琳珺,等. 贵州南板蓝根提取成分对红细胞凝集的影响[J]. 时珍国医国药,2014,25(7):1607-1608.
[13] Wang Y Q,Wu Z F,Ke G,et al. An effective vacuum assisted extraction method for the optimization of labdane diterpenoids from Andrographis paniculata by response surface methodology[J]. Molecules,2014,20(1):430-435.
[14] Lu M J,Chen C. Enzymatic modification by tannase increases the antioxidant activity of green tea[J]. Food Res Int,2008,41(2):130-137.
[15] 安益强,贾晓斌,陈 彦,等. HPLC-DAD 法测定板蓝根药材及其制剂中主要抗病毒生物碱含量[J]. 中成药,2009,31(5):733-736.
[16] 何立巍,吴晓培,杨婧妍,等. 板蓝根总生物碱的提取纯化工艺及其抗病毒药理作用研究[J]. 中成药,2014,36(12):2611-2614.

