华法林个体化给药研究进展
赵 颖 杜海燕 仇 琪 谭 莉 刘文芳 淳泽利 董 然 林 阳
1.首都医科大学附属北京安贞医院临床药理中心,北京 100029;2.沈阳药科大学药学院,辽宁沈阳 110016;3.首都医科大学附属北京安贞医院心外科,北京 100029
华法林是香豆素类口服抗凝药, 在临床上被广泛使用,但其治疗窗狭窄,个体差异大,剂量过低达不到抗凝效果,剂量过高增加出血的风险,甚至会危及生命。影响华法林药效的因素主要有年龄、身体指标、维生素K 的摄入量、疾病状况、药物相互作用、吸烟及基因多态性等,这些因素能够解释华法林剂量差异的40%~60%[1]。 临床常以凝血酶原时间(PT)及国际标准化比率(INR)作为其抗凝监测指标(要求INR 值在2~3 之间)[2]。 近年来国内外对影响华法林个体化剂量相关的基因多态性及华法林剂量预测模型的研究不断深入。本文将对影响华法林剂量的基因多态性和华法林剂量预测模型进行综述,以期为更全面剂量预测模型的建立提供借鉴,为临床华法林个体化治疗提供理论依据。
1 基因多态性对华法林剂量的影响
相关研究发现,多个基因与华法林的个体化治疗剂量有关,其中,与华法林药动学(pharmacokinetics,PK)相关的基因有:CYP2C9、ABCG2、ABCB1 等;药效学(pharmacodynamics,PD)相关的基因有:VKORC1、NQO1、CYP4F2 和ApoE 等。
1.1 CYP2C9、ABCB1 和ABCG2 基因
目前临床上使用的华法林是由S-对映体和R-对映体组成的外消旋体化合物,且S-对映体的抗凝活性是R-对映体的2~5 倍。 S-对映体主要由CYP2C9 代谢,少部分由CYP2C19 和CYP3A4 代谢,R-对映体主要由CYP1A2 代谢,少部分由CYP3A4代谢[3-4]。 Mazzaccara 等[1]研究了266 例意大利患者,发现基因型为CYP2C9*1/*3、*2/*3 和*3/*3 的患者所需华法林的剂量小于其野生型等位基因,剂量分别为(22.03±8.80)、(13.4±10.10)、(9.74±3.25)mg/周和(32.11±13.98)mg/周。这与Hillman 等[5]得到的研究结果相似。 武建才等[6]研究发现中国人群中CYP2C9*3(-1075A>C)基因的AC和CC 基因型患者所需华法林日均稳定剂量较AA 型降低了19.5%。
最近的研究发现,华法林的药动学受肠内转运蛋白的影响。 ABC(ATP-binding cassette)跨膜转运蛋白超家族存在于小肠、 肝脏和肾脏的跨膜转运体系,被认为是影响华法林药动学的主要因素之一。 ABC 跨膜转运蛋白家族由7 个子家族构成, 即ABCAABCG,大多ABC 蛋白为膜蛋白,这些转运蛋白主要由ABCB1 基因和ABCG2 基因编码。 ABCB1 基因编码的P-糖蛋白(P-glycoprotein,P-gp)位于肝细胞、小肠上皮细胞顶膜及近端小管刷状缘,负责将外缘性物质转运出细胞。 ABCG2 基因编码的乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)位于细胞质膜上,也存在于细胞内囊泡膜上。 P-糖蛋白与BCRP 均属于外排转运蛋白,能将药物排出细胞,影响药物吸收, 降低生物利用度, 并增加药物吸收的个体差异。ABCB1 基因和ABCG2 基因的突变能够影响转运蛋白的表达,从而影响华法林的吸收。近年来,有研究表明:ABCB1 基因C3435T 位点多态性与ABCB1 基因的表达水平有关, 从而影响华法林在体内的吸收、代谢、排泄等。基因型为T3435T、C3435T 和C3435C 所需华法林的剂量分别为43.0、39.0 mg/周和33.0 mg/周[7]。ABCG2 基因421C>A 的突变能够降低BCRP 蛋白的表达水平,从而降低BCRP 的转运能力。 Ferrari 等[8]研究发现,ABCG2-421A 等位基因的突变能使华法林的转运降低,减少华法林转运出细胞,并且能够增加与其他转运底物之间的作用, 能够改变维生素K 的摄取,从而减少到达有效范围所需的时间。
1.2 VKORC1、NQO1、CYP4F2 和ApoE 基因
维生素K 环氧化物还原酶是维生素K 依赖性凝血因子生成的限速酶。华法林因抑制该酶而阻断了维生素K 以辅因子的形式参与羧化酶的催化反应,抑制了凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的功能活性,从而产生抗凝作用[9]。 维生素K 环氧化物还原酶复合体亚单位1 基因(VKORC1)的多态性与华法林临床应用剂量个体化有关。Mazzaccara 等[1]研究发现,VKORC1-1639G>A 所需华法林的剂量低于野生型, 而VKORC1-3730G>A 的剂量大于野生型。 李胜军等[10]通过基因检测发现, 当VKORC1-1639 位G 基因突变后,其转录活性下降,抵抗华法林的能力降低,从而影响华法林的药效;VKORC1-1639 的变异型(GA 型和AA型)与野生纯合型(GG 型)比较,所需华法林的剂量显著减少,这与在白种人群中的研究结果相反。 Tatsuno等[11]研究发现,VKORC1 基因纯合子A/A 需要的华法林剂量比非A/非A 少50%,杂合子A/非A 需要的华法林剂量比非A/非A 少26%。
醌氧化还原酶 (quinone oxido-reductase,NQO1)是一种黄素酶,它以NAD(P)H 为受体,催化醌双电子还原反应。 有研究发现,NQO1 可能参与维生素K到氢醌维生素K 的还原反应,影响维生素K 的循环,从而影响凝血过程。 NQO1 基因突变后,影响该酶活性,从而影响华法林剂量。 Bress 等[12]对西班牙裔美国人和非裔美国人研究发现,突变纯合子中NQO1 没有活性,杂合子中酶的活性低于野生型,华法林稳定剂量在NQO1*2 等位基因中提高34%。 但Momary 等[13]对非裔美国患者群体研究得出不同的结果, 发现NQO1*1/*2 基因对华法林剂量的影响不明显。
CYP4F2 属于CYP 家族,参与维生素K1代谢,其突变导致酶活性下降,维生素K1浓度增加,从而使华法林剂量增加。 Wypasek 等[14]研究发现,在CYP4F2c.1297A>G 的不同基因型中华法林的剂量不同,GG:35.0 mg/周,GA:42.0 mg/周,AA:52.2 mg/周; 携 带CYP4F2c.1297A 变异型基因需要的华法林剂量高于野生型。 然而,Hirai 等[15]研究发现,CYP4F2 基因多态性与华法林的个体化剂量相关性不大,仅能解释个体化的2.2%。 张亚同等[16]对CYP4F2c.1297A>T 基因多态性与华法林抗凝作用之间的相关性进行研究,发现中国人群CYP4F2 基因的不同基因分型组间华法林剂量未见显著性差异,但是携带T 突变的患者华法林稳定剂量有逐步升高的趋势。
载脂蛋白E(Apo lipoprotein E,ApoE)是血浆中的载脂蛋白之一,它广泛存在于乳糜微粒、极低密度脂蛋白、低密度脂蛋白及高密度脂蛋白中,对肝脏摄入维生素K 有影响,通过影响维生素K 的循环途径,对华法林的抗凝治疗剂量产生影响。 ApoE 基因共有3 种主要的亚型, 其相应的编码基因分别为ε2、ε3、ε4。 Cavallari 等[17]在非裔美国人群中研究发现,ApoE的基因型为ε3 的患者到达稳定剂量所需时间比基因型为ε2 或ε4 的长。 但我国李佳佳[18]对皖南地区汉族人群中ApoE 基因型与华法林剂量的相关性进行研究发现,不同基因型的华法林稳定剂量略有不同,但差异无统计学意义,ApoE 的基因多态性可能不是华法林用药剂量个体差异的主要因素。
2 华法林剂量预测模型
华法林治疗窗窄,剂量个体差异大,容易发生出血或栓塞的不良反应, 临床上根据INR 值来调整华法林的剂量需要数周的时间,不能有效避免不良反应的发生。 因此,国内外学者致力于对华法林个体化剂量预测模型的研究以促进患者获得满意疗效的同时减少不良反应的发生。 目前,建立的华法林剂量预测模型主要有两种,一是基于基因多态性和各种相关临床因素建立的剂量预测模型, 二是基于群体药动学(population pharmacokinetics,PPK)/群体药效学(population pharmacodynamics,PPD) ( 以 下 简 称 PPK/PPD), 纳入基因多态性和临床因素建立的剂量预测模型。
2.1 基于临床因素合并基因多态性的剂量预测模型
华法林的个体差异大,其影响因素包括患者的年龄、身高、体重、疾病状态、合并用药和基因多态性等。国内外已发表了数十个基于临床因素合并基因多态性的华法林剂量预测模型, 可解释约60%的剂量差异。华法林临床因素合并基因多态性的剂量预测模型研究见表1。
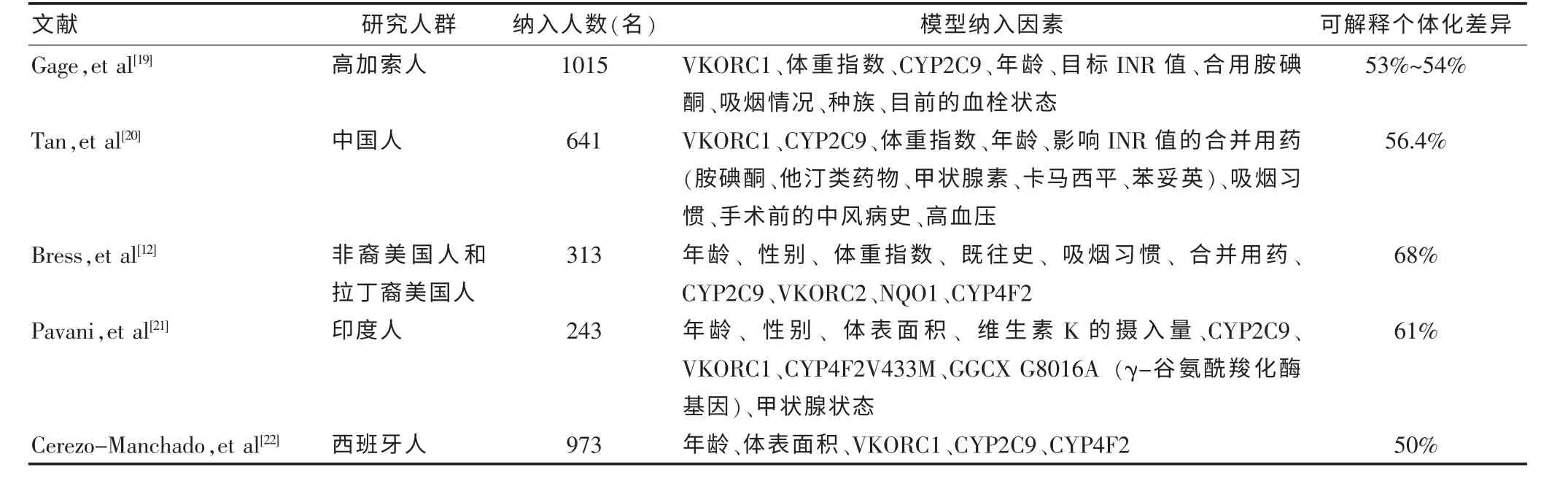
表1 华法林临床因素合并基因多态性的剂量预测模型研究
临床因素合并基因多态性因素所建立的剂量预测模型其准确度高于只基于临床因素所建立的剂量预测模型。 例如,华法林国际药理联盟(IWPC)[23]建立剂量预测模型(IWPC 模型),其与只基于临床因素的剂量预测模型相比,该模型预测准确度更高,即在低剂量人群中高于实际给药剂量的比例分别为59.7%和74.8%;在高剂量人群中达到理想剂量范围内的比例分别为32.8%和13.3%。 Bazan 等[24]利用63 例使用华法林治疗的埃及患者信息,比较了Gage 模型、IWPC模型及每天5 mg 经验给药的三种给药方式; 研究发现,Gage 模型的R2为0.421,绝对误差为3.3,IWPC 模型的R2为0.419,绝对误差为3.2,其准确度均高于经验给药(绝对误差为3.9)。 在我国大陆,娄莹[25]纳 入322 例 患 者 的 年 龄、 体 重、 身 高、VKORC1、CYP2C9、CYP4F2、 合并用药等因素建立剂量预测模型,其中,60.6%的患者预测剂量达到理想剂量。
2.2 基于群体药动学/药效学(PPK/PPD)的相关性因素分析及剂量预测模型
以往的研究均是基于临床因素联合基因多态性建立华法林的剂量预测模型, 随着研究的不断深入,群体药动学和群体药效学相结合成为新的研究方向。PPK/PPD 即PK/PD 的群体分析方法, 将经典的PK、PD 或PK-PD 链式模型与群体统计学模型相结合,定量考察患者群体中血药浓度和效应的决定因素,研究个体之间血药浓度、药物效应的变异性,是临床药物治疗学中优化个体给药方案的重要手段,能够分析患者群体中的个体差异[26]。 PPK/PPD 的研究对象是患有相关疾病需研究药物治疗的患者,研究样本采用稀疏采集的方法,受试者的依从性较好。 PPK/PPD 通过强力的分析手段可以揭示进入体内后药物与机体间较深层次的各种相互关系。 患者的年龄、体重、基因型、性别、疾病状态、合并用药为群体药动学中的协变量。个体化给药方案是充分了解个体的这些协变量对PK/PD 的影响,根据群体药动学特征来优化药物治疗方案,达到最佳药效和减少不良反应的目的[27]。 在华法林PPK/PPD 研究基础上纳入临床因素, 同时结合基因多态性建立模型,可以用来分析不同因素对华法林在体内的代谢、 清除等的影响及对个体化的贡献,与基于基因多态性合并临床因素的模型相比,可以更直观地表达出不同因素对华法林作用的影响,使实验数据更具有说服力。
Hamberg 等[28]利用PPK/PPD 模型更好的预测了年龄、CYP2C9、VKORC1 等对华法林个体化剂量的影响。 研究显示:加入年龄的协变量后对S-华法林清除率差异的解释,由31%上升到34%,加入CYP2C9 基因后,由31%升高到50%;此外,发现影响R-华法林清除率的因素只有年龄, 加入后对差异的解释由25.5%升高到26.2%, 并且年龄每增加10 岁,S-华法林清除率减少9%,R-华法林清除率减少10%; 对年龄为50、70、90 岁的 患者加入CYP2C9 和VKORC1基因后进行了剂量的预测,发现高剂量与低剂量组相差接近20 倍。 Gong 等[29]收集了167 例接受华法林治疗的患者数据,建立了PPK/PPD 模型,用回归方法分析了CYP2C9 基因型、肾功能、性别对S-华法林清除率的影响,S-华法林的清除率范围为0.8~20.8, 个体间相差20 倍, 其最主要的影响因素是CYP2C9 基因的多态性; 此外女性的清除率低于男性; 还分析了VKORC1 基因型、CYP4F2 基因型、 体内维生素K 水平及体重对华法林药效的影响,VKORC1 基因至少有一个-16939G>A 等位基因的血药浓度要低于野生型,基因型为VKORC1 A/A、G/A 和G/G 的S-华法林的血药浓度分别0.291、0.347 ng/mL 和0.503 ng/mL。Ohara 等[30]利用PPK/PPD 模型研究亚洲患者中华法林过度抗凝的决定性因素发现:CYP2C9*3 变异性对清除率的影响大于体表面积,VKORC1*2 变异性对半抑制浓度的影响大于CYP4F2*3;S-华法林清除率减小,谷丙转氨酶值增高,高血压,深静脉血栓都会增大INR 值。
Sasaki 等[31]利用PPK/PPD 所建立的剂量预测模型与其他模型相比预测的稳定剂量与实际剂量具有更好的相关性(R2=0.944)与准确度。此外,Salinger 等[32]用PPK/PPD 模型合并基因多态性的剂量预测模型与基本模型相比能够使患者更快到达有效的INR 值范围。Biss 等[33]用已发表的成人的PPK/PPD 模型桥接到儿童患者中,发现在64 例瑞典患儿中使用此模型与已发表的儿童预测模型相比较,具有更高的准确性;将患儿3 次的INR 值用到桥接的模型中所得到的优化剂量落入实际剂量±20%范围内的比例上升到70%。在我国林荣芳[34]利用非线性混合效应模型(NONlinear Mixed Effects Model,NONMEM)软件定量考察患者性别、年龄、体重、CYP2C9 及VKORC 基因分型、疾病状况、合并用药及随机变异等对华法林血药浓度与INR的影响,建立华法林PPK/PPD 模型,研究结果显示,基于NONMEM 法建立的华法林PPK/PPD 模型稳定、有效,具有良好的拟合优度与预测能力,可为临床个体化给药提供参考。
3 展望
华法林临床应用的个体差异受很多因素的影响,研究引起这些差异的相关因素, 实现个体化治疗,是临床亟待解决的问题。目前国内外对影响华法林剂量的基因多态性及临床因素的研究能够解释40%~60%的剂量差异, 但仍有将近40%的剂量差异无法解释。此外,无论是基于临床因素的剂量预测模型还是基于临床因素合并基因多态性的剂量预测模型,对中剂量的预测准确度较高,但对低剂量和高剂量的准确度普遍较低。 在华法林的PPK/PPD 模型研究中发现,利用PPK/PPD 参数及不同协变量的加入能够解释更多的剂量差异。国外已有联合PPK/PPD、基因多态性、临床因素的剂量预测模型, 但由于不同种族存在差异,所以仍需建立适合中国人群的剂量预测模型。目前国内的研究存在纳入的样本数量小、 协变量不足等问题,具有一定的局限性。笔者所在课题组利用北京安贞医院丰富的病例资源, 正在开展基于药物基因组学、临床因素的群体药动学/药效学研究, 拟建立适合我国北方地区汉族换瓣术后患者华法林PPK/PPD 模型。以期建立更精准的华法林剂量预测模型,以便更好地指导其个体化用药, 从而使临床用药更具有针对性、高效性和安全性。
[1] Mazzaccara C,Conti V,Liguori R,et al. Warfarin anticoagulant therapy: a Southern Italy pharmacogenetics-based dosing model [J]. PLoS One,2013,8(8):e71505.
[2] Bosch LA. A Proposal for an individualized Pharmacogenetic-Guided Warfarin Dosage Regimen for Puerto Rican Patients Commencing Anticoagulation Therapy[J]. J Pharmacogenomics Pharmacoproteomics,2014,5(1):T-001.
[3] Ouellet D,Bramson C,Carvajal-Gonzalez S,et al. Effects of lasofoxifene on the pharmacokinetics and pharmacodynamics of single-dose warfarin [J]. Br J Clin Pharmacol,2006,61(6):741-745.
[4] Miller GP,Jones DR,Sullivan S,et al. Assessing cytochrome P450 and UDP-glucuronosyltransferase contributions to warfarin metabolism in humans [J]. Chem Res Toxicol,2009,22(7):1239-1245.
[5] Hillman MA,Wilke RA,Yale SH,et al. A Prospective,randomized pilot trial of model-based warfarin dose initiation using CYP2C9 genotype and clinical data [J]. Clin Med Res,2005,3(3):137-145.
[6] 武建才,赵克斌,胡敏,等.CYP2C9 和VKORC1 基因多态性对华法林稳定剂量的影响[J].中西医结合心血管病杂志,2013,11(4):465-467.
[7] De Oliveira Almeida VC,De Souza Ferreira AC,Ribeiro DD,et al. Association of the C3435T polymorphism of the MDR1 gene and Therapeutic doses of warfarin in thrombophilic patients [J]. J Thromb Haemost,2011,9(10):2110-2012.
[8] Ferrari M,Romualdi E,Dentali F,et al. Association between ABCG2 and ABCB1 genes and warfarin stability:a case-control study [J]. Thromb Res,2014,134(6):1359-1362.
[9] Dingemanse J,Hoever P. Absence of pharmacokinetic and pharmacodynamic interactions between almorexant and warfarin in healthy subjects [J]. Drugs R D,2013,13(2):145-151.
[10] 李胜军,盛红专.CYP2C9 和VKORC1 基因多态性与华法林抗凝剂量的研究[J].天津医药,2010,38(8):670-673.
[11] Tatsuno SY,Tatsuno EM. Does ethnicity play a role in the dosing of warfarin in Hawai'I [J]? Hawaii J Med Public Health,2014,73(3):76-79.
[12] Bress A,Patel SR,Perera MA,et al. Effect of NQO1 and CYP4F2 genotypes on warfarin dose requirements in Hispanic-Americans and African-Americans [J]. Pharmacogenomics,2012,13(16):1925-1935.
[13] MomaryKM,ShapiroNL,VianaMA,etal.Factors influencing warfarin dose requirements in African-Americans [J].Pharmacogenomics,2007,8(11):1535-1544.
[14] Wypasek E,Branicka A,Awsiuk M,et al. Genetic determinants of acenocoumarol and warfarin maintenance dose requirements in Slavic population:a potential role of CYP4F2 and GGCX polymorphisms [J]. Thromb Res,2014,134(3):604-609.
[15] Hirai K,Yamada Y,Hayashi H,et al. Plasma vitamin K concentartion depend on CYP4F2 polymorphism and influence on anticoagulation in Japanese patients with warfarin therapy [J]. Thromb Res,2015,135(5):861-866.
[16] 张亚同,梁欣,董凡,等.中国人群CYP4F2 基因多态性对华法林剂量作用的影响[J].中国临床治疗杂志,2014,12(1):41-45.
[17] Cavallari LH,Butler C,Langaee TY,et al. Association of apolipoprotein E genotype with duration of time to achieve a stable warfarin dose in African-American patients [J]. Pharmacotherapy,2011,31(8):785-792.
[18] 李佳佳.APOE 基因多态性与华法林应用剂量相关性的研究[D].芜湖:皖南医学院,2014.
[19] Gage BF,Eby C,Johnson JA,et al. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin [J]. Clin Pharmacol Ther,2008,84(3):326-331.
[20] Tan SL,Li Z,Song GB,et al. Development and comparison of a new personalized warfarin stable dose prediction algorithm in Chinese patients undergoing heart valve replacement [J]. Pharmazie,2012,67(11):930-937.
[21] Pavani A,Naushad SM,Mishra RC,et al. Retrospective evidence for clinical validity of expanded genetic model in warfarin dose optimization in a South Indian population [J]. Pharmacogenomics,2012,13(8):869-878.
[22] Cerezo-Manchado JJ,Rosafalco M,Anton Al,et al. Creating a genotype -based dosing algorithm for acenocoumarol steady dose [J]. Thromb Haemost,2013,109(1):146-153.
[23] Klein TE,Altman RB,Eriksson N,et al. Estimation of the warfarin dose with clinical and pharmacogenetic data[J]. N Engl J Med,2009,360(8):753-764.
[24] Bazan NS,Sabry NA,Rizk A,et al. Validation of pharmacogenetic algorithms and warfarin dosing table in Egyptian patients [J]. Int J Clin Pharm,2012,34(6):837-844.
[25] 娄莹.中国汉族人群华法林稳定剂量预测模型的建立与验证[D].北京:协和医学院,2009.
[26] 郭仙忠,王长连.群体药动学/药效学原理及应用[J].海峡药学,2010,22(7):14-18.
[27] 张弨,赵荣生,翟所迪,等.群体药代动力学概述[J].中国临床药理学杂志,2013,29(8):563-565.
[28] Hamberg AK,Dahl ML,Barban M,et al. A PK-PD model for predicting the impact of age,CYP2C9,and VKORC1 genotype on individualization of warfarin therapy [J]. Clin Pharmacol Ther,2007,81(4):529-538.
[29] Gong IY,Schwarz UI,Crown N,et al. Clinical and genetic determinants of warfarin pharmacokinetics and pharmacodynamics during treatment initiation [J]. PLoS One,2011,6(11):e27808.
[30] Ohara M,Takahashi H,Lee MT,et al. Determinants of the over-anticoagulationresponse during warfarin initiation therapy in Asian patients based on population pharmacokinetic pharmacodynamic analyses [J]. PLoS One,2014,9(8):e105891.
[31] Sasaki T,Tabuchi H,Higuchi S,et al. Warfarin dosing algorithm based on a population pharmacokinetic/pharmacodynamic model combined with forecasting [J]. Pharmacogenomics,2009,10(8):1257-1266.
[32] Salinger DH,Shen DD,Thummel K,et.al. Pharmacogenomic trial design: use of a PK/PD model to explore warfarin dosing interventions through clinical trial simulation [J]. Pharmacogenet Genomics,2009,19(12):965-971.
[33] Biss T,Hamberg AK,Avery P,et al. Warfarin dose prediction in children using pharmacometric bridging-comparison with published pharmacogenetic dosing algorithms [J]. Br J Clin Pharmacol,2013,69(9):1275-1283.
[34] 林荣芳.基于非线性混合效应模型法的华法林PK/PD模型的建立[D].福州:福建医科大学,2014.

