Na+吸收对干旱导致的棉花叶片光合系统损伤的缓解作用
解卫海, 马淑杰, 祁 琳, 张振华, 柏新富,*
1 鲁东大学生命科学学院, 烟台 264025 2 鲁东大学地理与规划学院, 烟台 264025
Na+吸收对干旱导致的棉花叶片光合系统损伤的缓解作用
解卫海1, 马淑杰1, 祁 琳1, 张振华2, 柏新富1,*
1 鲁东大学生命科学学院, 烟台 264025 2 鲁东大学地理与规划学院, 烟台 264025
以盆栽棉花为材料,在植株高约20 cm时用不同浓度NaCl溶液浇透后进行持续干旱处理。在干旱处理期间测定叶片叶绿素荧光参数、光合气体交换参数的变化以及植株水分状况和Na+含量,以分析土壤NaCl施入引起的棉花Na+吸收和积累量的增加对干旱胁迫导致的叶片光合系统损伤的缓解作用及可能原因。结果表明,未用NaCl处理的棉花植株,其叶片净光合速率随着干旱的延续而持续下降、光合机构在干旱处理后期出现了严重损伤;而NaCl处理的棉花植株,其叶片净光合速率下降幅度明显小于未用NaCl处理的,光合机构受损伤程度也较轻或无明显损伤。对各处理棉花植株Na+的吸收和水分状况的测定分析表明,NaCl处理的植株,其叶片Na+积累显著增加、渗透势降低,细胞膨压显著高于未用NaCl处理的植株。由此可见,在土壤浇灌NaCl溶液后的持续干旱条件下,棉花植株吸收和积累Na+增加,降低了组织渗透势、维持了一定的细胞膨压,从而有效缓解了干旱胁迫对叶片光合机构的损伤。
棉花; Na+; 干旱; 光系统Ⅱ光化学效率; 气体交换
旱、盐等非生物胁迫是影响植物生长发育、引起农作物减产的主要环境因子[1],其中又以干旱造成的损失最大,损失量超过其它逆境造成损失的总和[2-3]。干旱引起植物水分平衡失调,进而引起代谢紊乱、生长被抑制、光合速率降低等[4]。土壤盐渍化除导致土壤溶液水势降低、植物吸水困难、形成渗透胁迫外,还能引起离子毒害并诱发氧化胁迫等[5-6]。在干旱半干旱地区由于蒸发量远大于降水量,再加上植物根系的吸水作用,导致近地表土壤溶液浓缩、盐分浓度升高,从而形成旱、盐双重胁迫,对植物造成更严重的危害。然而,土壤盐分的存在也能够使植物以消耗较少的能量来吸收盐离子、降低渗透势、提高根系从外界吸水的能力[7],也就是说植物对盐分的吸收和积累可能会增强其抗旱能力,目前在盐生植物和荒漠植物中已有相关报道[8-9],而在农作物中还未见相关研究。
光合作用是植物最基本的生命活动,是对逆境胁迫影响最为敏感的生理过程之一。干旱胁迫会导致植物光合作用受到抑制,甚至光合机构的严重损伤[3,10]。本实验利用不同浓度NaCl溶液处理盆栽棉花,测定干旱持续过程中棉花叶片光合气体交换、叶绿素荧光参数的变化以及Na+积累与植株水分状况的关系,分析Na+吸收、积累对叶细胞水分状况的影响及其在缓解干旱导致的光合机构损伤中的作用,探讨Na+积累在棉花适应干旱过程中的作用,为干旱半干旱地区和环渤海滨海地区棉花种植的微咸水灌溉提供参考。
1 材料与方法
1.1 实验材料与处理
实验在玻璃温室内进行,供试材料为新农抗13号棉花(Gossypiumspp)。将园土和蛭石以2∶1的比例混合均匀后,分别装入15个直径为45 cm的花盆中。将棉花种子在水中浸泡12 h后,选择饱满均匀的种子分别种到花盆中,每个花盆种15颗种子,适时浇水,保证土壤湿润。幼苗长到3片真叶时进行间苗,每盆留下7棵长势均匀的幼苗。待幼苗长至6片真叶时(高约20 cm)进行处理,将材料分成A、B、C、D、E 5组(每组3盆),A、B两组浇灌自来水10 L,C、D、E 3组分别浇灌浓度为25、50、100 mmol/L NaCl溶液10 L,使盆土中溶液完全被替换为相应浓度的NaCl溶液。随后A组保持正常浇水,即A组为没有进行干旱处理的对照(CK); B、C、D、E组停止浇水,进行自然干旱,即B组为常规干旱处理、C组为干旱加25 mmol/L NaCl处理、 D组为干旱加50 mmol/L NaCl处理、E组为干旱加100 mmol/L NaCl处理。在干旱处理的第0、5、10、15、20、25、30天测定各项光合气体交换和叶绿素荧光参数指标,并在第30天完成上述测定后取样进行水分状况和Na+含量的测定。
1.2 测定方法
1.2.1 光合气体交换参数的测定
光合气体交换参数用便携式光合作用测定系统(PP System,USA)测定,测定光强为(800±10) μmol m-2s-1。该系统能同步获得活体叶片的净光合速率(Pn)、空气CO2浓度(Ca)、细胞间隙CO2浓度(Ci)等生理生态参数,气孔限制值(Ls)用Berry和Downtow 方法[11]计算:Ls=1-Ci/Ca。每种处理均取倒数第一个完全展开叶片为测定对象,每处理重复测定5个植株的5个叶片。
1.2.2 叶绿素荧光参数的测定
叶绿素荧光参数用Handy-PEA便携式植物效率分析仪(连续激发式荧光仪,Hansatech,UK)测定。激发光(饱和脉冲光)强度为3000 μmol m-2s-1,暗适应时间为 15 min,记录时间1 s。荧光参数由 Handy PEA 软件直接从测定结果中导出。每个处理重复测定15个叶片。
1.2.3 植株水分状况的测定
植株水势在处理后第30天用压力室法测定,叶片渗透势用露点微伏压计(HR-33T,美国)测定,均重复测定5个植株。叶片渗透势测定以上数第2个完全展开叶片为测定对象,取每个叶片的半叶(另半叶用于测定Na+含量)密封在自封袋内置冰箱(-18 ℃)冷冻10 h以上,取出在室温下解冻并待温度平衡后挤压出组织液进行测定。细胞膨压则用下式计算:细胞膨压=水势-渗透势。
1.2.4 叶片Na+含量测定
取测定渗透势所用叶片的另半叶在70 ℃烘干后参照王宝山和赵可夫[12]的方法提取叶片Na+。溶液中Na+含量采用GBC-932B型原子吸收分光光度计(GBC,AU)测定。
1.3 数据处理
实验数据以“平均值±标准差”表示,用Origin7.5作图、SPSS17.5进行数据处理和统计分析。
2 结果与分析
2.1 不同处理的棉花叶片Fo和Fv随干旱持续时间的变化
Fo是初始荧光量或最小荧光量,为PSⅡ反应中心处于完全开放时的荧光产量,Fo的升高说明色素吸收的能量中流向光化学反应的部分减少,PSⅡ反应中心的破坏或可逆失活会引起Fo的增加[13]、非光化学能量耗散和光合色素的破坏则引起Fo的下降[14]。可变荧光产量Fv=Fm-Fo(Fm:最大荧光量),Fv下降反映了PSⅡ反应中心QA氧化态数量减少,使QA→QB传递电子的能力下降[15]。从本实验结果可见,在干旱持续10 d后,B组Fo迅速上升,20 d后又快速下降;C、D、E组Fo在干旱持续10 d后出现小幅上升随后又恢复至与对照(A)相似的水平。B组Fv在干旱10 d后则快速下降,而C、D、E组在10 d后也开始缓慢下降,但下降幅度较小(图1)。说明,在干旱持续10 d后B组叶片PSⅡ反应中心开始失活,QA→QB的电子传递受阻,随着干旱持续时间延长反应中心失活加剧,至20 d后出现光合色素的破坏,光合机构受损严重。而C、D、E组虽然也有PSⅡ反应中心失活现象,但很快就能部分修复。
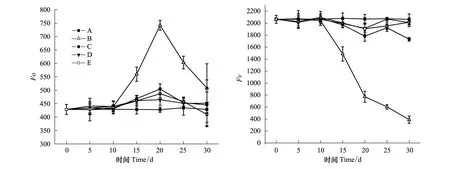
图1 各处理Fo和Fv随干旱持续时间的变化Fig.1 Changes of Fo and Fv in leaves of cotton plants treated with drought for different time
2.2 各处理的棉花叶片Fv/Fm和Fv/Fo随干旱持续时间的变化
Fv/Fm和Fv/Fo是表示PSⅡ光化学反应状况的两个叶绿素荧光参数,Fv/Fm表示PSⅡ最大光化学效率,Fv/Fo代表反应中心PSⅡ潜在的活性[16]。当植物光合机构受到损害时,Fv/Fm和Fv/Fo值就明显降低[17]。本实验结果显示,B组的Fv/Fm和Fv/Fo值均在干旱处理10 d后开始大幅度下降,C、D、E组Fv/Fm和Fv/Fo值也在干旱处理10 d后出现下降,但下降较缓慢,在整个实验期间都能维持在一个相对较高的水平(图2)。这说明干旱导致了棉花叶片PSⅡ光化学反应活性和效率的显著降低,持续干旱使光合机构受到明显损害;而土壤NaCl的添加能减缓干旱胁迫造成的叶片PSⅡ反应中心的破坏。
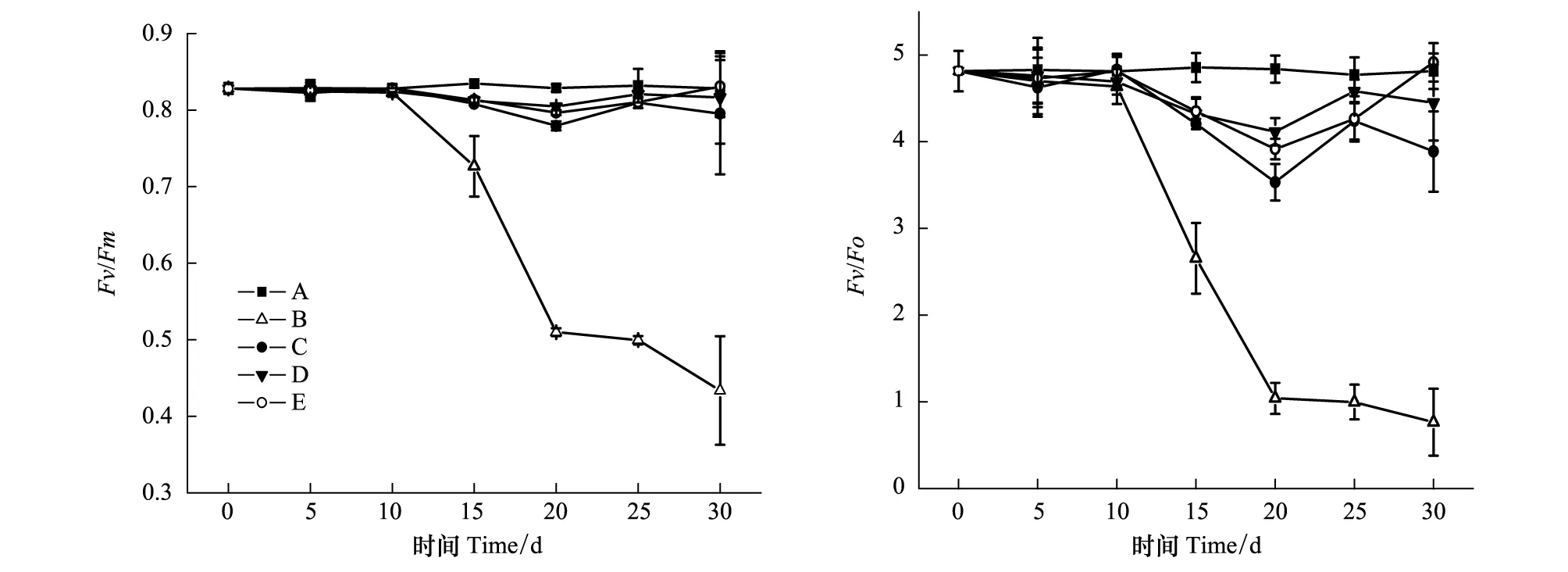
图2 各处理Fv/Fm和Fv/Fo随干旱持续时间的变化Fig.2 Changes of Fv/Fm and Fv/Fo in leaves of cotton plants treated with drought for different time
2.3 各处理的棉花叶片RC/CSo和ABS/RC随干旱持续时间的变化
RC/CSo是表明单位面积有活性反应中心数量的参数(RC为反应中心,CSo为横截面),ABS/RC是表明单位反应中心吸收的光能的参数(ABS为吸收光量子通量)[18]。由本实验结果可见,在干旱处理10 d后,B组RC/CSo开始快速下降,RC/ABS则快速上升,至30 d时RC/CSo已下降至150左右、RC/ABS则上升至30以上。C、D、E组RC/CSo的下降和RC/ABS的上升都比较平缓,在第30天时RC/CSo仍维持在300以上、RC/ABS则保持在20以下(图3)。RC/CSo的下降说明单位面积有活性反应中心的数量在减少,ABS/RC上升则说明每个有活性反应中心吸收的光能增加[19]。从两者的变化规律中可以看出持续干旱使单位面积有活性的反应中心数量下降,迫使剩余的有活性的反应中心的负担加重,表明干旱导致了光合反应中心不可逆的损伤;而土壤NaCl的存在则使这种损伤程度减轻。
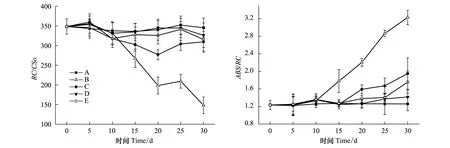
图3 各处理RC/CSo和ABS/RC随干旱处理时间的变化Fig.3 Changes of RC/CSo and ABS/RC in leaves of cotton plants treated with drought for different timeRC/CSo: 单位面积有活性反应中心数量The density of the active photosynthetic reaction centers;ABS/RC: 单位反应中心吸收的光能The effective antenna size; RC: 反应中心reaction centre; CSo: 横截面cross section; ABS: 吸收光量子通量absorption flux
2.4 各处理的棉花叶片PIABS随干旱持续时间的变化
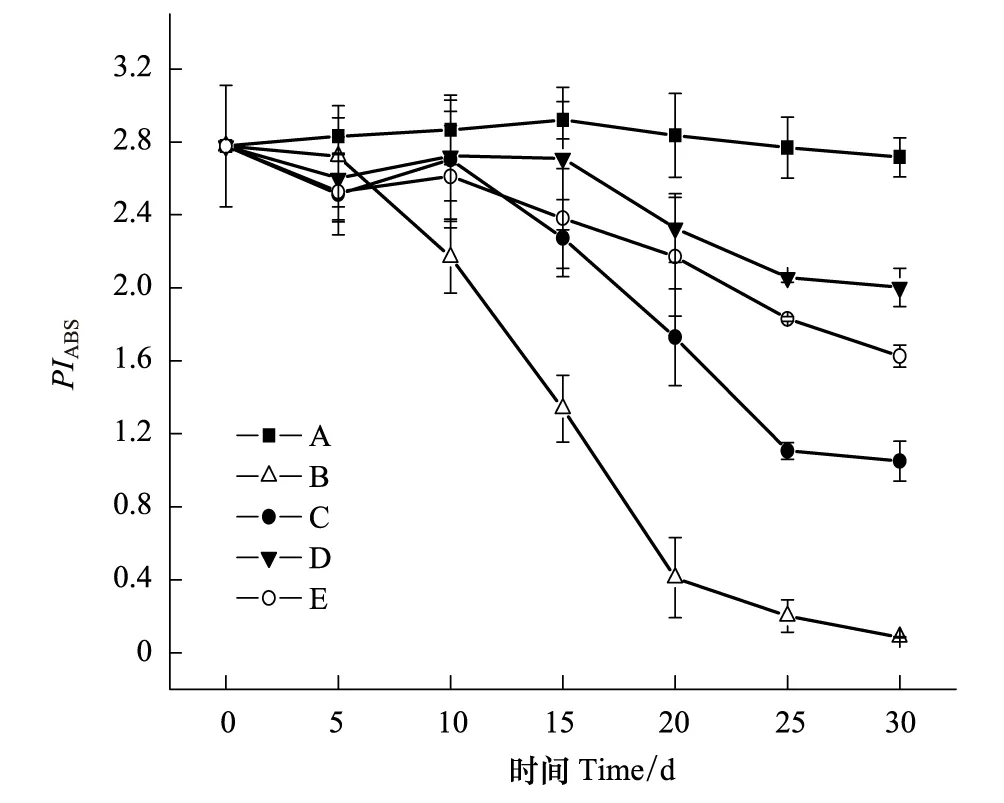
图4 各处理PIABS随干旱处理时间的变化 Fig.4 Changes of PIABS in leaves of cotton plants treated with drought for different time
PIABS是以吸收光能为基础的光合性能指数[13],可以准确地反映植物光合机构的整体状态,是反应光合系统受到环境影响的最敏感的参数[20-21]。当植物受到干旱或盐等环境胁迫导致光合系统受到损伤时,PIABS值会随着胁迫的加剧而持续下降。本实验结果显示,B组的PIABS值变化最大,在第30天已经下降至近0;C、D、E组的PIABS值在前5 d下降幅度稍大于B组,可能与NaCl的影响有关,5 d后下降幅度均远小于B组(图4)。可见,B组的光合机构受到了明显损伤,而C、D、E组的受损伤程度相对较小。
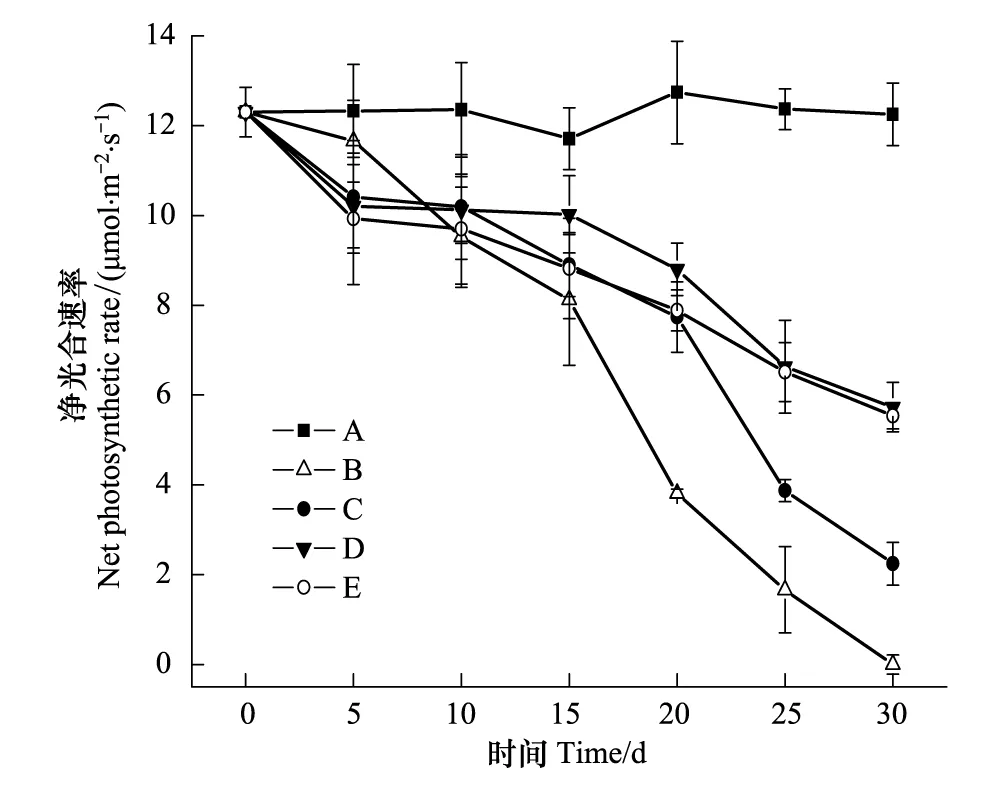
图5 各处理净光合速率随干旱处理时间的变化 Fig.5 Changes of the net photosynthetic rate in leaves of cotton plants treated with drought for different time
2.5 各处理的棉花叶片光合气体交换参数随干旱持续时间的变化
对不同处理叶片光合速率的测定结果表明,干旱显著降低棉花叶片的光合速率,其中B组在处理后第10天光合速率开始大幅下降,至处理后第30天降至近0;而C、D、E组的光合速率下降幅度明显小于B组(图5)。进一步分析各处理的细胞间隙CO2浓度和气孔限制值的变化发现,处理B在处理后的前20 d细胞间隙CO2浓度下降、气孔限制值升高,随后细胞间隙CO2浓度迅速升高、气孔限制值则快速下降;而C组细胞间隙CO2浓度和气孔限制值在干旱处理25 d后出现上升和下降,但上升和下降幅度远小于B组;而D、E组的细胞间隙CO2浓度和气孔限制值在整个实验期间一直表现为小幅下降和升高(图6)。依据高辉远等[22]和许大权[23]的观点,可以认为B组在干旱处理的前20 d光合速率下降的原因是气孔因素,即气孔关闭或部分关闭导致的CO2供应不足;20 d后光合速率下降的主要原因则是非气孔因素,即光合机构受损导致的叶肉细胞光合活性的降低;C组在干旱处理25 d后光合速率下降的原因才是非气孔因素,而D、E组在测定期限内,光合速率下降的原因主要是气孔因素,并没有出现光合机构的明显受损。可见,在土壤中添加NaCl可明显缓解干旱胁迫对棉花光合机构的损伤。
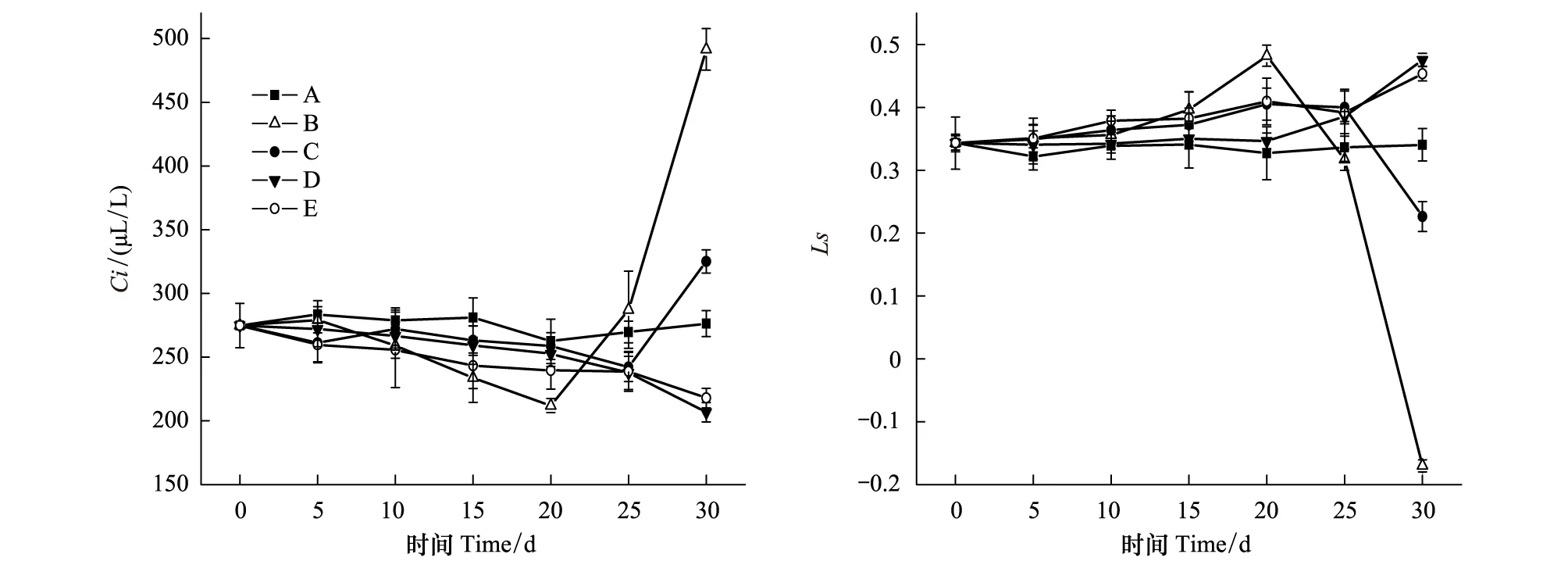
图6 各处理细胞间隙CO2浓度和气孔限制值随干旱处理时间的变化Fig.6 Changes of intercellular CO2 concentration (Ci) and stomata limitations (Ls) in leaves of cotton plants treated with drought for different time
2.6 各处理的棉花水分状况与Na+吸收的关系
对干旱处理第30天各处理棉花植株水分状况的测定结果显示,A组(CK)维持较高的叶片水势、渗透势和细胞膨压,干旱处理(B、C、D、E)则导致各项指标的显著降低(图7)。其中,B组细胞膨压为负值,叶片严重萎蔫;而C、D、E组由于具有更低的渗透势,细胞膨压均为正值,且显著高于B组(P<0.05),说明细胞仍维持一定的膨胀状态,这有利于其正常生理活动的进行。另对干旱胁迫下叶片Na+含量与渗透势的关系分析发现,叶片渗透势的降低与Na+含量有极显著的对数相关(图7,相关指数R=0.971>R0.01)。说明在NaCl溶液灌溉后的持续干旱条件下,棉花植株能够通过吸收和积累Na+等无机离子(主要区隔化在液泡内)来降低渗透势,从而增强渗透调节能力和吸水、保水能力,使组织能够维持相对较高的细胞膨压。
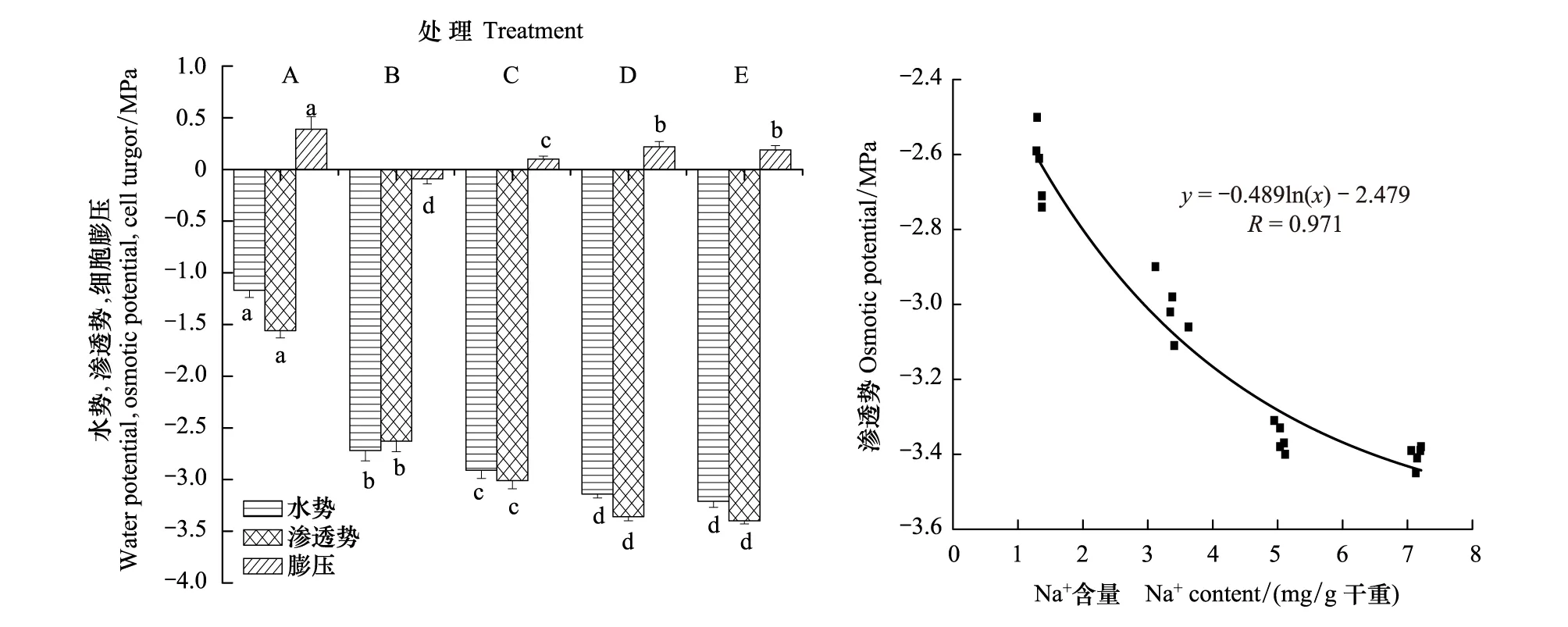
图7 各处理植株水分状况及叶片渗透势与Na+含量的关系Fig.7 The water status of plants in different groups and the osmotic potential of leaves in relation to the Na+ content数据柱上标记字母不同表示差异显著(P<0.05)
3 讨论
干旱会引起气孔导度的降低或者关闭,进而影响植物叶片的气体交换,通过对表观的气体交换参数变化的分析可以判断光合作用受影响的程度和原因[24]。叶绿素荧光分析技术则是研究和探测植物光合生理状况及各种外界因子或胁迫对其细微影响的快速、准确的活体测定和诊断技术[21,25],与气体交换指标相比,叶绿素荧光参数具有“内在性”的特点[26-27]。在本实验中随着干旱持续时间的延长,棉花叶片的净光合速率逐渐下降(图5),但NaCl处理的棉花植株,其叶片净光合速率的下降幅度明显低于未用NaCl处理的。进一步分析光合速率变化的原因,从气体交换参数的变化可见,未用NaCl处理的棉花植株在干旱持续20 d后细胞间隙CO2浓度迅速升高、气孔限制值则快速下降;而NaCl处理的棉花植株,其叶片细胞间隙CO2浓度和气孔限制值在整个实验期间一直表现为小幅变化(图6)。说明未用NaCl处理的棉花植株,在干旱持续20 d后,其光合速率下降的主要原因是光合机构受损导致的叶肉细胞光合活性的降低,而NaCl处理的并没有出现光合机构的明显受损。叶绿素荧光参数的变化则表现为,未用NaCl处理的棉花植株,其参数Fo在干旱持续10 d后开始快速上升20 d后又迅速下降,Fv、Fv/Fm、Fv/Fo、RC/CSo和PI均在干旱持续10 d后开始快速持续下降(PI在干旱处理5 d后就开始下降),ABS/RC则在干旱持续10 d后上升,这些结果均显示持续干旱导致了其叶片光合机构的严重损伤;而NaCl处理的棉花植株,各参数的变化幅度较小或无明显变化,即损伤较轻或无明显损伤。与气体交换参数相比较可以发现,两者均能很好地显示持续干旱对叶片光合机构的影响,但叶绿素荧光参数在持续干旱10 d后就表现出明显变化,而气体交换参数在20 d后才出现明显变化,说明持续干旱10 d后棉花叶片光合机构的就开始受到了损伤,这时从“表观的”气体交换参数上并不能体现出来,而叶绿素荧光参数却能及时显现光合机构的内部变化。
虽然土壤盐渍化可导致环境渗透胁迫,并引起离子毒害和氧化胁迫[5,28],如果同时伴有干旱则会引起土壤溶液进一步浓缩,环境盐离子浓度升高更有利于Na+等从外界环境到植物细胞内的运输[29-31],且使植物对K+的吸收减少[32],从而对植物产生更严重的伤害。但是,本实验结果显示,在盆土中浇灌适量的NaCl溶液后,在随后的持续干旱条件下,棉花植株对Na+的吸收和积累显著增加,并在一定程度上降低了叶片的渗透势,从而使细胞能够维持一定的膨压,而细胞膨压的维持对保护叶绿素和细胞的正常功能都具有重要作用[33-34]。对气体交换参数和叶绿素荧光参数的分析均显示用NaCl溶液浇灌的棉花植株与没有浇灌NaCl的相比,在干旱胁迫下叶片光合机构受损伤程度显著减轻或没有出现明显损伤。虽然干旱和盐胁迫条件下植物细胞能够通过合成和积累有机渗透调节物质可溶性糖、脯氨酸和甜菜碱等来调节渗透势,但是有机渗透调节物质的合成、转运和积累会在一定程度上干扰和重新定向植物的正常的生理过程,且有机分子的合成、累积和转运都需要耗能耗时;而吸收和积累Na+等盐离子作为渗透调节物质则可以避免这种干扰且耗能耗时均较少。也就是说,在旱、盐协同作用下,植物吸收和积累Na+并区隔化至液泡进行渗透调节比其合成和积累有机物进行渗透调节更为经济和高效,Slama等[35]和陈成升等[36]的实验也证实了这一点。当然,土壤盐渍化导致的Na+吸收和积累量增加对干旱条件下植物渗透调节的增效作用是相对的和有一定限度的,不同植物在不同干旱程度下对土壤含盐量的反应都会有很大差异,如果土壤含盐量过高无疑会加重干旱对植物的不利影响,各种植物抗旱性对土壤盐分响应的适宜范围还需进一步研究。
[1] Aroca R, Porcel R, Ruiz-Lozano J M. Regulation of root water uptake under abiotic stress conditions. Journal of Experimental Botany, 2012, 63(1): 43-57.
[2] Anjum S A, Xie X Y, Wang L C, Saleem M F, Man C, Lei W. Morphological, physiological and biochemical responses of plants to drought stress. African Journal of Agricultural Research, 2011, 6(9): 2026-2032.
[3] Rahdari P, Hoseini S M. Drought stress: A review. International Journal of Agronomy and Plant Production, 2012, 3(10): 443-446.
[4] Mohan S C, Binod K, Suhel M, Kunj C. Effect of drought stress in rice: A review on morphological and physiological characteristics. Trends in Biosciences, 2012, 5(4): 261-265.
[5] Shaheen S, Naseer S, Ashraf M, Akram N A. Salt stress affects water relations, photosynthesis, and oxidative defense mechanisms inSolanummelongenaL. Journal of Plant Interactions, 2013, 8(1): 85-96.
[6] 韩冰, 孙锦, 郭世荣, 金春燕. 钙对盐胁迫下黄瓜幼苗抗氧化系统的影响. 园艺学报, 2010, 37(12): 1937-1943.
[7] Ma Q, Yue L J, Zhang J L, Wu G Q, Bao A K, Wang S M. Sodium chloride improves photosynthesis and water status in the succulent xerophyteZygophyllumxanthoxylum. Tree Physiology, 2012, 32(1): 4-13.
[8] Wang S M, Wan C G, Wang Y R, Chen H, Zhou Z Y, Fu H, Sosebee R E. The characteristics of Na+, K+and free proline distribution in several drought-resistant plants of the Alxa Desert, China. Journal of Arid Environments, 2004, 56(3): 525-539.
[9] 谭永芹, 柏新富, 侯玉平, 张振华. 土壤盐分对三角叶滨藜抗旱性能的影响. 生态学报, 2013, 33(23): 7340-7347.
[10] Wang Z X, Chen L, Ai J, Qin H Y, Liu Y X, Xu P L, Jiao Z Q, Zhao Y, Zhang Q T. Photosynthesis and activity of photosystem II in response to drought stress in Amur Grape (VitisamurensisRupr.). Photosynthetica, 2012, 50(2): 189-196.
[11] Berry J A, Downton W J S. Environmental regulation of photosynthesis // Govind J. Photosynthesis (Vol Ⅱ). New York: Academic Press, 1982: 263-343.
[12] 王宝山, 赵可夫. 小麦叶片中Na、K提取方法的比较. 植物生理学通讯, 1995, 31(1): 50-52.
[13] 付春霞, 张元珍, 王衍安, 范晓丹, 闫玉静, 张友朋. 缺锌胁迫对苹果叶片光合速率及叶绿素荧光特性的影响. 中国农业科学, 2013, 46(18): 3826-3833.
[14] Li R H, Guo P G, Michael B, Stefania G, Salvatore C. Evaluation of chlorophyll content and fluorescence parameters as indicators of drought tolerance in barley. Agricultural Sciences in China, 2006, 5(10): 751-757.
[15] Dias M C, Brüggemann W. Limitations of photosynthesis inPhaseolusvulgarisunder drought stress: gas exchange, chlorophyll fluorescence and Calvin cycle enzymes. Photosynthetica, 2010, 48(1): 96-102.
[16] Kalaji H M, Carpentier R, Allakhverdiev S I, Bosa K. Fluorescence parameters as early indicators of light stress in barley. Journal of Photochemistry and Photobiology B: Biology, 2012, 112: 1-6.
[17] 王海珍, 韩路, 徐雅丽, 王琳, 贾文锁. 胡杨异形叶叶绿素荧光特性对高温的响应. 生态学报, 2011, 31(9): 2444-2453.
[18] 魏晓东, 陈国祥, 施大伟, 刘丹, 唐加红, 李霞. 干旱胁迫对银杏叶片光合系统Ⅱ荧光特性的影响. 生态学报, 2012, 32(23): 7492-7500.
[19] 卜庆梅, 柏新富, 朱建军. 4种园林树木叶绿素荧光参数对脱水的响应及耐旱特性分析. 林业科学, 2011, 47(10): 37-43.
[20] Van Heerden P D R, Strasser R J, Krüger G H J. Reduction of dark chilling stress in N2-fixing soybean by nitrate as indicated by chlorophyll a fluorescence kinetics. Physiologia Plantarum, 2004, 121(2): 239-249.
[21] Stirbet A, Govindjee. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and Photosystem II: basics and applications of the OJIP fluorescence transient. Journal of Photochemistry and Photobiology B: Biology, 2011, 104(1/2): 236-257.
[22] 高辉远, 邹琦, 程炳嵩. 大豆光合日变化过程中气孔限制和非气孔限制的研究. 西北植物学报, 1993, 13(2): 96-102.
[23] 许大全. 光合作用气孔限制分析中的一些问题. 植物生理学通讯, 1997, 33(4): 241-244.
[24] Zlatev Z. Leaf gas exchange and water relations of two sunflower cultivars under drought. Agricultural Science and Technology, 2012, 4(1): 24-26.
[25] 李鹏民, 高辉远, Strasser R J. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用. 植物生理与分子生物学学报, 2005, 31(6): 559-566.
[26] Schreiber U, Bilger W, Neubauer C. Chlorophyll fluorescence as a non-destructive indicator for rapid assessment of in vivo photosynthesis. Ecological Studies, 1994, 100(1): 49-70.
[27] 罗明华, 胡进耀, 吴庆贵, 杨敬天, 苏智先. 干旱胁迫对丹参叶片气体交换和叶绿素荧光参数的影响. 应用生态学报, 2010, 21(3): 619-623.
[28] Yadav S, Irfan M, Ahmad A, Hayat S. Causes of salinity and plant manifestations to salt stress: a review. Journal of Environmental Biology, 2011, 32(5): 667-685.
[29] Niu X, Bressan R A, Hasegawa P M, Pardo J M. Ion homeostasis in NaCl stress environments. Plant Physiology, 1995, 109(3): 735-742.
[30] Bai X F, Zhu J J, Zhang P, Wang Y H, Yang L Q, Zhang L. Na+and water uptake in relation to the radial reection coefcient of root in arrowleaf saltbush under salt stress. Journal of Integrative Plant Biology, 2007, 49(9): 1334-1340.
[31] 刘正祥, 张华新, 杨秀艳, 刘涛, 狄文彬. NaCl 胁迫下沙枣幼苗生长和阳离子吸收、运输与分配特性. 生态学报, 2014, 34(2): 326-336.
[32] 丁同楼, 贾玉辉, 鲍敬, 王宝山. 不同耐盐性小麦根Na+和K+的吸收特性. 植物生理学报, 2013, 49(1): 34-40.
[33] Morgan J M. Osmoregulation and water stress in higher plants. Annual Review of Plant Physiology, 1984, 35: 299-319.
[34] Howarth J F, Durako M J. Variation in pigment content ofThalassiatestudinumseedlings in response to changes in salinity and light. Botanica Marina, 2013, 56(3): 261-273.
[35] Slama I, Ghnaya T, Messedi D, Hessini K, Labidi N, Savoure A, Abdelly C. Effect of sodium chloride on the response of the halophyte speciesSesuviumportulacastrumgrown in mannitol-induced water stress. Journal of Plant Research, 2007, 120(2): 291-299.
[36] 陈成升, 谢志霞, 刘小京. 旱盐互作对冬小麦幼苗生长及其抗逆生理特性的影响. 应用生态学报, 2009, 20(4): 811-816.
The mitigating effects of Na+accumulation on the drought-induced damage to photosynthetic apparatus in cotton seedlings
XIE Weihai1, MA Shujie1, QI Lin1, ZHANG Zhenhua2, BAI Xinfu1,*
1CollegeofLifeSciences,LudongUniversity,Yantai264025,China2CollegeofGeographyandPlanning,LudongUniversity,Yantai264025,China
Abiotic stresses such as drought and salinity are major factors affecting plant growth and development, leading to the reductions in crop productivity. It is generally believed that plant water stress is exacerbated by saline soils. However, sodium ions absorbed by plant cells are partmentalized into vacuoles, and function as an effective osmoregulator, increasing the ability of plants to absorb and retain water. Thus, salt uptake in plants may potentially alleviate the adverse effects of drought. In this study, pot grown cotton plants were watered with NaCl solutions of different concentrations at a plant height of ca. 20 cm, followed by a sustained drought treatment. Parameters such as chlorophyll fluorescence, photosynthesis and gas exchange, plant water status, tissue Na+content, etc. were measured during drought stress were taken to assess whether Na+could alleviate drought induced photosystem dysfunction in leaves and identify the mechanisms involved. The leaf photosynthetic rates and the gas exchange of the plants were investigated using a TPS-1 portable photosynthesis system (PP System, USA), and chlorophyll fluorescence parameters were measured with a handy PEA (Hansatech, UK). The net photosynthetic rate declined as drought stress progressed in plants not treated with NaCl. By contrast, the decline in photosynthetic rate induced by drought was significantly lower in plants treated with NaCl. In addition, in plants not treated with NaCl, CO2concentrations in leaf intercellular spaces increased rapidly, while the stomatal limitation value decreased rapidly 20 days after the drought treatment commenced; the chlorophyll fluorescence parameterFo(the initial fluorescence) increased rapidly after 10 days of drought treatment, but decreased rapidly after 20 days; the other chlorophyll fluorescence parameters, such asFv(the variable fluorescence),Fv/Fm(maximum quantum efficiency of photosystemⅡ),Fv/Fo(maximum primary yield of photochemistry of photosystemⅡ),RC/CSo(the density of the active photosynthetic reaction centers) andPI(the performance index) all showed sharp declines as drought stress became obvious, while theABS/RC(the effective antenna size) increased consistently 10 days after drought treatment began. These results indicate that the photosynthetic apparatus suffered serious damage in the late stages of drought stress in plants not watered with salt solution. By contrast, the salt treated plants subjected to the same drought stress showed smaller or insignificant changes in these parameters, indicating that the photosynthetic apparatus of the salt treated plants suffered less or no damage. Salt absorption and plant water status have always been extremely important in the study of salt stress. Our results show that Na+accumulation in salt treated plants increased significantly, which lowered leaf osmotic potential, facilitating the maintenance of turgor pressure. Compared to salt treated plants, cells in plants not treated with NaCl lost their turgor with the advancement of drought stress and the plants wilted seriously. It is therefore concluded that the cotton plants treated with NaCl absorbed and accumulated Na+, lowering tissue osmotic potential and maintaining some turgor pressure during sustained drought, thus mitigating damage to the photosynthetic apparatus caused by drought stress.
cotton; Na+; drought; photosystemⅡ(PSⅡ) photochemistry efficiency; gas exchange
国家自然科学基金项目(41271236)
2014-03-06; < class="emphasis_bold">网络出版日期:
日期:2014-12-04
10.5846/stxb201403060382
*通讯作者Corresponding author.E-mail: bxf64@163.com
解卫海, 马淑杰, 祁琳, 张振华, 柏新富.Na+吸收对干旱导致的棉花叶片光合系统损伤的缓解作用.生态学报,2015,35(19):6549-6556.
Xie W H, Ma S J, Qi L, Zhang Z H, Bai X F.The mitigating effects of Na+accumulation on the drought-induced damage to photosynthetic apparatus in cotton seedlings.Acta Ecologica Sinica,2015,35(19):6549-6556.

