《化学实验基本方法》考点聚焦
冯小丽

考点一、实验安全的注意事项与实验事故的处理
1.安全中要注意“三禁七防”:(1)三禁:①禁止手触、鼻闻、口尝;②禁止一盏酒精灯点燃另一盏酒精灯;③加热液体时禁止试管口对着人.(2)七防:①防爆炸;②防暴沸;③防失火;④防中毒;⑤防倒吸;⑥防烫伤;⑦防仪器炸裂.
2.常见的意外事故的处理:(1)酒精及其它易燃有机物小面积失火,应立即用湿布扑灭;(2)钠、磷等失火应迅速用砂覆盖;(3)酸沾到皮肤上,应立即用大量水冲洗,再涂上NaHCO3稀溶液;(4)碱液沾到皮肤上,先用较多水冲洗,再涂上硼酸溶液;(5)酸、碱溅在眼中,应立即用水反复冲洗,并不断眨眼;(6)液溴、苯酚沾到皮肤上,应立即用酒精擦洗;(7)误食重金属盐,应立即口服蛋清或生牛奶;(8)汞滴落在桌上或地上,应立即撒上硫粉.
该部分主要考查危险品标志的识别、实验是否注意安全以及实验事故的处理是否正确.
例1 下列实验操作或实验事故处理正确的是( ).
A.实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中
B.实验室制硝基苯时,将硝酸与苯混合后再滴加浓硫酸
C.实验时手指不小心沾上苯酚,立即用70℃以上的热水清洗
D.实验室制乙酸丁酯时,用水浴加热
解析 将苯与液溴混合后加到有铁丝的反应容器中,铁起催化剂作用,使反应速率加快,A正确;实验室制取硝基苯时,首先滴加浓硝酸,然后向硝酸中逐滴滴加浓硫酸,最后加苯,B错误;手指上沾上苯酚,用热水清洗会造成烫伤,C错误;制取乙酸丁酯时,不需要水浴加热,直接加热即可,D错误.选A.
考点二、常见化学药品的存放
药品保存有六防:⑴防氧化;⑵防分解;⑶防粘结;⑷防腐蚀;⑸防挥发;⑹防水解,该部分内容主要考查药品保存的方法是否达到要求.一般从三个角度分析:一是药品的性质(物理性质和化学性质);二是试剂瓶(颜色、瓶口的粗细等);三是瓶塞(玻璃塞、橡皮塞等).
例2 下列做法正确的是( ).
A.将浓硝酸保存在无色玻璃瓶中
B.用镊子取出白磷并置于水中切割
C.把氯酸钾制氧气后的残渣倒入垃圾桶
D.氢气还原氧化铜实验先加热再通氢气
解析 浓硝酸见光易分解,必保存在棕色试剂瓶中;白磷的着火点较低(40℃),在空气中易自燃,切割时摩擦生热,白磷有自燃的危险,所以应在水下切割;氯酸钾有强氧化性,与垃圾混合易引起燃烧或爆炸;氢气还原氧化铜实验先加热再通氢气,则氢气与空气混合受热易引起爆炸.选B.
考点三 仪器的使用
常见的仪器包括试管、坩埚、蒸发皿、烧杯、烧瓶、锥形瓶、集气瓶、试剂瓶、量筒、容量瓶、滴定管、托盘天平、漏斗等,该部分主要考查这些仪器的使用方法是否正确.分析时应根据仪器的使用范围、注意事项等进行判断.
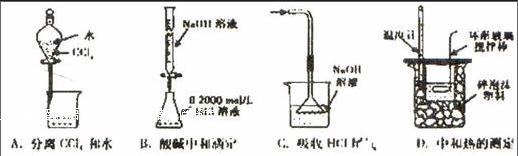
例3 下列实验装置(固定装置略去)和操作正确的是( ).
解析 CCl4与水分层,故可以用分液漏斗进行分离,A正确;NaOH应放在碱式滴定管中,B错误;倒置的漏斗应置于液面上,否则起不到防倒吸的作用,C错误;在中和热的测定中,温度计应测小烧杯中液体的温度,故温度计不能靠在烧杯壁,D错误.选A.
考点四 基本操作
基本操作包括过滤、量液仪器的读数、浓硫酸的稀释、加热、配制一定物质的量浓度溶液、中和滴定等,该部分内容主要考查操作的原理,以及操作的方法是否正确.
例4 下列与实验相关的叙述正确的是( ).
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
D.检验某溶液是否含有SO2-4时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
解析 稀释硫酸的操作是“酸入水”,A错误;若将多余的水取出,会使得浓度偏小,加水超过容量瓶的刻度的唯一办法是重新配制,B错误;用待测液润洗锥形瓶,则消耗的标准液会偏多,导致结果偏高,C正确;若溶液中含有Ag+,也会有不溶于盐酸的白色沉淀产生,D错误.选C.
考点五 物质的分离与提纯
物质的分离与提纯的方法有过滤、结晶、蒸馏、萃取、分液、洗气、渗析、升华等,该部分主要考查物质分离或提纯的方法以及所使用的仪器是否正确.
例5 下列实验装置不适用于物质分离的是( ).
解析 A装置可用于互不相溶液体的分离;B装置可将容易升华的物质分离出来;C装置可用于降温结晶;D装置并非蒸馏分馏操作示意图,只有当温度计的水银球位于蒸馏烧瓶的支管口附近时才能用于沸点不同且互溶液体的分离.选D.
考点六 物质的检验
物质的检验是根据常见气体、阳离子、阴离子和有机物的特征性质进行,该部分主要考查物质的检验方法,以及利用离子的检验方法进行离子的推断、鉴别等.
例6 某钠盐溶液中可能含有NO-2、SO2-4、SO2-3、CO2-3、Cl-、I-等阴离子.某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液pH大于7;
②加入盐酸,产生有色刺激性气体;
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体;
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色;
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色.
该同学最终确定在上述六种离子中仅含NO-2、CO2-3、Cl-三种阴离子.
请分析,该同学只需要完成上述哪几个实验,即可得出此结论( ).
A. ①②④⑤ B. ③④ C. ③④⑤ D. ②③⑤
解析 根据最终的离子分析:有NO-2存在时一定没有SO2-3、I-,因NO-2具有氧化性可以使他们氧化.Cl-存在下的NO-2的检验:加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体,既证明了NO-2的存在又检验出Cl-的存在.但仅加入盐酸产生刺激性气体也可能有SO2-3的存在,故须先确认SO2-3不存在.SO2-3、CO2-3、SO2-4的组合检验可以加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色来确认SO2-3、SO2-4不存在,CO2-3一定存在.故选择③④就可以,顺序是先④后③.
选B.

