基于IPA分析自噬对大鼠肝再生中树突状细胞的调节作用
王棋文,靳伟,常翠芳,徐存拴
基于IPA分析自噬对大鼠肝再生中树突状细胞的调节作用
王棋文1,2,3,靳伟1,2,3,常翠芳1,2,3,徐存拴1,2,3
1. 河南师范大学,河南省生物工程重点实验室,新乡 453007;2. 河南师范大学,河南省-科技部共建细胞分化调控国家重点实验室培育基地,新乡 453007;3. 河南师范大学生命科学学院,新乡 453007
为探讨自噬对大鼠肝再生中树突状细胞(Dendritic cells, DCs)的调节作用,文章通过Percoll 密度梯度离心结合免疫磁珠分选分离大鼠DCs,Rat Genome 230 2.0芯片检测大鼠肝再生中自噬相关基因表达变化,利用IPA等软件分析自噬在DCs中的生理活动。结果表明,、、和等关键基因在部分肝切除后不同恢复时间段有明显表达变化;芯片中对应的自噬相关基因为593个,其中210个基因发生了有意义的变化。比较分析自噬生理活动情况,发现自噬在再生早期和晚期阶段增强,增殖期减弱。与自噬相关的生理活动主要有RNA表达、RNA转录细胞分化和增殖,其中涉及的信号通路主要有PPARα/RXRα激活、急性期反应、TREM1 信号通路、IL-6 信号通路、IL-8 信号通路和IL-1 信号通路等,它们在肝再生阶段发生了不同程度的上调或下调。Cluster 分析还发现,P53和AMPK信号参与调控DCs的自噬活动,在肝再生早期主要是AMPK信号,在肝再生末期P53和AMPK信号共同参与自噬的调节。以上研究结果说明DCs自噬可能在肝再生早期激活细胞免疫反应和后期清除DCs等方面发挥着重要作用。
肝再生;自噬;树突状细胞;Rat Genome 230 2.0 芯片;IPA
肝脏再生是指正常肝脏出现急、慢性损伤时(如手术、感染等),肝组织重新修复的过程。正常条件下,肝细胞很少分裂,但是在手术切除、病毒或化学性损伤后,肝脏有惊人的再生能力。肝切除后早期应激信号的发生可能是增加每单位肝脏质量对能量需求的结果,剩余的肝组织继续保留了肝脏特异性的功能如:糖异生、尿素合成和蛋白质、核酸以及其他细胞成分合成所必须的ATP[1, 2]。但是目前对于肝脏切除后正常肝功能恢复的潜在机制(新陈代谢的作用、细胞成分的重组等)仍未完全阐明。
自噬,即“细胞的自我消化”,是将细胞成分(线粒体、折叠蛋白、细胞内病原体等)通过溶酶体途径降解的过程[3]。自噬在维持肝脏功能的动态平衡中发挥着重要作用,肝脏通过自噬消除有聚集倾向的蛋白质、受损的线粒体以及肿胀的肝细胞。研究表明,抑制自噬会造成肝肿大,随后是炎症、肝炎和肿瘤发生[4]。自噬水平的降低会导致()的积聚。作为一种信号枢纽激活NF-κB的信号传导途径,通过的转录因子活化编码抗氧化蛋白和解毒酶的基因转录[5]。肝脏中的树突状细胞(Dendritic cells, DCs)属于巨噬细胞系家族成员,在启动和调节肝脏免疫反应中发挥着重要作用。2/3肝切除后,一方面DCs被激活,通过吞噬作用和凝集素介导的内吞作用来摄取、加工、降解抗原。另一方面,DCs从门静脉迁移至中央静脉,最后通过窦周间隙到达肝淋巴系统,捕获抗原并通过MHC II呈递给T细胞,启动免疫反应[6]。但目前对于肝再生过程中自噬在DCs中的作用尚未见文献报道。本研究利用Percoll 密度梯度离心结合免疫磁珠分选分离大鼠DCs,全基因组表达谱芯片Rat Genome 230 2.0检测大鼠 2/3 肝切除后0、2、6、12、24、30、36、72、120、168 h 等10个时间点的基因表达谱,用生物信息学和系统生物学等方法分析DCs中调控自噬的关键通路以及自噬与免疫的关系。
1 材料和方法
1.1 大鼠2/3肝切除及DCs分离与鉴定
SD大鼠由河南师范大学实验动物中心提供。体重230±20 g,每组6只。9 组部分肝切除(Partial hepatectomy, PH),9 组手术对照(Sham operation, SO),1 组正常对照。外科手术方法切除大鼠的肝左叶和肝中叶,缝合切口,伤口外敷磺胺消炎。参考常翠芳等[7]的方法,在PH后0、2、6、12、24、30、36、72、120、168 h分离DCs(麻醉大鼠,打开腹腔,暴露肝脏,两步灌流,Percoll离心收集非实质细胞)。CD11c抗PE抗体4℃孵育 15 min,加入 10 μL/mL抗CD11c-PE 分选磁珠继续孵育 15 min,然后将“细胞-磁珠”悬液加入分选柱中,让其自然流出,PBS清洗分选柱后移去分选磁场,再将分选柱PBS下冲洗两次,冲洗出阳性结合细胞。免疫组化检测鉴定细胞[8]。
1.2 Rat Genome 230 2.0芯片检测与分析
分离、纯化的DCs提取RNA后,进行Rat Genome 230 2.0 芯片检测[9]。对基因芯片表达谱中的基因做均一化处理,用实验组比对照组的值得到基因的比值(ratio值)。当一个基因的ratio值≥对照3倍,或≤对照0.33倍时,该基因变化有意义。检验PH组与SO组的基因表达变化差异性,将差异显著(﹤0.05)或极显著(﹤0.01)并且PH后一个恢复时间点发生有意义表达变化的基因视为大鼠肝再生相关基因。为减少实验操作和芯片分析误差,每个时间点的样品均重复检测3次。对基因芯片检测结果的可靠性采用qRT-PCR方法进行确认[8]。
1.3 自噬相关基因的确认
根据 GENEONTOLOGY 网站(www.geneontology.org)的生理活动分类,将“自噬”输入NCBI (www.ncbi.nlm.nih.gov)和RGD(rgd.mcw.edu)等网站查找大鼠、小鼠和人的相关基因,并通过IPA、Pathwaystudio等软件中的自噬信号网络对上述基因进行补充,最终确定自噬调节相关基因。
1.4 大鼠肝再生DCs中自噬信号调节网络的构建
首先将获得的自噬相关基因分别导入IPA、Pathwaystudio中,通过“Core Analysis”和“Enrichment Analysis”获得自噬调节相关信号通路和生理活动,根据-log (-value)值的大小进行排序,初步筛选出可能的信号通路和生理调节活动。
将确认的自噬相关基因与芯片数据进行比对,获得芯片中的自噬相关基因在肝再生过程中的表达情况,通过“Dataset Files”导入IPA,进行“Core Analysis”和“Comparison Analyse”,在“Canonical Pathways”和“Diseases and Functions”得到相关信号通路和生理活动的-log (-value)值。将两次获得的自噬信号通路和生理活动进行比较分析,结合基因在大鼠部分肝切除后不同时间段的表达,分析DCs中自噬及与自噬相关的其他生理活动变化情况,找出可能的调控信号通路,并利用Cluster 和 Treeview 等软件绘制出相关生理活动和信号通路的表达模式图。
2 结果与分析
2.1 自噬关键基因在芯片中的表达情况
为了分析自噬在肝再生DCs中的作用,本研究首先观察了、、、在2/3肝切除后不同恢复时间段的变化,从图1中可以看出、、在激活期(PH 后 0.5~6 h)和终止期(PH后72~168 h)有不同程度的表达上调,在0~168 h内呈现先升高后降低的趋势。的表达变化最为显著。
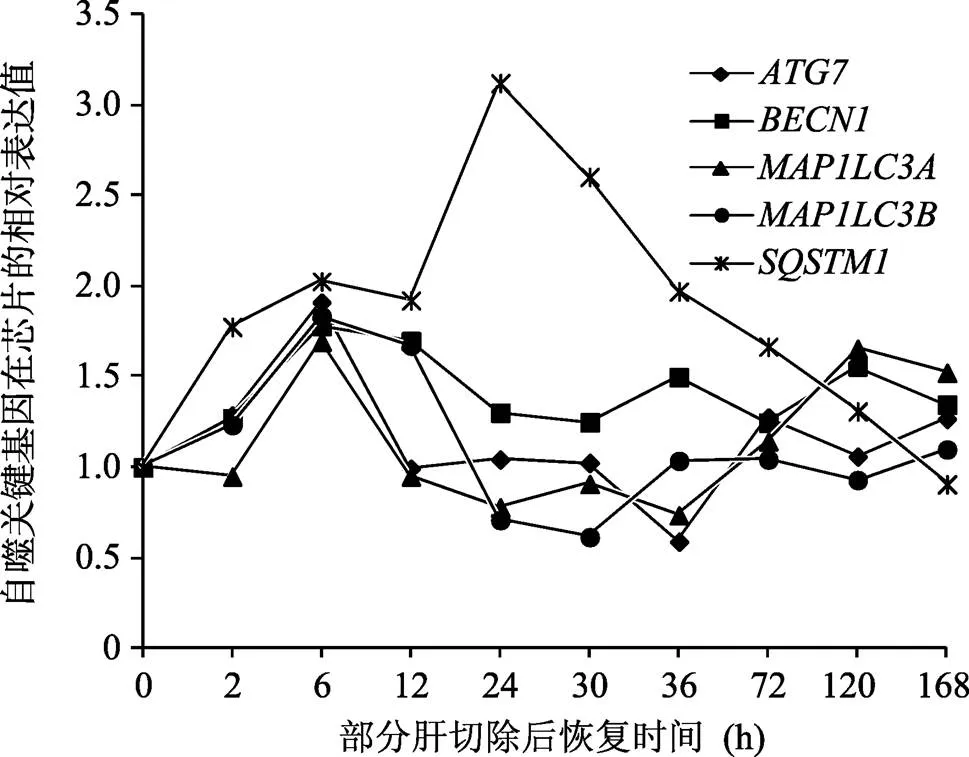
图1 自噬关键基因在大鼠肝再生DCs中的表达变化
2.2 自噬的生理活动情况
本研究进一步在NCBI和RGD等网站查找,得到与自噬相关基因814个,与芯片中对应的基因有593个,发生有意义变化的基因210个。由图2A可以看出,在2~168 h 等9个时间段内,上调/下调的基因数分别为41/1、66/11、39/33、74/37、50/21、40/61、31/4、31/2、14/13。利用IPA比较分析自噬生理活动情况,自噬在再生早期和晚期阶段增强,增殖期减弱(图2B)。Cluster 分析还发现,P53和AMPK信号参与调控DCs的自噬活动,在肝再生早期,主要是AMPK信号,肝再生末期P53和AMPK信号共同参与自噬的调节。
2.3 与自噬相关的其他生理活动变化情况
由图3可以看出,DCs中与自噬相关的生理活动主要有RNA表达、RNA转录、细胞分化和增殖等,其中涉及到的信号通路主要有PPARα/RXRα激活、急性期反应、TREM1 信号通路、IL-6 信号通路、IL-8 信号通路和IL-1 信号通路等,它们在肝再生阶段发生了不同程度的上调或下调。
2.4 P53和AMPK信号通路调节肝再生中DCs自噬的途径和方式
从IPA、RGD、KEGG和QIAGEN等网站分析P53信号通路与自噬的关系,结合芯片中基因表达情况,发现在P53信号通路中,等12个基因发生了有意义的变化,可能参与了自噬的调节(表1)。用IPA软件解析上述基因的作用途径和方式,自噬的发生可能是通过以下途径:自噬;自噬;→自噬。

图2 肝再生DCs中自噬及其相关信号通路的生理活动的生物信息学分析
A:自噬相关基因的表达情况;B:自噬及相关信号通路的热图分析。

图3 肝再生DCs中与自噬相关的生理活动及信号通路的生物信息学分析
A:与自噬相关的生理活动热图分析;B:与生理活动相关的信号通路热图分析。

表1 P53信号通路相关基因表达变化
从芯片中发现AMPK信号通路与自噬调节相关(表2)。分析得出,自噬的发生可能通过以下途径:→自噬;→自噬。
3 讨论
肝脏再生是一个非常复杂的过程,伴随着细胞分化、增殖以及组织结构重建等一系列生理活动。肝脏中的DCs仅占肝脏细胞总数的0.3%~0.6%,但在刺激、诱导静息T细胞增殖,激发免疫反应等方面发挥着重要作用[10]。

表2 AMPK通路相关基因表达变化
对于自噬与肝再生的关系,国内外已经有少量文献报道,C57BL/6小鼠肝脏切除后,自噬水平的降低一直贯穿于再生早期。而自噬的诱导剂卡马西平却能促进肝脏再生,同时降低肝损伤[11]。在敲除的小鼠模型中,70%肝脏切除后肝再生过程受到严重影响,有丝分裂减少,同时代偿性的肝肥大和老化肝细胞增多[12]。本研究结果表明,自噬的关键基因、、、在大鼠肝再生DCs中发生了不同程度上调或下调变化,有明显的时间-依赖关系。聚类分析结果也可以看出,自噬在再生早期和晚期有明显上调,说明其可能参与了DCs的生理活动调节。
自噬不但在维持自身稳定方面发挥作用,而且也参与免疫、炎症抗原递呈、T细胞免疫反应等生理或病理过程。敲除或基因,CD4+和CD8+周边T淋巴细胞很快凋亡,二级淋巴器官数量减少,T细胞抗原受体刺激之后的增殖反应受到抑制[13]。自噬还影响胞质内抗原的呈递反应,如MHC II类分子的组成[14],T细胞发育、分化、极化和稳态等[15]。本实验室前期研究结果已经指出,大鼠肝再生DCs中细胞因子分泌、免疫、防御、炎性反应等生理活动在肝切除早期迅速升高,增殖期没有明显增加,但在终止期显著降低[8]。本研究发现,肝再生DCs中与自噬相关的生理活动主要有RNA表达,RNA转录细胞分化和增殖,主要受PPARα/RXRα激活、急性期反应、TREM1 信号通路、IL-6 信号通路、IL-8 信号通路和IL-1 信号通路的调节,在再生早期和晚期都有一个高峰,说明DCs自噬可能在肝再生早期启动细胞免疫反应,后期清除DCs和诱导DCs凋亡等方面发挥重要作用,有待进一步运用其他生物学方法进行验证。
自噬是真核细胞内依赖溶酶体,降解细胞内的长寿命蛋白和受损的细胞器的一种降解途径,受mTOR、AMPK、P53等信号通路的调控[16, 17]。是一种肿瘤抑制基因,主要的功能是作为转录因子,发挥维持基因组稳定的作用。此外,还参与泛素介导的蛋白酶体降解,其活性高低受靶基因的调节。在正常细胞中,处于较低水平。但是在各种应激条件下,如DNA损伤、缺氧等,受到抑制,通过激活下游分子,诱导自噬的发生[18]。[19, 20]等分子也可以通过调节的水平进而影响自噬进程。本研究结果显示,肝再生早期树突状细胞中的表达虽有升高,但其下游自噬底物表达反而降低,说明此时的激活主要参与细胞周期的调控、DNA 损伤识别和修复。同时的低表达有助于增强应激条件下细胞的长期生存能力[21],激活期p53信号可能并没有参与早期自噬的调节。但在肝再生后期,的活化促进了的表达,进一步激活自噬,参与抑制DCs的增殖,防止过度免疫反应。
腺苷酸活化蛋白激酶(AMPK)是LKB1的重要底物,被认为是真核生物的“细胞能量调节器”,AMPK的功能可能与各亚基有密切关系,其中仅α亚基为催化单位,主要有α1/α2 两种异构形式,即和。上游磷酸化催化亚基,从而使活化。一方面,开启分解代谢途径产生ATP,同时关闭合成代谢途径以减少ATP的消耗。另一方面,的激活介导了的活化作用,进一步抑制的生物功能。是自噬发生发展的中心环节,失活,导致去磷酸化,进而激活,最终诱导自噬的发生。最近的研究指出,肝脏经过乙醇处理会通过上调磷酸酶抑制的功能,进而抑制的活化,刺激自噬的发生。而长期的酒精暴露会降低肝自噬水平,这可能是水平降低、乙醇的囊泡运输受到抑制所引起。肝脏缺血再灌注损伤过程中,[22]和[23]的表达也启动了介导保护性的自噬反应。从本研究结果可以看出,肝再生早期和末期AMPK信号表达均有上调,与自噬的生理活动基本一致,说明大鼠部分肝切除,引起DCs的应激反应,促使调节能量代谢的分子激活,诱导自噬过程,参与DCs的增殖、防止感染和免疫应答;另外一方面,在肝再生后期,活化引起自噬的同时,进一步激活AMPK信号通路[24],两者共同促进自噬的发生,通过一系列级联反应,清除过度增殖的DCs,防止过度免疫反应。本研究还发现的表达在整个再生过程中都处于较高的水平,可能除了调节自噬活动,激活的同时还参与细胞凋亡、细胞周期、蛋白质翻译等过程[25, 26],有待于进一步实验验证。
[1] Merlen G, Gentric G, Celton-Morizur S, Foretz M, Guidotti JE, Fauveau V, Leclerc J, Viollet B, Desdouets C. AMPKα1 controls hepatocyte proliferation independently of energy balance by regulating Cyclin A2 expression., 2014, 60(1): 152–159.
[2] Lehmann K, Tschuor C, Rickenbacher A, Jang J, Oberkofler CE, Tschopp O, Schultze SM, Raptis DA, Weber A, Graf R, Humar B, Clavien PA. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration., 2012, 143(6): 1609–1619.
[3] Hamasaki M, Furuta N, Matsuda A, Nezu A, Yamamoto A, Fujita N, Oomori H, Noda T, Haraguchi T, Hiraoka Y, Amano A, Yoshimori T. Autophagosomes form at ER-mitochondria contact sites., 2013, 495(7441): 389–393.
[4] Codogno P, Meijer AJ. Autophagy in the liver., 59(2): 389–391.
[5] Komatsu M. Liver autophagy: physiology and pathology., 2012, 152(1): 5–15.
[6] Hsu W, Shu SA, Gershwin E, Lian ZX. The current immune function of hepatic dendritic cells., 2007, 4(5): 321–328.
[7] 常翠芳, 王改平, 朱秋实, 王磊, 张富春, 马纪, 徐存拴. 大鼠再生肝8种细胞的丝氨酸族氨基酸代谢相关基因的转录谱. 遗传, 2010, 32(8): 829–838.
[8] Xu CS, Chen XG, Chang CF, Wang GP, Wang WB, Zhang LX, Zhu QS, Wang L. Genome-wide analysis of gene expression in dendritic cells from rat regenerating liver after partial hepatectomy., 2011, 29(3): 255–264.
[9] Chang CF, Xu CS. Transcriptome atlas of aromatic amino acid family metabolism-related genes in eight liver cell types uncovers the corresponding metabolic pathways in rat liver regeneration., 2010, 42(10): 1708–1716.
[10] 谢来峰, 王文博, 王磊, 王望, 徐存拴. 树突状细胞在大鼠再生肝中分布及数量变化. 重庆师范大学学报(自然科学版), 2009, 26(2): 22–26.
[11] Lin CW, Mo LR, Chen YS, Chen YJ, Kuo PL, Yu ML. Enhanced autophagy promotes liver regeneration and hepatocyte proliferation after partial hepatectomy in mouse liver., 2013, 58: 469A-470A.
[12] Takeo T, Ken S, Takasuke F, Toru I, Tomoharu Y, Yuji S, Tetsuo I, Shinji O, Yoshihiko M. Suppression of autophagy during liver regeneration impairs energy charge and hepatocyte senescence in mice., 2014, 60(1): 290–300.
[13] Pua HH, Guo J, Komatsu M, He YW. Autophagy is essential for mitochondrial clearance in mature T lymphocytes., 2009, 182(7): 4046–4055.
[14] Lee HK, Mattei LM, Steinberg BE, Alberts P, Lee YH, Chervonsky A, Mizushima N, Grinstein S, Iwasaki A.requirement for Atg5 in antigen presentation by dendritic cells., 2010, 32(2): 227–239.
[15] Jia W, Pua HH, Li QJ, He YW. Autophagy regulates endoplasmic reticulum homeostasis and calcium mobilization in T lymphocytes., 2011, 186(3): 1564–1574.
[16] Gammoh N, Wilkinson S. Autophagy in cancer biology and therapy., 2014, 9(1): 35–50.
[17] Matter MS, Decaens T, Andersen JB, Thorgeirsson S. Targeting the mTOR pathway in hepatocellular carcinoma: Current state and future trends., 2014, 60(4): 855–865.
[18] Ryan K M. p53 and autophagy in cancer: Guardian of the genome meets guardian of the proteome., 2011, 47(1): 44–50.
[19] Liu B, Cheng Y, Zhang B, Bian HJ, Bao JK.lectin induces apoptosis and autophagy in human melanoma A375 cells through a mitochondria-mediated ROS-p38-p53 pathway., 2009, 275(1): 54–60.
[20] De Luca P, Moiola CP, Zalazar F, Gardner, K, Vazquez ES, De Siervi A. BRCA1 and p53 regulate critical prostate cancer pathways., 2013, 16(3): 233–238.
[21] Crighton D, Wilkinson S, Ryan KM. Addenda DRAM links autophagy to p53 and programmed cell death., 2007, 3(1): 72–74.
[22] Bhogal RH, Weston CJ, Curbishley SM, Adams DH, Afford SC. A cyto-protective mechanism which prevents primary human hepatocyte apoptosis during oxidative stress., 2012, 8(4): 545–558.
[23] Padrissa-Altés S, Zaouali MA, Bartrons R, Roselló-Catafau J. Ubiquitin-proteasome system inhibitors and AMPK regulation in hepatic cold ischaemia and reperfusion injury: possible mechanisms., 2012, 123(2): 93–98.
[24] Chen SN, Rehman SK, Zhang W, Wen AD, Yao LB, Zhang J. Autophagy is a therapeutic target in anticancer drug resistance., 2010, 1806(2): 220–229.
[25] Høyer-Hansen M, Jäättelä M. AMP-activated protein kinase: a universal regulator of autophagy?, 2007, 3(4): 381–383.
[26] Jansen M, ten Klooster JP, Offerhaus GJ, Clevers H. LKB1 and AMPK family signaling: the intimate link between cell polarity and energy metabolism., 2009, 89(3): 777–798.
(责任编委: 张博)
Regulation of autophagy on dendritic cells during rat liver regeneration by IPA
Qiwen Wang1,2,3, Wei Jin1,2,3, Cuifang Chang1,2,3, Cunshuan Xu1,2,3
To understand the mechanism underlying autophagy in regulating dendritic cells during rat liver regeneration, we used the method of percoll density gradient centrifugation combined with immunomagnetic bead to isolate dendritic cells, the Rat Genome 230 2.0 Array to determine the expression changes of autophagy-related genes, and Ingenuity Pathway Analysis 9.0 (IPA) to determine the autophagy activities. The results indicated that,,andgenes had significant expression changes during rat liver regeneration. There were 593 genes related to autophagy, among which 210 genes were identified as significant. We also showed that the activity of autophagy was enhanced in the priming phase and teminal phase of liver regeneration, weakened in the proliferative stage by comparative analysis method of IPA. The autophagy-related physiological activities mainly included RNA expression, RNA transcription, cell differentiation and proliferation, involving in PPARα/RXRα activation, acute phase response signaling, TREM1 signaling, IL-6 signaling, IL-8 signaling and IL-1 signaling, whose activities were increased or decreased in liver regeneration. Cluster analysis found that P53 and AMPK signaling participated in the regulation of dendritic cells autophagy, with AMPK signaling in the priming phase of liver regeneration, and both signaling pathways in the terminal phase. We conclude that dendritic cells autophagy played an important role in initiation of the immune response in priming phase and depletion of dendritic cells in late phase during rat liver regeneration.
rat liver regeneration; autophagy; dendritic cells; Rat Genome 230 2.0 Array; ingenuity pathway analysis
2014-11-13;
2015-01-12
河南省重大科技攻关项目(编号:111100910600),河南师范大学博士启动课题(编号:qd14175)和河南师范大学青年科学基金项目 资助
王棋文,博士研究生,研究方向:肝再生的分子机理。E-mail: wangqiwen@htu.edu.cn
徐存拴,博士,教授,博士生导师,研究方向:肝再生的分子机理。E-mail: xucs@x263.net
10.16288/j.yczz.14-391
2015-1-28 15:17:44
http://www.cnki.net/kcms/detail/11.1913.R.20150128.1517.003.html

