真核生物和原核生物mRNA 5′至3′方向的降解机制
许禔森,李学贵,焦德杰,谢兆辉,戴忠民
真核生物和原核生物mRNA 5′至3′方向的降解机制
许禔森1,2,李学贵1,2,焦德杰1,2,谢兆辉1,2,戴忠民1,2
1. 德州学院生命科学学院,德州 253023;2. 山东省高校生物技术与生物资源利用重点实验室,德州 253023
RNA降解是基因表达调节的重要途径,影响很多生命活动。近来,mRNA降解机制有了很多新发现,如真核生物中发现了一种mRNA末端尿苷化介导的脱帽机制,和一条不依赖exosome的3′→5′的mRNA降解途径。虽然真核生物与原核生物mRNA降解途径非常相似,通常都有3种:内切降解、5′→3′外切降解和3′→5′外切降解等,但两者mRNA降解途径之间也存在很多差异,如5′→3′方向的外切降解是真核生物mRNA最重要的降解途径之一,但其在细菌中作用非常弱,且只在革兰氏阳性菌中发现。mRNA降解的研究不仅深化了人们对这一过程的认识,而且有助于新型药物的研发,以防御寄生虫、病毒或治疗人类疾病(如癌症)等。文章主要综述了真核生物和原核生物mRNA 5′→3′方向的降解机制,并对其应用前景进行了展望。
5′→3′ mRNA降解;基因表达;真核生物mRNA;原核生物mRNA;药物
mRNA稳定性的调控对基因表达调节具有重要意义,有时这种调控可以占到基因表达调节作用的50%[1]。通常真核生物与原核生物mRNA降解方式都包括5′→3′方向降解、内切降解和3′→5′方向降解等3种方式。其中5′→3′方向是真核生物mRNA最重要的降解途径之一,相关的酶突变可以引起细胞个体增大、减数分裂阻滞、染色体端粒缩短、生长减慢等症状,严重时可以致死。虽然5′→3′方向的降解途径不是原核生物mRNA主要的降解途径,至今也只在革兰氏阳性菌中发现,但相关的酶却是革兰氏阳性菌正常生长所必需的。近年来,人们对真核与原核两类生物mRNA降解方式的认识有了很大的进展。例如。原来一直认为真核生物3′→5′方向的降解只有exosome介导的一条途径,最近却发现还可能存在另一条独立于exosome的途径[2]。此外,随着对mRNA降解途径细节方面的认识, mRNA降解途径将来很有可能会成为药物研发的新靶标,以更好地防御病原体,如细菌、病毒和线虫类害虫等;或更好地治疗人类疾病(如癌症和脊髓性肌肉萎缩症等)。本文主要综述了真核生物和细菌mRNA 5′→ 3′方向的降解方式,并对其应用前景进行了展望。
1 真核生物mRNA 5′→3′方向的降解
参与真核生物mRNA 5′→3′方向降解的核酸酶主要为XRN1(Exoribonucleases 1),因为其活性中心不能容纳三磷酸核苷酸或帽子结构,所以XRN1发挥作用前首先需要清除起稳定作用的mRNA 5′端帽子结构—7-甲基鸟苷三磷酸(m7Gppp)。
1.1 mRNA的脱帽酶及其辅助因子
目前发现的脱帽酶主要包括广泛表达的Nudix家族的水解酶Dcp2和Nudt16,和一些表达不太广泛的非Nudix家族的水解酶,如酵母()中的Rai1(Rat1 interacting protein 1)和Dxo1等[3]。最近的研究发现,除了Dcp2和Nudt16,Nudix家族的其他水解酶,如Nudt2、Nudt3、Nudt12、Nudt15、Nudt17和Nudt19也都有脱帽酶活性,其中Nudt17和Nudt19与Dcp2相似,也可以形成m7GDP,这说明真核生物中也许还有很多未被发现的脱帽酶[4]。目前发现的这些脱帽酶在不同生物中的表达不同,如果蝇()中只有一种,哺乳动物则至少可以表达两种;而且它们之间也存在靶标特异性或功能冗余,如在无义介导的mRNA降解(Nonsense-mediated mRNA decay, NMD)途径中,Dcp2被优先利用,在富含AU序列(AU-rich element, ARE)介导的降解途径中,Dcp2和Nudt16分别作用于不同的mRNA,而在miRNA介导的降解途径中,Dcp2和Nudt16存在功能冗余[5]。
Dcp2是目前研究最为清楚的脱帽酶,其发挥活性不仅需要与Dcp1形成Dcp1-Dcp2复合物,而且在不同生物中还需要不同类型的激活蛋白,如Pat1 (protein associated with topoisomerase II)、Edc1-4(enhancer of decapping 1-4)、Dhh1(DExH/D-box RNA helicase 1)、Lsm1-7和Scd6等。这些激活蛋白根据作用机制可以分三类:第一类可以直接激活脱帽酶,如Edc3,其包含一个Sm-结构域,可以直接结合和激活Dcp2;第二类可以通过抑制翻译起始,以改变翻译起始和脱帽之间的竞争关系,间接的激活脱帽活性,如 Dhh1和Scd6;第三类既可以直接激活脱帽酶Dcp2,也可以抑制翻译起始,如Pat1。Pat1是一个多功能蛋白,可以在不同生物中与Dcp1-Dcp2复合物、脱帽激活因子(Dhh1、Ed3、Lsm1-7)、核酸外切酶XRN1和脱腺苷化复合物Ccr4(Carbon catabolite repression 4)-Not(negative on TATA-less )等相互作用[6]。最近,有研究报道了人类脱帽复合物组装的过程:其中脱帽激活因子Edc4为组装平台,其N-末端结构域为DCP1三聚体提供结合位点,C-末端α-结构域为DCP2和XRN1提供结合位点,DCP1的EVH1结构域则通过与DCP2的NRD结构域相互作用激活DCP2的脱帽活性,这种结构非常利于已经脱帽的mRNA迅速转运给XRN1进行降解[7]。
1.2 脱帽作用的引发
以前,通常把引发脱帽的机制分为2种:脱腺苷化依赖性的脱帽和不依赖于脱腺苷化的脱帽,最近发现3′-末端尿苷化可能也是一种引发脱帽的机制。
1.2.1 脱腺苷化依赖性的脱帽
脱腺苷化依赖性的脱帽不仅是真核生物mRNA最主要的脱帽方式(图1A,①⑤),也是降解途径的限速步骤,脱腺苷化过程一般分为两个阶段,分别由Pan2(PABP-dependent poly(A)nuclease 2)-Pan3和CCR4–NOT两个复合物催化(图1,①、⑤)。Pan2-Pan3复合物中具有催化活性的为Pan2,但其不能直接结合mRNA,所以往往需要Pan3先以二聚体形式结合到poly(A)尾巴上,再招募Pan2以催化脱腺苷化反应[8]。Pan3上的两个结构——PAM2(PABP interacting motif 2)结构域和N-端锌指结构和假激酶区/C-端结构域有利于其先被招募,前者可以与poly(A)结合蛋白的C-端结构域发生相互作用,后者可以直接结合到poly(A)上[8]。Pan3上临近PAM2结构域的一些丝氨酸或苏氨酸还可以通过磷酸化修饰,调节Pan3与PABP之间的相互作用,及其Pan3的招募过程[9]。
当poly(A)缩短到20~25nt之后,PABP会从poly(A)上解离,Pan2-Pan3脱腺苷化的活性受阻,第二阶段开始,由Ccr4-Not去除剩下的腺苷酸残基[8]。许多蛋白可以起到招募Ccr4-Not的作用,如果蝇中的CUP/9和Smaug蛋白、人类生殖干细胞中Nanos的同源蛋白[10]、ARE-介导的mRNA降解途径中的TTP (tristetraprolin)蛋白[11]、NMD途径中的SMG7蛋白[12]和miRNA途径中的GW182蛋白[13]。其中在哺乳动物和果蝇的miRNA途径中,GW182蛋白不仅可以直接结合Ccr4-Not复合物,而且还可以与脱帽激活因子HPat相互作用,并充当miRNA反应中各因子结合的平台[13]。
当poly(A)进一步缩短到只有约10~15nt时,因为Lsm1-7复合体偏爱结合寡聚poly(A),所以Lsm1-7可以与Pat1蛋白形成Lsm1-7/Pat1复合物,结合到寡聚poly(A)上,并在Dhh1的共同作用下,抑制mRNA的翻译起始。最近的研究证明,单独的Lsm1-7或Pat1不仅结合RNA的能力非常弱,而且也没有识别寡聚poly(A)的能力,只有组装成Lsm1-7-Pat1复合物后才可以结合到寡聚poly(A)上[14]。推测可能是Pat1的C-末端结构域通过与Lsm1-7复合体中的Lsm2和Lsm3亚基的相互作用介导了上述复合物的形成[15],Lsm1-7/Pat1复合物结合以后便可以招募DCP1-DCP2进行mRNA脱帽反应[16]。因为脱腺苷化有时也可以通过Pan2-Pan3独立完成,所以有研究认为Pan2-Pan3与Ccr4-Not之间可能存在功能冗余[8]。
1.2.2 不依赖于脱腺苷酸化的脱帽
酵母中有少数mRNA可以不经过脱腺苷化,直接进行脱帽(图1A,⑥),如酿酒酵母()中编码Rps28b(Ribosomal protein S28 B)蛋白的mRNA和编码脱帽激活蛋白Edc1的mRNA。原来曾认为Rps28b蛋白可以直接结合到自身mRNA 3′-端非翻译区(Untranslated region, UTR)中的茎环结构上,直接招募Edc3和脱帽酶引发脱帽[17]。但最近却发现,Rps28b并不能直接结合上述茎环结构,相反可能是Edc3先结合茎环结构,以后Rps28b再结合到Edc3上,以调节Edc3的活性[18]。Edc1 mRNA的3′-UTR中没有颈环结构,但具有Poly(U) 序列,这个序列可以与mRNA末端Poly(A) 尾巴形成双链结构,从而阻断脱腺苷化过程,引发不依赖于脱腺苷化的脱帽[19]。NMD降解mRNA的方式有多种,在酿酒酵母中,NMD中的一些蛋白因子就可以直接招募DCP1-DCP2脱帽复合物,使mRNA进行不依赖于脱腺苷化的脱帽和5′→3′方向降解[20],如核心蛋白UPF1,且这种作用还可以通过其磷酸化/脱磷酸化修饰而受到调节[12, 20]。最近的研究还发现,在某些情况下,miRNA可以通过提高脱帽复合物中相关酶或蛋白的浓度,介导靶标mRNA进行非脱腺苷化引发的脱帽降解[21]。目前,mRNA的这种不依赖于脱腺苷化的脱帽降解机制主要在酵母中发现,在哺乳动物中是否存在还不清楚[22]。

图1 真核生物和原核生物mRNA 5′→3′方向的降解机制
A:真核生物mRNA 5′→3′方向的降解。①脱腺苷化;②寡聚poly(A)末端的尿苷化;③poly(A)末端的直接尿苷化;④尿苷化介导的脱帽;⑤脱腺苷化依赖性的脱帽;⑥不依赖脱腺苷化的脱帽;⑦尿苷化介导的脱帽;⑧XRN1从5′端降解mRNA。B:真核生物组蛋白mRNA 5′→3′方向的降解。①末端尿苷化;②脱帽;③XRN1从5′端降解。C:细菌mRNA 5′→3′方向的降解。①去除焦磷酸;②RNase J1/J2从5′端降解mRNA。
1.2.3 3′-末端尿苷化引发的脱帽
3′-末端尿苷化引发的脱帽是最近才发现的一种引发mRNA脱帽的机制,最早在组蛋白的mRNA(图1B)上发现,组蛋白mRNA的3′-末端没有poly(A)尾巴,但具有颈环结构。其脱帽过程首先需要在其3′-末端进行寡聚尿苷化,以形成一个尿苷酸残基组成的尾巴,并以此作为平台招募Lsm1-7和DCP1- DCP2等进行脱帽反应[23]。不具有poly(A)尾巴的还有mRNA内切后的上游片段,这些片段往往可以被exosome在3′→5′方向降解,但在人类()、小鼠()和拟南芥()中,mRNA被miRNA内切后产生的上游产物,类似组蛋白mRNA,也发生了3′-末端尿苷化介导的脱帽反应,且Lsm1-7复合物还可以结合到尿苷酸尾巴上,稳定该片段的3′-末端[24]。
上述末端尿苷化介导的脱帽过程也可以发生在具有poly(A)尾巴的mRNA上,但尿苷化过程可能直接发生在完整的poly(A)之后,如粟酒裂殖酵母()的和mRNA。这些mRNA首先需要尿苷酸转移酶Cid1在完整的poly(A)之后先进行尿苷化,再进行脱帽(图1A,③、⑦),推测这时尿苷化与脱腺苷化在引发脱帽方面可能存在功能冗余[25]。末端尿苷化也可能发生在poly(A)被部分脱腺苷化之后,如拟南芥和构巢曲霉()。拟南芥中这种尿苷化过程不仅可以引发脱帽和5′→3′方向的降解(图1A,②、④),而且还可以阻止mRNA从3′方向降解,以保证最后一轮翻译过程得到完整的产物[26]。构巢曲霉mRNA的尿苷化主要发生在poly(A)被降解到大约15nt左右时,并且往往尿苷化伴随着胞苷化,形成一个尿苷酸和胞苷酸组成的杂合尾巴,突变上述末端修饰酶会导致脱帽速率大大降低[27]。最近又发现,mRNA末端尿苷化不仅可以引发脱帽和5′→3′的降解,也可以改变mRNA 3′→5′方向降解的方式,这种降解过程不需要exosome,但需要一种新发现的3′→5′外切核酸酶DIS3L2(DIS3-like exonuclease 2),推测其可能是一种3′→5′方向降解mRNA的新途径[28]。由于很多生物具有Cid1同源物,所以推测尿苷化也许是一种广泛存在且保守的引发mRNA降解的机制[25]。
1.3 5′→3′方向的降解
脱帽反应完成之后,帽子结构以m7GDP形式释放,mRNA则被核酸外切酶XRNs在5′→3′方向降解。动物中的核酸外切酶往往为XRN1,XRN1可以与脱帽复合物直接发生相互作用。如酵母XRN1可以直接与Pat1的C-末端结构域相互作用[29];果蝇XRN1的C-末端DBM(DCP1-binding motif)基序可以与DCP1的EVH1结构域直接相互作用[30];人类XRN1可以直接与Edc4的C-末端α-结构域相互作用[7]等。推测XRN1与脱帽复合物在结构上的密切联系,可以使脱帽的mRNA迅速转运给XRN1进行降解。最近发现,XRN1不仅可以降解mRNA,而且还可以进入细胞核充当转录调节因子,增强多种mRNA的表达水平,尤其那些高效表达的基因,所以有人称XRN1为“合成降解酶(Synthegradase)”[31]。研究还发现,XRN1的靶标基因倾向于表达不稳定的mRNA,推测在胞浆中非常不稳定的mRNAs主要被XRN1优先降解;中等稳定的mRNAs可以被Xrn1降解,也可以被exosome降解;而稳定的mRNAs则主要被exosome降解[31]。
由于释放的帽子—m7GDP为甲基化的核苷酸,所以细胞需要快速清除这种修饰核苷酸,以防止它们掺入核酸的正常合成而造成危害。原来曾认为这是由DcpS (Decapping Scavenger)催化的,所以DcpS曾被认为可以参与两个方向的mRNA降解:在3′→5′方向将帽子m7GpppN形成m7GMP,在5′→3′方向将帽子m7GDP形成m7GMP[32]。但最近发现,在人类、线虫()和酵母中,DcpS虽然对m7GDP有非常高的亲和力,但实际上它不仅不能降解m7GDP,而且m7GDP还有可能会竞争性的抑制其活性,干扰其正常的生物学功能[33]。最近在果蝇中发现了一种5′→3′方向新的核苷酸酶—CG3362 (基因编码),它不仅可以将m7GMP 水解成7-甲基鸟苷和无机磷酸,也可以将帽子结构m7GDP 水解成核苷和两个无机磷酸,但它是否真的是体内m7GDP的降解酶还需要进一步验证[34]。
2 细菌mRNA的5′→3′方向的降解
mRNA 5′→3′方向的降解方式在细菌中不普遍,目前只发现了一种参与这个方向降解的核酸酶—RNase J,且一般也只存在于革兰氏阳性菌中。RNase J通常具有5′→3′外切和内切两种活性,并在一个活性中心完成,这是第一次发现同一个活性位点完成两种酶切活性。RNase J的内切酶活性专一于单链RNA,没有序列或位置特异性,因为酶结合底物主要识别RNA的核糖与磷酸形成的骨架链,而不是识别碱基[35]。不同于内切酶活性,RNase J表现外切酶活性时,因为其底物的结合区域只能容纳单磷酸核苷酸,不能容纳三磷酸核苷酸,所以其外切酶活性需要RNA的5′端为单磷酸或羟基形式[35]。因为原核生物mRNA的5′端往往为三磷酸形式,所以需要另一种酶完成单磷酸形式的转化(图1C),这种酶为细菌的RNA焦磷酸水解酶RppH(RNA pyrophosphohydrolase),不同细菌中转化的方式有所差异。枯草杆菌()的RppH可以依次去除γ和β位的磷酸,大肠杆菌的RppH则是将γ和β位的磷酸以焦磷酸形式去除,尽管大肠杆菌mRNA没有5′→3′方向的降解途径,但是上述转化往往也是大肠杆菌内切酶必需的[36]。在有些细菌中,RNase J具有两种同源性形式:RNase J1和RNase J2,如枯草杆菌和金黄色葡萄球菌(),且两者往往形成异二聚体或异四聚体,推测可能RNase J1表现活性,而RNase J2只起结构蛋白的作用[37]。由于RNase J的外切酶活性是革兰氏阳性菌正常生长所必需的,内切酶活性是次要的,而RNase J2 的外切酶活性比RNases J1低至少2个数量级,有时还只表现内切酶活性,所以RNases J1往往是细菌生长所必需的,而RNase J2 是非必需的。推测通过基因拷贝,一些细菌之所以表达两种RNase J,可能与内切酶和外切酶之间的活性转变有关,是一种功能的精细调节方式[37]。除了方向性,RNase J1还有一个特点不同于细菌其他3′→5′核酸外切酶,也就是它可以彻底降解mRNA,包括寡聚核苷酸片段[38],由于其中一些2~5nt长的寡聚核苷酸片段(nanoRNAs)可以充当转录的引物[39],所以RNase J1还可以通过改变细菌转录的起始,影响细菌的基因的表达。
细菌中RNase J 往往与其他的酶或蛋白形成复杂的降解体(Degradosome)结构,且这种现象在革兰氏阳性菌中非常保守,如金黄色葡萄球菌的降解体复合物包括RNase J1、RNase J2、RNase Y、PNPase、烯醇化酶、磷酸果糖激酶和解链酶RnpA等[40]。最近在菌幽门螺杆菌()中研究发现,这种降解体结构可以与翻译中的核糖体相互作用,说明这种降解体不仅参与mRNA降解过程,还可以影响蛋白质的翻译,使mRNA降解与蛋白质翻译相互偶联[41]。这种现象原来曾认为只存在于真核生物[42],这是首次发现细菌RNA的降解复合体也可以与翻译复合物相互作用,说明这种现象可能在生物界广泛存在。
除了细菌,又在古细菌、蓝细菌和叶绿体中发现RNase J,编码RNase J的核基因在植物中也普遍存在,叶绿体中RNase J不仅可以缩短叶绿体mRNA的5′端,还可以参与叶绿体mRNAs的成熟[43]。最近的研究也揭示,RNase J还可以参与细菌RNase P的RNA和16S rRNA 5′-端的成熟加工,所以RNase J可能具有多种生物学功能,如RNA的成熟、转录后调节和RNA降解等[37]。
3 5′→3′方向mRNA降解机制研究与药物研发
5′→3′方向mRNA 降解机制的深入研究有可能为药物研发提供新靶标,如A族乙型溶血性链球菌可以引发多种疾病,由于RNase J是其生长必需的,所以有研究认为RNase J很有可能会成为将来治疗相关疾病的靶标,且相关的实验也已经开始并取得了一定的进展[44]。过去基因治疗的靶标主要集中在DNA,这很容易产生不可逆转的危害,而基于翻译水平的治疗手段则可以避免这种情况。帽子类似物原来主要用于RNA的代谢研究,现在这些类似物已经开始用于药物研究。如在人类的很多癌症中,翻译的起始因子eIF4E通常会超表达,而抑制eIF4E可以抑制癌细胞生长,推测通过合成的帽子类似物破坏eIF4E–mRNA的帽子复合物结构,可以成为治疗癌症和脊髓性肌肉萎缩症的新途径[45,46]。在不同生物中,由于甲基化的程度或位置不同,mRNA往往存在多种不同的帽子结构,已经发现血吸虫()和线虫与哺乳动物mRNA 有着不同的帽子结构,人类eIF4E对这种帽子亲和力比上述害虫eIF4E低数百倍,所以深入了解上述害虫eIF4E结合帽子的机制,非常有利于研发新型且广谱的抗寄生虫药物[47]。此外,脱帽本身可能也具有一定的抗病毒功能,如崩芽病毒()可以从昆虫向哺乳动物传染多种疾病,这些病毒不能形成自身mRNA的帽子结构,通过劫取宿主带有帽子结构的短mRNA片段作为自身mRNA合成的引物。果蝇脱帽酶Dcp2 和两个脱帽激活因子DDX6和LSM7对多种崩芽病毒都有抗性作用[48]。而脊髓灰质炎病毒感染可以直接导致Dcp1a和Pan3降解,在病毒感染之前表达Dcp1则可以抑制这种病毒的感染[49]。最近研究发现,很多进化各异的(+)RNA病毒,如兽棚病毒(),在其基因组复制的关键阶段都会用到脱帽激活因子Lsm1-7、Pat1和Dhh1等,所以针对这3种蛋白也有可能会开发出广谱的抗病毒药物[50]。
4 结语与展望
综上所述,真核与原核生物mRNA 5′→3′方向的降解细节虽有不同,但过程非常相似(表1):先去除mRNA 5′端的保护结构,如真核生物的帽子结构或细菌中三磷酸结构,再利用5′→3′外切酶降解。有趣的是,细菌mRNA虽然没有帽子结构,但其RppH也具有脱帽酶活性,这揭示脱帽活性可能出现在真核生物mRNA的帽子结构出现之前[4],这也与高度保守真核生物的Dcp2与细菌RppH在进化上具有亲缘关系的特点一致[51]。此外,两类生物涉及降解的酶和蛋白因子往往都形成大的复合物结构,如细菌的降解体或真核生物的P-body。但是细菌的降解体往往成分更复杂,包含多个方向的核酸酶,甚至还有一些非mRNA降解相关的酶。由于参与3′→5′方向的外切酶复合物exosome独立于P-body,所以曾经认为真核生物mRNA两个方向的外切降解途径在空间上是分开的,P-body从5′→3′外切酶降mRNA,exosome从3′→5′方向的外切酶降mRNA[54]。但是最近发现,真核生物3′→5′方向降解mRNA的另一个核酸酶Dis3L2可以与P-body共沉降,推测可能位于P-body中[2],这不仅是第一次发现P-body具有3′→5′方向外切酶的活性,也进一步验证了真核生物mRNA在3′→5′方向的降解至少存在exosome和Dis3L2依赖性的两条途径。虽然真核生物Xrn1与细菌RNase J具有相似的功能,但两者在三维结构、催化机制和结合口袋的氨基酸组成上存在明显差异,推测生物可能历经至少2次进化,才形成了上述两种类型的5′→3′方向的核酸外切酶[52]。其实不仅这2种酶,真核生物和原核生物mRNA降解过程中的很多核酸酶都有非常大的差异,所以细菌mRNA降解过程也许可以提供很多新的药物靶标,以应对越来越严重的细菌耐药性难题[53]。
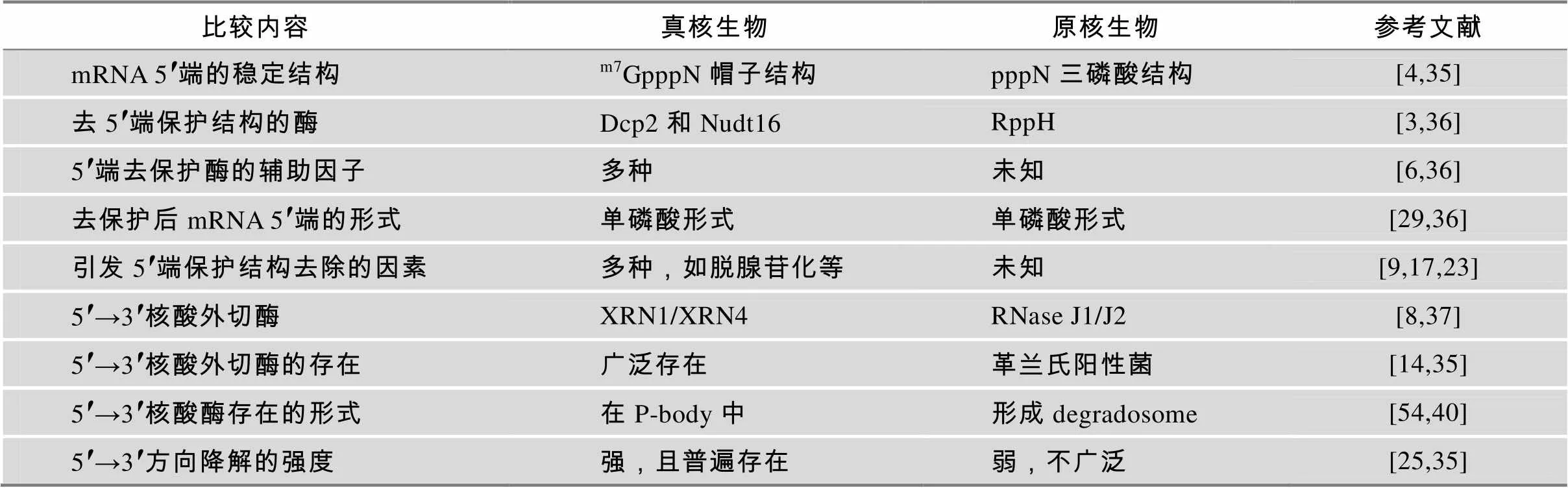
表1 真核生物与原核生物胞浆mRNA 5′→3′方向降解机制的比较
现在还不清楚为什么细菌中最弱的降解途径,在很多真核生物中转化为了最强的降解过程之一,而细菌中最强的降解途径—内切降解,却是真核生物中最弱的。也许是由于原核生物的mRNA是多顺反子,长度较长,内切有利于迅速降解,以适应细菌快速繁殖。而真核生物mRNA是单顺反子,长度变短,且稳定性需要提高,所以内切降解的作用下降了。另外,由于真核生物蛋白质翻译起始需要识别帽子结构,而5′→3′降解可以通过脱帽使mRNA迅速失去模板功能,所以在一定程度上可以起到原核生物通过内切快速降低mRNA模板功能的特点。另外,真核生物5′→3′方向优于3′→5′降解的另一个特点是可以防止形成长短不一的有害蛋白质,因为一旦翻译起始,mRNA的3′端影响很大。如在拟南芥中,为保证最后一轮翻译过程得到完整的产物,往往通过mRNA末端尿苷酸化阻止的3′方向的降解[26]。此外,5′→3′方向降解复合物的组装,往往需要3′端相关复合物招募,而结合到3′端的Lsm1-7复合物也可以保护3′端的作用。细胞为了防止由于mRNA模板原因,导致翻译过程异常终止,而产生有害的蛋白质的情况,已经进化出了多种质量控制机制,如NMD、No-go降解(No-go decay, NGD)和Non-stop降解(Non-stop decay, NSD)[55]。当然这些都是推测,还有待进一步证实。但是鉴于mRNA降解在基因表达调节中的重要作用,且目前一些降解细节还不是十分清楚,所以对其进行深入研究将具有重要的理论意义和深远的应用价值。
[1] Cheadle C, Fan JS, Cho-Chung YS, Werner T, Ray J, Do L, Gorospe M, Becker KG. Control of gene expression during T cell activation: alternate regulation of mRNA transcription and mRNA stability., 2005, 6: 75.
[2] Malecki M, Viegas SC, Carneiro T, Golik P, Dressaire C, Ferreira MG, Arraiano CM. The exoribonuclease Dis3L2 defines a novel eukaryotic RNA degradation pathway.,2013, 32(13): 1842–1854.
[3] Chang JH, Jiao XF, Chiba K, Oh C, Martin CE, Kiledjian M, Tong L. Dxo1 is a new type of eukaryotic enzyme with both decapping and 5′-3′ exoribonuclease activity., 2012, 19(10): 1011–1017.
[4] Song MG, Bail S, Kiledjian M. Multiple Nudix family proteins possess mRNA decapping activity.,2013, 19(3): 390–399.
[5] Li Y, Song MG, Kiledjian M. Differential utilization of decapping enzymes in mammalian mRNA decay pathways., 2011, 17(3): 419–428.
[6] Haas G, Braun JE, Igreja C, Tritschler F, Nishihara T, Izaurralde E. HPat provides a link between deadenylation anddecapping in metazoa.,2010, 189(2): 289–302.
[7] Chang CT, Bercovich N, Loh B, Jonas S, Izaurralde E. The activation of the decapping enzyme DCP2 by DCP1 occurs on the EDC4 scaffold and involves a conserved loop in DCP1., 2014, 42(8): 5217–5233.
[8] Wolf J, Valkov E, Allen MD, Meineke B, Gordiyenko Y, McLaughlin SH, Olsen TM, Robinson CV, Bycroft M, Stewart M, Passmore LA. Structural basis for Pan3 binding to Pan2 and its function in mRNA recruitment and deadenylation, 2014, 33(14): 1514–1526.
[9] Huang KL, Chadee AB, Chen CY, Zhang YQ, Shyu AB. Phosphorylation at intrinsically disordered regions of PAM2 motif-containing proteins modulates their interactions with PABPC1 and influences mRNA fate., 2013, 19(3): 295–305.
[10] Bhandari D, Raisch T, Weichenrieder O, Jonas S, Izaurralde E. Structural basis for the Nanos-mediated recruitment of the CCR4-NOT complex and translational repression., 2014, 28(8): 888–901.
[11] Barckmann B, Simonelig M. Control of maternal mRNA stability in germ cells and early embryos., 2013, 1829(6–7): 714–724.
[12] Loh B, Jonas S, Izaurralde E. The SMG5-SMG7 heterodimer directly recruits the CCR4-NOT deadenylase complex to mRNAs containing nonsense codons via interaction with POP2., 2013, 27(19): 2125–2138.
[13] Barišić-Jäger E, Kręcioch I, Hosiner S, Antic S, Dorner S. HPat a decapping activator interacting with the miRNA effector complex.2013, 8(8): e71860.
[14] Chowdhury A, Kalurupalle S, Tharun S. Pat1 contributes to the RNA binding activity of the Lsm1–7-Pat1 complex., 2014, 20(9): 1465–1475.
[15] Wu DH, Muhlrad D, Bowler MW, Jiang SM, Liu Z, Parker R, Song HW. Lsm2 and Lsm3 bridge the interaction of the Lsm1-7 complex with Pat1 for decapping activation., 2014, 24(2): 233–246.
[16] Sharif H, Conti E. Architecture of the Lsm1–7-Pat1 complex: a conserved assembly in eukaryotic mRNA turnover.,2013, 5(2): 283–291.
[17] Badis G, Saveanu C, Fromont-Racine M, Jacquier A. Targeted mRNA degradation by deadenylation-independent decapping., 2004, 15(1): 5–15.
[18] He F, Li CF, Roy B, Jacobson A. Yeast Edc3 targetsmRNA for decapping by binding to a 3′ untranslated region decay-inducing regulatory element.,2014, 34(8): 1438–1451
[19] Muhlrad D, Parker R. The yeast EDC1 mRNA undergoes deadenylation-independent decapping stimulated by Not2p, Not4p, and Not5p., 2005, 24(5): 1033–1045
[20] Nagarajan VK, Jones CI, Newbury SF, Green PJ. XRN 5′→3′ exoribonucleases: structure, mechanisms and functions.,2013, 1829(6–7): 590–603.
[21] Nishihara T, Zekri L, Braun JE, Izaurralde E. miRISC recruits decapping factors to miRNA targets to enhance their degradation., 2013, 41(18): 8692–8705.
[22] Chen CYA, Shyu AB. Deadenylation and P-bodies. In: Chan EKL, Fritzler MJ, eds. Ten Years of Progress in GW/P Body Research. New York: Springer, 2013: 183–195.
[23] Su W, Slepenkov SV, Slevin MK, Lyons SM, Ziemniak M, Kowalska J, Darzynkiewicz E, Jemielity J, Marzluff WF, Rhoads RE. mRNAs containing the histone 3′ stem-loop are degraded primarily by decapping mediated by oligouridylation of the 3′ end., 2013, 19(1): 1–16.
[24] Song MG, Kiledjian M. 3′ Terminal oligo U-tract-mediated stimulation of decapping., 2007, 13(12): 2356–2365.
[25] Rissland OS, Norbury CJ. Decapping is preceded by 3′ uridylation in a novel pathway of bulk mRNA turnover., 2009, 16(6): 616–623.
[26] Sement FM, Ferrier E, Zuber H, Merret R, Alioua M, Deragon JM, Bousquet-Antonelli C, Lange H, Gagliardi D. Uridylation prevents 3′ trimming of oligoadenylated mRNAs., 2013, 41(14): 7115–7127.
[27] Morozov IY, Jones MG, Razak AA, Rigden DJ, Caddick MX. CUCU modification of mRNA promotes decapping and transcript degradation in., 2010, 30(2): 460–469.
[28] Gallouzi IE, Wilusz J. A DIStinctively novel exoribonuclease that really likes U., 2013, 32(13): 1799–1801.
[29] Nissan T, Rajyaguru P, She MP, Song HW, Parker R. Decapping activators inact by multiple mechanisms., 2010, 39(5): 773–783.
[30] Braun JE, Truffault V, Boland A, Huntzinger E, Chang CT, Haas G, Weichenrieder O, Coles M, Izaurralde E. A direct interaction between DCP1 and XRN1 couples mRNA decapping to 5′ exonucleolytic degradation., 2012, 19(12): 1324–1231.
[31] Medina DA, Jordán-Pla A, Millán-Zambrano G, Chávez S, Choder M, Pérez-Ortín JE. Cytoplasmic 5′-3′ exonuclease Xrn1p is also a genome-wide transcription factor in yeast., 2014, 5: 1.
[32] Liu HD, Kiledjian M. Scavenger decapping activity facilitates 5′ to 3′ mRNA decay., 2005, 25(22): 9764–9772.
[33] Wypijewska A, Bojarska E, Lukaszewicz M, Stepinski J, Jemielity J, Davis RE, Darzynkiewicz E. 7-methylguanosine diphosphate (m7GDP) is not hydrolyzed but strongly bound by decapping scavenger (DcpS) enzymes and potently inhibits their activity., 2012, 51(40): 8003–8013.
[34] Buschmann J, Moritz B, Jeske M, Lilie H, Schierhorn A, Wahle E. Identification ofand human 7-methyl GMP-specific nucleotidases., 2013, 288(4): 2441–2451.
[35] Richards J, Liu QS, Pellegrini O, Celesnik H, Yao SY, Bechhofer DH, Condon C, Belasco JG. An RNA pyrophosphohydrolase triggers 5′-exonucleolytic degradation of mRNA in., 2011, 43(6): 940–949.
[36] Laalami S, Zig L, Putzer H. Initiation of mRNA decay in bacteria.,2014, 71(10): 1799–1828.
[37] Linder P, Lemeille S, Redder P. Transcriptome-wide analyses of 5′-ends in RNase J mutants of a gram-positive pathogen reveal a role in RNA maturation, regulation and degradation., 2014, 10(2): e1004207.
[38] Fang M, Zeisberg WM, Condon C, Ogryzko V, Danchin A, Mechold U. Degradation of nanoRNA is performed by multiple redundant RNases in Bacillus subtilis., 2009, 37(15): 5114–5125.
[39] Goldman SR, Sharp JS, Vvedenskaya IO, Livny J, Dove SL, Nickels BE. NanoRNAs prime transcription initiation.,2011, 42(6): 817–825.
[40] Roux CM, DeMuth JP, Dunman PM. Characterization of components of the Staphylococcus aureus mRNA degradosome holoenzyme-like complex., 2011, 193(19): 5520–5526.
[41] Redko Y, Aubert S, Stachowicz A, Lenormand P, Namane A, Darfeuille F, Thibonnier M, De Reuse H. A minimal bacterial RNase J-based degradosome is associated with translating ribosomes., 2013, 41(1): 288–301.
[42] Hu WQ, Sweet TJ, Chamnongpol S, Baker KE, Coller J. Co-translational mRNA decay incerevisiae., 2009, 461(7261): 225–229.
[43] Luro S, Germain A, Sharwood RE, Stern DB. RNase J participates in a pentatricopeptide repeat protein-mediated 5′ end maturation of chloroplast mRNAs., 2013, 41(19): 9141–9151.
[44] Hu HP, Mao SL, Bugrysheva JV, Pruett S, Liotta DC, Scott JR, Snyder JP. Group A streptococcus inhibitors by high-throughput virtual screening., 2014, 82: 120–126.
[45] Li S, Jia Y, Jacobson B, McCauley J, Kratzke R, Bitterman PB, Wagner CR. Treatment of breast and lung cancer cells with a N-7 benzyl guanosine monophosphate tryptamine phosphoramidate pronucleotide (4Ei-1) results in chemosensitization to gemcitabine and induced eIF4E proteasomal degradation., 2013, 10(2): 523–531.
[46] Ziemniak M, Strenkowska M, Kowalska J, Jemielity J. Potential therapeutic applications of RNA cap analogs.,013, 5(10): 1141–1172.
[47] Yoffe Y, Léger M, Zinoviev A, Zuberek J, Darzynkiewicz E, Wagner G, Shapira M. Evolutionary changes in the Leishmania eIF4F complex involve variations in the eIF4E-eIF4G interactions., 2009, 37(10): 3243–3253.
[48] Hopkins KC, McLane LM, Maqbool T, Panda D, Gordesky-Gold B, Cherry S. A genome-wide RNAi screen reveals that mRNA decapping restricts bunyaviral replication by limiting the pools of Dcp2-accessible targets for cap-snatching., 2013, 27(13): 1511–1525.
[49] Dougherty JD, Reineke LC, Lloyd RE. mRNA decapping enzyme 1a (Dcp1a)-induced translational arrest through protein kinase R (PKR) activation requires the N-terminal enabled vasodilator-stimulated protein homology 1 (EVH1) domain., 2014, 289(7): 3936–3949.
[50] Giménez-Barcons M, Alves-Rodrigues I, Jungfleisch J, Van Wynsberghe PM, Ahlquist P, Díez J. The cellular decapping activators LSm1, Pat1, and Dhh1 control the ratio of subgenomic to genomic Flock House virus RNAs., 2013, 87(11): 6192–6200.
[51] Deshmukh MV, Jones BN, Quang-Dang DU, Flinders J, Floor SN, Kim C, Jemielity J, Kalek M, Darzynkiewicz E, Gross JD. mRNA decapping is promoted by an RNA-binding channel in Dcp2., 2008, 29(3): 324–336.
[52] Kulkarni M, Ozgur S, Stoecklin G. On track with P-bodies., 2010, 38(Pt 1): 242–251.
[53] Dorléans A, Li de la Sierra-Gallay I, Piton J, Zig L, Gilet L, Putzer H, Condon C. Molecular basis for the recognition and cleavage of RNA by the bifunctional 5′-3′ exo/endoribonuclease RNase J., 2011, 19(9): 1252–1261.
[54] Eidem TM, Roux CM, Dunman PM. RNA decay: a novel therapeutic target in bacteria., 2012, 3(3): 443–454.
[55] Shoemaker CJ, Green R. Translation drives mRNA quality control., 2012, 9(6): 594–601.
(责任编委: 宋旭)
Mechanism of 5′-to-3′ degradation of eukaryotic and prokaryotic mRNA
Tisen Xu1,2, Xuegui Li1,2, Dejie Jiao1,2, Zhaohui Xie1,2, Zhongmin Dai1,2
RNA degradation plays an important role in modulating gene expression and it affects multiple biological processes. There are three common degradation mechanisms of eukaryotic and prokaryotic mRNA: endonucleolytic, 5′-to-3′ and 3′-to-5′ exonucleolytic degradation. Differences do exist between the two kingdoms. For example, although the 5′-to-3′ exoribonucleolytic degradation is the primary degradation mechanism of eukaryotic mRNA, it plays a minimal role in bacteria, and only in Gram-positive bacteria. Recently, novel RNA degradation mechanisms have been revealed, such as a new eukaryotic mRNA decapping mode mediated by 3′-uridylation and a new 3′-to-5′ degradation pathway independent of exosome. These accumulating discoveries not only deepen the insight of mRNA degradation mechanisms, but also may contribute to the development of novel therapeutic drugs targeting parasites, viruses or cancer. In this review, we summarize the current knowledge of 5′-to-3′ exonucleolytic degradation pathway of eukaryotic and prokaryotic mRNA, and its future therapeutic perspectives.
5′-to-3′ mRNA degradation; gene expression; eukaryotic mRNA; prokaryotic mRNA; drugs
2014-10-26;
2014-11-27
国家自然科学基金项目(编号: 31271667)资助
许禔森,副教授,研究方向:微生物遗传学。E-mail: jnxxx123@163.com
10.16288/j.yczz.14-368
2015-1-19 16:51:16
http://www.cnki.net/kcms/detail/11.1913.R.20150119.1651.001.html

