右旋美托咪定对脓毒血症大鼠心功能障碍的影响
夏继辉,徐世荣,夏文胜,鲁晶
· 论著 ·
右旋美托咪定对脓毒血症大鼠心功能障碍的影响
夏继辉,徐世荣,夏文胜,鲁晶
目的观察右旋美托咪定对脓毒血症大鼠心功能障碍的影响。方法30只SD大鼠随机均分假手术(Sham)组、盲肠结扎穿孔(CLP)组和右旋美托咪定(Dex)组,每组各10只。采用盲肠结扎穿孔法建立大鼠脓毒血症模型。Dex组大鼠建模后即给予负荷量的右旋美托咪定7 μg/kg,20 min后以5 μg/(kg·h)持续泵注,其余两组均于术后持续泵注等量生理盐水。采集术后6 h、12 h、24 h时的平均动脉压(MAP)、心率(HR)、左心室舒张末压(LVEDP)、左心室收缩压(LVSP)、左心室最大收缩速率(+dP/dt),左室最大舒张速率(-dP/dt)。采用ELISA试剂盒法检测血清中血清脂联素、肿瘤坏死因子-α(TNF-α)及白细胞介素-1β(IL-1β)水平。结果与Sham组比较,CLP组与Dex组大鼠在术后6 h、12 h和24 h的血流动力学指标MAP、HR、LVEDP、LVSP、+dP/dt和-dP/dt及24 h的血清脂联素、TNF-α及IL-1β水平均明显均明显降低(P< 0.05)。与CLP组比较,Dex组大鼠在术后6 h、12 h和24 h的血流动力学指标MAP、HR、LVEDP、LVSP、+dP/dt及-dP/dt均明显升高(P<0.05),术后24 h时血清脂联素水平升高、TNF-α及IL-1β水平明显减少(P<0.05)。结论Dex可明显改善脓毒血症大鼠心功能障碍并维持血流动力学稳定,其作用可能与上调血清脂联素表达水平、抑制TNF-α和IL-1β炎症因子表达,减轻脓毒症所致心脏毒性和心肌损伤有关。
右旋美托咪定;脓毒血症;心功能障碍
脓毒血症是目前临床上具有极高威胁性的临床综合征,其本质是由多种原因引起的失控的全身炎症反应综合征(SIRS),表现为血流动力学不稳定和组织细胞氧代谢障碍,其具有高发病率和病死率,成为重症监护病房非心脏病患者死亡的主要原因[1]。尽管近年来在加强抗感染治疗的基础上配合器官功能支持等治疗措施上取得了长足进步,但合并脓毒血症患者,其心功能抑制的发生率仍达40%,出现脓毒症休克时病死率高达50%~70%[2,3]。右旋美托咪定(Dex)是一种新型高选择性的α2肾上腺素能受体激动剂,主要用于术中或重症监护病房(ICU)患者的镇静。研究发现Dex具有抗炎作用,能够抑制炎症因子的产生,对肾、脑等器官功能有一定保护作用[4-6]。本研究通过观察Dex对脓毒血症大鼠血流动力学和血清炎症因子表达水平的影响,探讨右旋美托咪定对改善脓毒血症大鼠心功能障碍的可行性。
1 材料与方法
1.1 试剂和仪器盐酸右旋美托咪定注射液(江苏恒瑞医药股份有限公司,中国),低温高速离心机(Eppedorf公司,德国),微量移液器(Eppedorf公司,德国),酶标仪(Thermo公司,美国),MedLab生物信号采集处理系统(北京众实迪创科技发展有限责任公司,中国),大鼠脂联素、肿瘤坏死因子α(TNF-α)及白细胞介素-1β(IL-1β)酶联免疫法(ELISA)检测试剂盒(武汉博士德生物有限公司)。
1.2 实验动物与分组SPF级成年SD大鼠30只,由扬州大学医学中心提供,雌雄不拘,体质量280~320 g,随机均分为以下3组:假手术(Sham)组、盲肠结扎穿孔法(CLP)组和右旋美托咪定(Dex)组,每组10只。所有大鼠实验前静养1周,温度(23±1)℃,自由进食饮水。实验动物使用遵守实验动物伦理的相关规定。
1.3 动物模型制备和药物处理参照文献[7,8]建立CLP致大鼠脓毒血症模型:术前禁食6 h,10%水合氯醛(350 mg/kg)腹腔注射麻醉,取仰卧位,固定四肢及头部,24号套管针左侧股静脉和右侧股动脉置管。于大鼠中下腹沿正中线做1 cm长切口,暴露腹腔脏器并游离肠系膜,探查找到盲肠。以4-0丝线距盲肠根部1.5 cm、血管弓内环形结扎盲肠根部,用18号针头在结扎远端贯通穿刺一次,挤出粪便少许,还纳肠段,依次缝合腹膜和皮肤。Sham组仅剖腹探查盲肠后即刻缝合腹壁切口;CLP症组采用CLP复制脓毒症模型;两组均于术后经股静脉套管持续泵注等量生理盐水。Dex组同样采用CLP复制脓毒症模型,术后经股静脉套管给予负荷量的右旋美托咪定7 μg/kg,20 min后继而以5 μg/(kg·h)持续泵注[9]。
1.4 血流动力学监测大鼠腹腔麻醉后,将股动脉插管通过压力传感器连接于MedLab生物信号采集处理系统,观察并记录术后6 h、12 h、24 h时的平均动脉压(MAP);将电极针插入动物四肢皮下,连接好导联线,进行心电图监测并记录心率(HR);经左心室插管记录左室收缩曲线。计算左室舒张末压(LVEDP)、左心室收缩压(LVSP),左心室最大收缩速率(+dP/dt),左室最大舒张速率(-dP/dt)。
1.5 血清脂联素、TNF-α及IL-1β检测于CLP术后24 h经股静脉导管取股静脉血5 ml,1500 r/min离心15 min后取血清,用乙二胺四乙酸(EDTA)抗凝处理,-80°C深低温保存。采用ELISA试剂盒法检测血清中血清脂联素、TNF-α)及IL-1β水平,按试剂盒说明书步骤进行操作,酶标仪测定各物质光密度值,建立标准曲线,根据标准曲线计算血清中各物质含量。
1.6 统计分析应用SPSS13.0统计学软件进行分析。计量资料以均数±标准差(±s)表示。血流动力学指标采用重复测量方差分析,组间两两比较采用Bonferroni t检验,血清脂联素、TNF-α及IL-1β表达水平采用单因素方差分析,组间两两比较采用q检验。P<0.05差异有统计学意义。
2 结果
2.1 术后各组大鼠血流动力学指标变化与Sham组比较,CLP组与Dex组大鼠在术后6 h、12 h和24 h时血流动力学指标MAP、HR、LVEDP、LVSP、+dP/dt及-dP/dt均明显降低,三组比较差异有统计学意义(P<0.05)。与CLP组比较,Dex组大鼠在术后6 h、12 h和24 h时血流动力学指标MAP、HR、LVEDP、LVSP、+dP/dt及-dP/dt均明显升高,两组比较差异有统计学意义(P<0.05)(表1~3)。
2.2 术后24 h各组大鼠血清脂联素、TNF-α及IL-1β表达变化与Sham组比较,CLP组与Dex组大鼠术后24 h血清脂联素、TNF-α及IL-1β水平明显减少,三组比较差异有统计学意义(P<0.05)。与CLP组比较,术后24 h血清脂联素水平升高、TNF-α及 IL-1β水平明显减少,两组比较差异有统计学意义(P<0.05),(表4)。
3 讨论
脓毒血症诱导的心功能障碍是造成脓毒血症预后不良的重要因素之一,研究发现,40%~50%的脓毒血症患者可并发心功能不全,约7%出现严重心功能障碍[10]。脓毒血症引起心功能障碍的因素:一方面心脏局部炎症因子增加,如TNF-α和IL-1β等炎性介质的直接的心肌毒性作用是导致心功能障碍的重要因素;另一方面,由于炎症介质过度激活所诱发的“瀑布效应”及氧自由基损伤是造成心肌损伤的另一重要机制[11]。在脓毒血症引起的炎性介质大量释放的过程中,TNF-α和IL-1β作为介导炎症反应重要的启动因子,其引发的氧自由基等物质的释放最终对心肌功能产生抑制性影响,继而引发一系列病理生理改变。基于此,TNF-α和IL-1β被认为是脓毒血症病情发展的重要介质。治疗脓毒血症诱导的心功能障碍的关键是减轻炎症因子介导的心脏毒性和氧自由基导致的心肌损伤,从而维持血流动力学稳定。Dex是一种目前临床上使用的新型高选择性的α2肾上腺素能受体激动剂,具有抗焦虑、镇静、抑制唾液分泌、抗交感和稳定血流动力学等多种效应,广泛应用麻醉辅助用药或重症监护病房。研究发现[12,13],Dex具有抗炎作用,能够抑制包括TNF-α、IL-1β、白介素-6(IL-6)在内的多种炎性因子的产生,并对心、肾、脑等器官有保护作用。
本研究采用CLP法建立大鼠脓毒血症模型,观察Dex对脓毒血症大鼠血流动力学和血清炎症因子表达水平的影响。研究结果显示:与Sham组大鼠相比,术后6 h开始CLP组大鼠出现HR明显增快以及MAP、LVEDP、LVSP、+dP/dt和-dP/dt明显降低,表明CLP法建立的大鼠脓毒血症模型出现明显的心功能障碍并伴血流动力学异常,随脓毒血症的病程持续而进行性的恶化;然而Dex组大鼠虽然也出现心功能障碍和血流动力学异常表现,但较CLP组大鼠明显改善,且该过程没有出现随脓毒血症的病程持续而进行性的恶化的趋势,表明Dex可减轻脓毒血症大鼠心功能异常。我们还发现脓毒血症大鼠血清炎症因子TNF-α和IL-1β水平明显增加,而Dex可以抑制脓毒血症大鼠血清炎症因子TNF-α和IL-1β水平增加。推测Dex改善脓毒血症大鼠心功能障碍的作用可能与抑制炎症因子表达水平,减轻炎症因子介导的心脏毒性和氧自由基导致的心肌损伤有关,从而维持血流动力学稳。
表1 术后6 h三组大鼠血流动力学指标比较表(±s)
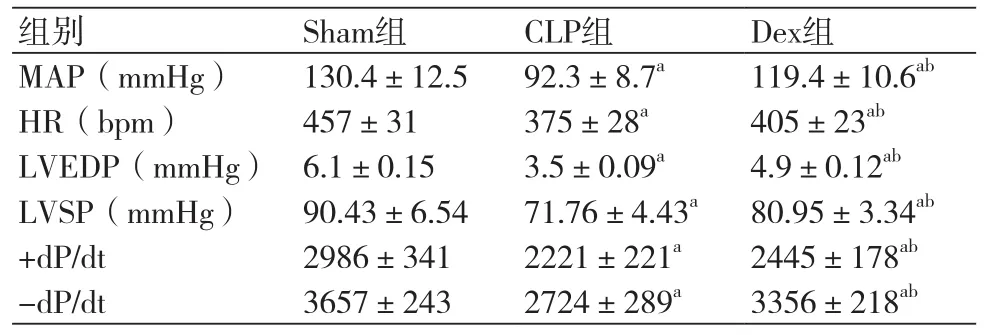
表1 术后6 h三组大鼠血流动力学指标比较表(±s)
注:MAP:平均动脉压;HR:心率;LVEDP:左室射血分数;LVSP:左心室收缩压;+dP/dt:左心室最大收缩速率;-dP/dt:左室最大舒张速率;与Sham组比较,aP<0.05;与CLP组比较,bP<0.05
组别 Sham组 CLP组 Dex组MAP(mmHg) 130.4±12.5 92.3±8.7a 119.4±10.6abHR(bpm) 457±31 375±28a 405±23abLVEDP(mmHg) 6.1±0.15 3.5±0.09a 4.9±0.12abLVSP(mmHg) 90.43±6.54 71.76±4.43a 80.95±3.34ab+dP/dt 2986±341 2221±221a 2445±178ab-dP/dt 3657±243 2724±289a 3356±218ab
表2 术后12 h三组大鼠血流动力学指标比较表(±s)
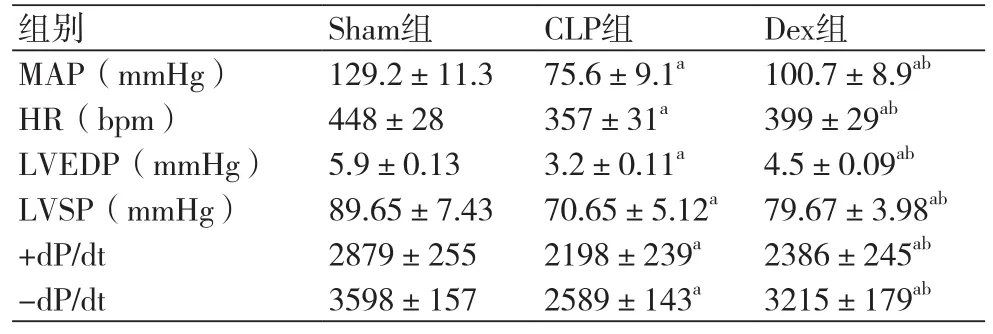
表2 术后12 h三组大鼠血流动力学指标比较表(±s)
注:MAP:平均动脉压;HR:心率;LVEDP:左室射血分数;LVSP:左心室收缩压;+dP/dt:左心室最大收缩速率;-dP/dt:左室最大舒张速率;与Sham组比较,aP<0.05;与CLP组比较,bP<0.05
组别 Sham组 CLP组 Dex组MAP(mmHg) 129.2±11.3 75.6±9.1a 100.7±8.9abHR(bpm) 448±28 357±31a 399±29abLVEDP(mmHg) 5.9±0.13 3.2±0.11a 4.5±0.09abLVSP(mmHg) 89.65±7.43 70.65±5.12a 79.67±3.98ab+dP/dt 2879±255 2198±239a 2386±245ab-dP/dt 3598±157 2589±143a 3215±179ab
表3 术后24 h三组大鼠血流动力学指标比较表(±s)
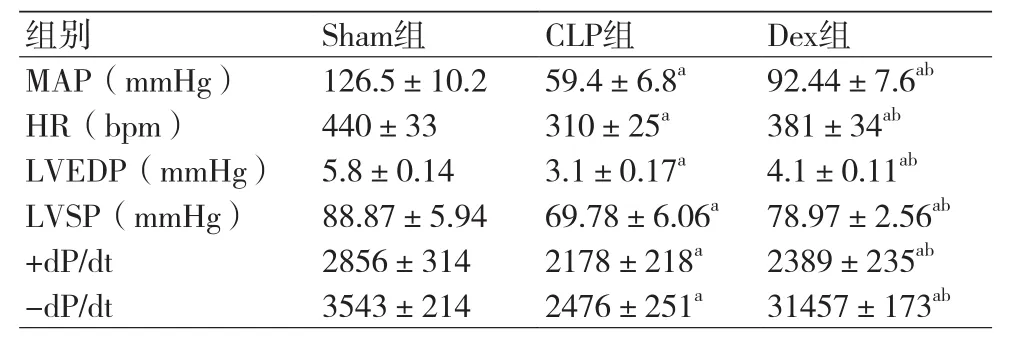
表3 术后24 h三组大鼠血流动力学指标比较表(±s)
注:MAP:平均动脉压;HR:心率;LVEDP:左室射血分数;LVSP:左心室收缩压;+dP/dt:左心室最大收缩速率;-dP/dt:左室最大舒张速率;与Sham组比较,aP<0.05;与CLP组比较,bP<0.05
组别 S h a m组 C L P组 D e x组M A P(m m H g) 1 2 6 . 5 ± 1 0 . 2 5 9 . 4 ± 6 . 8a 9 2 . 4 4 ± 7 . 6abH R(b p m) 4 4 0 ± 3 3 3 1 0 ± 2 5a 3 8 1 ± 3 4abL V E D P(m m H g) 5 . 8 ± 0 . 1 4 3 . 1 ± 0 . 1 7a 4 . 1 ± 0 . 1 1abL V S P(m m H g) 8 8 . 8 7 ± 5 . 9 4 6 9 . 7 8 ± 6 . 0 6a 7 8 . 9 7 ± 2 . 5 6ab+ d P / d t 2 8 5 6 ± 3 1 4 2 1 7 8 ± 2 1 8a 2 3 8 9 ± 2 3 5ab-d P / d t 3 5 4 3 ± 2 1 4 2 4 7 6 ± 2 5 1a 3 1 4 5 7 ± 1 7 3ab
表4 三组大鼠术后24 h血清脂联素、TNF-α及IL-1β水平变化比较(±s)

表4 三组大鼠术后24 h血清脂联素、TNF-α及IL-1β水平变化比较(±s)
注:TNF-α:肿瘤坏死因子;IL-1β:白细胞介素-1β;与Sham组比较,aP<0.05;与CLP组比较,bP<0.05
组别 脂联素 T N F -α I L -1 β S h a m组 4 . 3 9 ± 0 . 7 6 5 . 2 4 ± 0 . 5 5 4 . 6 9 ± 0 . 9 1 C L P组 1 . 0 8 ± 0 . 1 2a 1 8 . 3 3 ± 1 . 7 8a 1 5 . 4 5 ± 1 . 7 6aD e x组 2 . 6 8 ± 0 . 5 4ab 1 0 . 4 5 ± 1 . 9 7ab 9 . 3 9 ± 1 . 0 1ab
近年来研究表明,脂联素可抑制TNF-α等炎症因子的表达,参与减轻炎症反应,是炎症免疫反应的重要负性调节因子[14,15]。本研究我们也发现CLP组大鼠血清脂联素水平明显降低,且血清TNF-α和IL-1β水平明显增加;经Dex治疗组大鼠血清脂联素水平明显升高,血清TNF-α和IL-1β水平明显降低。推测Dex可能通过增加血清脂联素表达水平,降低血清TNF-α和IL-1β水平。
本研究发现Dex可明显改善脓毒血症大鼠心功能障碍并维持血流动力学稳定,其作用可能与上调血清脂联素表达水平、抑制TNF-α和IL-1β炎症因子表达,减轻脓毒症所致心脏毒性和心肌损伤有关。本研究为临床应用Dex纠正脓毒血症大鼠心功能障碍提供新的思路和实验依据。
[1] 孟强,董伟,屈峰. 早期血液滤过对脓毒血症患者血浆IL-10和单核细胞人白细胞抗原-DR表达的影响[J]. 中国医学创新,2014, 11(7):6-8.
[2] Gamkrelidze M,Intskirveli N,Vardosanidze K,et al. Myocardial dysfunction during septic shock (review)[J]. Georgian Med News,2014,(237):40-6.
[3] Walley KR. Deeper understanding of mechanisms contributing to sepsis-induced myocardial dysfunction[J]. Crit Care.2014, 18(3):137.
[4] Giovannitti JA Jr,Thoms SM,Crawford JJ. Alpha-2 adrenergic receptor agonists: a review of current clinical applications[J]. Anesth Prog,2015, (1):31-9.
[5] Zhang X,Zhao X,Wang Y. Dexmedetomidine: a review of applications for cardiac surgery during perioperative period[J]. J Anesth,2015, 29(1):102-11.
[6] Mantz J,Josserand J,Hamada S. Dexmedetomidine:new insights[J]. Eur J Anaesthesiol. 2011,28(1):3-6.
[7] Hu D,Yang X,Xiang Y,et al. Inhibition of Toll-like receptor 9 attenuates sepsis-induced mortality through suppressing excessive inflammatory response[J]. Cell Immunol. 2015,295(2):92-8.
[8] Zhang J,Wang Z,Wang Y,et al. The effect of dexmedetomidine on inflammatory response of septic rats[J]. BMC Anesthesiol. 2015, 1(15):68.
[9] 于冬梅,张铁铮,周锦,等. 右美托咪定对内毒素血症大鼠急性肾损伤的保护作用[J]. 实用药物与临床,2014,17(12):1545-7.
[10] Kimmoun A,Ducrocq N,Levy B. Mechanisms of vascular hyporesponsiveness in septic shock[J]. Curr Vasc Pharmacol,2013, 11(2):139-49.
[11] Krishnagopalan S,Kumar A,Parrillo JE,et al. Myocardial dysfunction in the patient with sepsis[J]. Curr Opin Crit Care,2002,8(5):376-88.
[12] Cai Y,Xu H,Yan J,et al. Molecular targets and mechanism of action of dexmedetomidine in treatment of ischemia/reperfusion injury[J]. Mol Med Rep,2014,9(5):1542-50.
[13] Chen C,Zhang Z,Chen K,et al. Dexmedetomidine regulates inflammatory molecules contributing to ventilator-induced lung injury in dogs[J]. J Surg Res,2014,187(1):211-8.
Influence of dexmedetomidine on cardiac dysfunction in rats with sepsis
XIA Ji-hui*, XU Shi-Rong, XIA Wen-Sheng, LU Jing.*Department of Cardiology, Second People's Hospital of Taizhou City, Taizhou 225599, China.
XIA Ji-hui, E-mail: Jiangyanheart@126.com
ObjectiveTo observe the influence of dexmedetomidine on cardiac dysfunction in rats with sepsis.MethodsSD rats (n=30) were randomly divided into sham-operation group (Sham group), cecal ligation and puncture group (CLP group) and dexmedetomidine group (Dex group, each n=10). The rat model of sepsis was established by applying CLP. Dex group was given load dose of Dex (7 μg/kg, and 5 μg/kg·h after 20 min), and other 2 groups were given the same dose of normal saline solution. The changes of mean arterial pressure (MAP), heart rate (HR), LVEDP, LVSP, +dP/dt and -dP/dt were observed after CLP for 6 h, 12 h and 24 h respectively. The levels of serum adiponectin (ADP), tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) were detected by using ELISA.ResultsCompared with Sham group, MAP, HR, LVEDP, LVSP, +dP/dt and -dP/dt after 6 h, 12 h and 24 h, and levels of serum ADP, TNF-α and IL-1β after 24 h decreased significantly in CLP group and Dex group (P<0.05). Compared with CLP group, MAP, HR, LVEDP, LVSP, +dP/dt and -dP/dt after 6 h, 12 h and 24 h increased significantly (P<0.05), level of serum ADP increased and levels of TNF-α and IL-1β decreased significantly (P<0.05) in Dex group after 24 h.ConclusionDex can significantly relieve cardiac dysfunction and maintain stable hemodynamics in sepsis rats, and the effect maybe related to up-regulating serum ADP, inhibiting TNF-α and IL-1β, and abating sepsis-induced cardiotoxicity and myocardial injury.
Dexmedetomidine; Sepsis; Cardiac dysfunction
R631
A
1674-4055(2015)06-0843-03
2015-06-02)
(责任编辑:孙竹)
225599 泰州,泰州市第二人民医院心内科
夏继辉,E-mail:Jiangyanheart@126.com
10.3969/j.issn.1674-4055.2015.06.37

