广西首例牛源鹿流行性出血热病毒的分离鉴定
曹颖颖,吴健敏,林 俊,朱建波,杨振兴,覃绍敏,蓝显利
(1.广西大学 动物科学技术学院,广西 南宁 530004;2.广西壮族自治区兽医研究所,广西 南宁 530001;3.云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室,云南 昆明 650224;4.广西马山县动物疫病预防控制中心,广西 马山 530699)
鹿流行性出血热(Epizootic hemorrhagic disease,EHD)是由呼肠孤病毒科环状病毒属鹿流行性出血热病毒(EHDV)引起的一种虫媒病毒病。1955 年首先在新泽西白尾鹿中分离到[1]。以白尾鹿、糜鹿、大角羚羊等多种驯养和野生反刍动物体温升高、呼吸困难、粘膜和浆膜面出血、常处于昏迷状态下死亡为特征的严重致死性传染病。牛感染导致怀孕牛流产、死产,严重影响畜牧业及国际贸易的发展[2]。
EHDV 为双股RNA 病毒,具有10 个节段(L1-L3、M4-M6、S7-S10),基因组编码7 种结构蛋白(VP1~VP7)和4 种非结构蛋白(NS1、NS2、NS3、NS3a)。病毒VP7 蛋白与群特异有关,VP2 蛋白与型特异相关[3]。血清型数量尚不明确,目前根据其血清学反应至少确定了8 个血清型[4]。
我国在牛、羊血清中已检测到EHDV 阳性抗体,但暂未开展系统性调查,因此对EHDV 的分布及危害情况知之甚少,亟待开展研究。为此本研究在广西马山县设立虫媒病监控点,经采血检验筛选EHDV 抗体阴性动物作为哨兵动物,通过对哨兵动物定期采血监测,并在哨兵动物EHDV 抗体转阳时采集血细胞进行病原分离鉴定,分离到3 株EHDV,明确当地存在EHDV 感染,为广西乃至全国开展EHDV 的预防和控制提供了有价值的参考资料。
1 材料和方法
1.1 监控群的建立 根据气候条件、地理位置等因素综合考虑,选择在23°41′N,108°13′E,海拔299米的马山县白山镇民族村建立监控点。采用竞争性ELISA(C-ELISA)检测牛羊EHDV 抗体情况,筛选1岁以下EHDV 抗体阴性的10 头牛(6 头黄牛和4 头水牛)和5 只羊作为哨兵动物,分别混养在EHDV抗体阳性的牛群及羊群中,组成监控群,采用白天放牧,夜间赶进栏舍的方式饲养。
1.2 样品采集 对哨兵动物每年1~4 月每月采血一次,5~12 月每周采血一次。每次均需采集1 份无抗凝剂全血,分离血清后-20 ℃保存,用于检测EHDV 抗体。1 份肝素钠抗凝全血4 ℃保存,用于病毒核酸检测及病毒的分离。
1.3 主要试剂 EHDV C-ELISA 抗体检测试剂盒、BHK-21 细胞、EHDV-2、EHDV-5、EHDV-7 标准株及其标准血清均由云南省畜牧兽医科学院热带亚热带动物病毒病重点实验室提供;E.coli DH5α 购自天根生化科技(北京)有限公司;pMD18-T 载体、RTPCR 一步法试剂盒及胶回收试剂盒均购自TaKaRa公司。
1.4 EHDV 抗体检测 参照C-ELISA 试剂盒说明书方法检测2013 年全年监控群血清。
1.5 EHDV 抗原检测 取哨兵动物血清EHDV 抗体阳转时间点及前、后两周的肝素钠抗凝血红细胞按常规TRIzol 法抽提核酸。参照文献[5]针对EHDV相对保守的S7 节段设计引物,序列为:PA:5'-GT TAAAATTTGGTGAAGATGG-3'/PB:5'-GTAAGTTG AATTTGGGAAGAGG-3',采用一步法RT-PCR 进行目的片段的扩增,预期扩增片段为1 162 bp。RTPCR 反应条件为:45 ℃40 min,95 ℃2 min;94 ℃30 s、50 ℃30 s、72 ℃1 min 30 s,40 个循环;72 ℃5 min,PCR 产物经1 %琼脂糖凝胶电泳检测。
1.6 病毒分离及其TCID50测定 经1.5 方法EHDV抗原检测为阳性的肝素钠抗凝血,用0.05 M PBS 洗涤红细胞并裂解后,按常规方法接种BHK-21 细胞进行病毒分离。将分离株接种BHK-21 细胞。参照文献[6]方法进行病毒TCID50测定。
1.7 病毒的鉴定
1.7.1 病毒群特异性鉴定 以PA/PB 为引物,利用一步法RT-PCR 扩增EHDV 的S7 节段基因进行EHDV 群特异性鉴定。
1.7.2 病毒血清型鉴定
1.7.2.1 病毒血清型的RT-PCR 鉴定:采用一步法RT-PCR 扩增EHDV 的分型节段S2 部分基因,PCR产物经胶回收后测序,使用DNAStar 的MegAlign进行同源性分析,同时通过MEGA5.0 构建系统进化树。
1.7.2.2 EHDV 阳性血清样品中和试验:参考GB/T 18089-2000 方法[7],将抗体检测为强阳性的血清样品与EHDV 标准病毒株做中和试验判断分离株血清型,并采用Reed-Muench 法计算阳性血清中和效价[3]。
1.7.2.3 EHDV 分离株中和试验:参照GB/T 18089-2000 方法[7],将病毒分离株与EHDV 标准血清进行中和试验,判断分离株的血清型。
2 结果
2.1 抗体检测 采用EHDV C-ELISA 试剂盒检测2013 年全年监控群血清,结果显示7 月11 日两头黄牛血清抗体转阳,7 月25 日又有一头黄牛血清抗体转阳。3 头EHDV 抗体转阳前后血清样品检测结果见表1。
2.2 EHDV 抗原检测 采用EHDV-S7 特异性引物PA/PB 对EHDV 抗体转阳时间点及转阳前、后一周的肝素钠抗凝血进行RT-PCR 检测,结果显示有7份抗凝血样品可以扩增获得约1 200 bp 的目的片段(图1)。并且在哨兵动物血清抗体转阳前1~2 周的肝素钠抗凝血红细胞可以检测出EHDV 核酸的可能性更大(表1)。
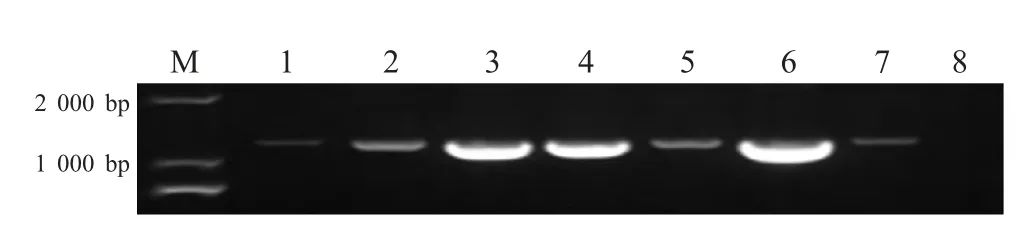
图1 EHDV 抗体转阳哨兵牛抗凝血样品中EHDV-S7 检测结果Fig.1 The RT-PCR detection of EHDV-S7 in the blood samples of cows with the seroconversion
2.3 病毒分离及毒价测定 将EHDV 抗体转阳前后两周的肝素钠抗凝血样品接种BHK-21 细胞,结果显示,其中EHDV 核酸检测呈阳性的7 份样品均能够引起BHK-21 细胞出现细胞病变(CPE)。一般接种后3 d~5 d 开始出现细胞变圆,胞质内颗粒增多聚合、脱落。收获细胞盲传3 代后,CPE 变得规律、典型。将阳性样品抗体、抗原检测及病毒的分离情况列于表1,结果显示在哨兵动物抗体转阳前2 周分离病毒的成功率高。采用常规方法对3 头黄牛分离病毒株0540-2、0541-2 和0554-2 的TCID50进行测定,其毒价分别为102.5/0.1 mL、102.83/0.1 mL 和102.5/0.1 mL。

表1 监控动物EHDV 血清抗体转阳及其分离情况Table 1 Monitoring animal EHDV seroconversion and its virus isolated
2.4 病毒的鉴定
2.4.1 EHDV-S7 序列测定与分析 3 株分离株感染BHK-21 细胞,待CPE 达75 %时收获病毒,冻融3次后,提取病毒总RNA,采用RT-PCR 一步法扩增EHDV 群特异性基因S7 并测序。3 株分离株均获得大小约1 162 bp 的目的基因序列。同源性分析发现3 个分离株序列同源性高达99.8 %,3 株分离株应来自媒介库蠓传播的同一株病毒。通过与GenBank数据库中不同血清型EHDV-S7 节段基因序列进行比对,结果显示本实验分离株序列与EHDV-5 代表序列高度同源,同源性达94.3 %。由此进一步证实所获分离株的血清型很可能为EHDV-5 型。
2.4.2 EHDV 分离株血清型的RT-PCR 鉴定 扩增0554-2 的S2 节段部分基因测序后在GenBank 数据库中比对,结果显示本实验分离株S2 序列与EHDV-5 代表株CSIRO157 S2 序列高度同源,同源性达92%;证实了此次广西EHDV 分离株为EHDV-5型。选取GenBank 中EHDV 各型代表病毒株S2 节段序列,通过MEGA5 软件构建系统进化树(图2),结果显示本实验分离株与EHDV-5 CSIRO157 为同一个分支,并且进化树与报道显示的S2 节段可将EHDV分成4 大组一致[8]。EHDV-2 与EHDV-7 同源关系接近为同一组,EHDV-6 与EHDV-8 为一组,EHDV-1单独为一组,EHDV-4 与EHDV-5 为一组。
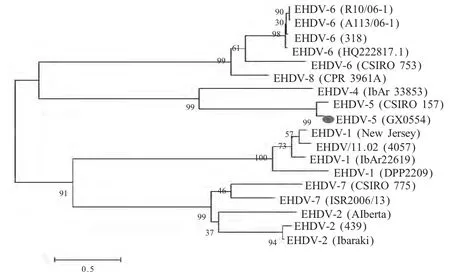
图2 分离株EHDV-S2 节段基因序列系统进化树Fig.2 Phylogenetic tree base on S2 sequences of EHDV
2.4.3 中和试验定型鉴定
2.4.3.1 EHDV 阳性血清样品中和试验:采用EHDV-2、EHDV-5 和EHDV-7 标准株与3 株分离株对应的阳性血清样品进行微量血清中和试验,结果3 份血清对EHDV-2 和EHDV-7 标准株感染均无中和作用,接毒细胞均出现CPE。而对EHDV-5 标准株具有中和作用(表2),根据细胞出现CPE 的比例利用Reed-Muench 法计算样品阳性血清和标准株的中和效价分别为1∶226、1∶80 和1∶226。
2.4.3.2 分离株的病毒中和试验:采用EHDV-2、EHDV-5、EHDV-7 标准血清与0540、0541 及0554分离株进行微量病毒中和试验,结果显示,3 株病毒与EHDV-2 和EHDV-7 标准血清均无中和反应,而与EHDV-5 标准血清发生中和反应(表3),根据细胞出现CPE 的比例利用Reed-Muench 法计算分离株和标准血清中和效价分别为1∶113、1∶113 和1∶54。
表2 阳性血清抗体中和试验Table 2 Positive serum antibody neutralization test
表3 分离株病毒中和试验Table 3 Isolates neutralization test
3 讨论
EHDV 与蓝舌病病毒均属典型的昆虫媒介病,疫病的分布与媒介昆虫分布区域基本一致,均与地理位置及典型气候条件相关。上世纪60 年代和90年代日本暴发茨城病(EHDV-2),2006 年~2007 年,以色列、土耳其、摩洛哥、突尼斯、阿尔及利亚和约旦的奶牛和肉牛暴发了EHDV-6 的318 株及EHDV-7,引起牛发病且牛场遭受严重的经济损失[4]。提醒我们必须加强昆虫媒介疾病的研究,了解其分布区域、流行变化趋势及致病力变化情况对做好昆虫媒介病的防控至关重要。
广西属亚热带季风气候区,气温较高、降水多,非常适合媒介昆虫的生长。本研究选择的虫媒病监控点位于低海拔、高气温、降水充沛地区,对虫媒病的监控具有代表性。通过设立监控动物群,选取1 岁以下EHDV 阴性动物与阳性动物混养,持续监控哨兵动物血清抗体水平,选择抗体转阳动物的血细胞进行病毒分离,从3 头转阳哨兵动物中分离到3 株病毒,经微量中和试验和遗传进化分析,证明所分离到的病毒均为EHDV-5 型。这是首次在广西牛群中分离到EHDV,从而也证明广西牛群中存在EHDV 感染。这也说明通过建立监控群,从转阳动物分离病毒是分离虫媒病毒的有效方法,对其它病毒的分离也有借鉴作用。
本研究进行期间,哨兵动物共有3 头黄牛抗体转阳,而4 头水牛5 只哨兵羊并未发生阳转现象,提示黄牛对EHDV 更敏感,是EHDV 监测的首选动物。但本研究黄牛感染EHDV 后并未出现明显的临床症状,提示黄牛在EHDV 的传播中仅起到贮存宿主的作用[4]。此外,EHDV 在广西的媒介宿主究竟是库蠓属哪几种成员也是亟待研究的问题。
[1]陈志飞,李树清.鹿流行性出血热病毒[J].畜牧与兽医,1997,29(3):132-133.
[2]李晓成.鹿流行性出血病诊断方法研究初报[J].中国动物检疫,1990,2:1-4.
[3]Anbalagan S,Cooper E,Klumper P,et al.Whole genome analysis of epizootic hemorrhagic disease virus identified limited genome constellations and preferential reassortment[J].J Gen Virol,2014,95(Pt 2):434-441.
[4]Savini G,Afonso A,Mellor P,et al.Epizootic heamorragic disease[J].Res Vet Sci,2011,91(1):1-17.
[5]阮周曦,花群义,杨俊兴,等.4 种动物虫媒病病毒多重RT-PCR 检测方法的建立[J].动物医学进展,2010,31(2):25-31.
[6]GB/T 18089-2008.蓝舌病病毒分离、鉴定及血清中和抗体检测技术[S].
[7]GB/T 18089-2000.中华人民共和国国家标准蓝舌病微量血清中和试验及病毒分离和鉴定方法[S].
[8]Anthony S J,Maan S,Maan N,et al.Genetic and phylogenetic analysis of the outer-coat proteins VP2 and VP5 of epizootic haemorrhagic disease virus(EHDV):comparison of genetic and serological data to characterise the EHDV serogroup[J].Virus Res,2009,145(2):200-210.

