低盐养殖大黄鱼部分器官的组织学特征
金希哲,陈庆凯,3,叶 坤,龚诗琦,王志勇,谢仰杰
(1.集美大学水产学院,福建 厦门 361021;2.农业部东海海水健康养殖重点实验室,福建 厦门 361021;
3.宁德市水产技术推广站,福建 宁德 352100)
低盐养殖大黄鱼部分器官的组织学特征
金希哲1,2,陈庆凯1,2,3,叶坤1,2,龚诗琦1,2,王志勇1,2,谢仰杰1,2
(1.集美大学水产学院,福建 厦门 361021;2.农业部东海海水健康养殖重点实验室,福建 厦门 361021;
3.宁德市水产技术推广站,福建 宁德 352100)
[摘要]对低盐养殖大黄鱼(低盐组)与正常海水养殖大黄鱼(对照组)的肥满度、肝体指数和鳃、肾、肝、性腺的组织学特征进行了比较.结果表明:生物学参数方面,低盐组大黄鱼的体长(17.31±1.76)cm、体重(56.31±13.85)g、肥满度(1.08±0.14)和肝体指数(0.50±0.11)均显著低于对照组(体长(23.85±1.13)cm,体重(267.91±42.74)g,肥满度(1.96±0.10)及肝体指数(1.16±0.12));组织学特征方面,低盐组与对照组相比,低盐组的鳃丝明显较宽,鳃小片上皮细胞增生、肥大,部分鳃小片上皮明显隆起、上皮细胞脱落、坏死,黏液细胞体积变大且数目大量增多,泌氯细胞数量大量增加且胞体变大;低盐组肾小体体积膨大,各级肾小管管径变大,肝细胞肿大、变形,出现大量空泡,部分肝细胞细胞核偏离细胞中心.低盐组大黄鱼性腺中,切片所得多为第Ⅱ、第Ⅲ时相卵母细胞,第Ⅳ时相卵母细胞几不可见,第Ⅲ时相卵母细胞不够饱满,脂肪滴小而密,且卵黄集中在细胞膜内缘,相对于对照组明显偏少.
[关键词]大黄鱼;低盐养殖;鳃;肾;肝;性腺;组织学
0引言
大黄鱼(Larimichthys crocea)属鲈形目、石首鱼科、黄鱼属,是我国重要的海水养殖鱼类,在20世纪70年代前为我国近海四大渔捞对象之首,有我国“海水国鱼”之称,其营养丰富、肉质鲜美.随着大黄鱼人工育苗技术的突破,大黄鱼养殖业得到迅速发展,成为我国海水养殖鱼类中养殖规模最大的种类之一.近十几年来,由刺激隐核虫引起的“白点病”频发,使渔民经济损失惨重.由于刺激隐核虫在低盐环境中不易存活,在盐度为6的海水下,15 min即可完全杀死刺激隐核虫幼虫[1],随着盐度继续降低,灭杀效果越好.大黄鱼有较强的耐低盐能力,用较低盐度水体进行大黄鱼养殖,有可能避免因刺激隐核虫病而引起的重大损失.此外,我国沿海拥有大量的低盐养殖水域,如能在低盐水域养殖大黄鱼,不但能拓展大黄鱼养殖空间,还能减轻近海网箱养殖的压力.李兵等[2]采用低盐咸水驯化养殖的方式研究了大黄鱼的摄食生长与存活,探讨了大黄鱼淡化养殖的可能性,为我国的大黄鱼低盐度水域的推广养殖起到了积极作用.
国内外学者已在盐度变化对海水鱼类的影响方面作了研究,内容涉及多个学科领域[3-12],于娜等[11]利用组织学切片的手段研究了盐度对鲻鱼消化生理和渗透调节生理的影响,发现随着盐度的升高,其鳃和肾器官发生不同程度的组织生理变化;盐度变化对于大黄鱼的影响,国内也已有一些研究报道[13-16],李兵等[13]报道了大黄鱼早期各发育阶段对盐度的适应范围,为大黄鱼的低盐养殖及白点病的淡水浴治疗提供了依据,沈盎绿和陈亚瞿[16]通过低盐度驯化大黄鱼的研究表明,在盐度小于10的试验组中,体长为9 cm左右的大黄鱼刚开始反应比较激烈,而后趋于平静,盐度对大黄鱼的48 h半致死盐度为2.5.但对于长时间养殖在低盐度海水中大黄鱼的重要生物学参数指标及有关组织、器官影响的研究,尚未见报道.笔者在开展大黄鱼低盐养殖试验时发现,低盐养殖大黄鱼生长速度明显较缓,养殖初期出现一定程度的死亡.为了解决低盐养殖大黄鱼生长缓慢的问题,为低盐养殖大黄鱼养殖技术的改进提供理论依据,本研究拟对低盐养殖大黄鱼和正常海水养殖大黄鱼的部分生物学参数进行测定和比较,并对两组大黄鱼的若干重要器官组织学特征进行比较研究,探讨低盐度影响大黄鱼生长发育缓慢的原因.
1材料与方法
实验用的正常海水养殖的大黄鱼(对照组)取自福建省宁德市三都澳海域网箱,海域盐度在24~26范围内,对照组大黄鱼体重211.40~346.60 g,体长22.7~25.9 cm;低盐度养殖大黄鱼(低盐组)取自福建省宁德市横屿岛水产有限公司室内养殖场,体重33.1~149.8 g,体长15.7~21.5 cm.两组鱼均为2011年9月繁育的同一批种苗,低盐组从体长10 cm左右开始驯化,驯化初期盐度从25开始,每次盐度降5,每个盐度适应2 d,最终在盐度为6的水中进行养殖.对照组及低盐组每天投喂两次,低盐组温度保持在22~26 ℃之间,于2013年11月随机取样各30尾,进行生物学测量后用SPSS软件对两组数据的差异性进行分析.取鳃、肾、肝、性腺组织,用Bouin氏液进行固定,次日换成70%的乙醇进行保存,对组织样品进行石蜡包埋和切片,切片厚度为5 μm,HE染色.肝体指数及其肥满度的计算公式为:肝体指数(HSI)/%=肝重/体重×100,肥满度(CF)/%=体重/体长3×100.
2结果
2.1 低盐与正常海水养殖大黄鱼肥满度和肝体指数的比较
低盐养殖的大黄鱼体长和体重显著低于正常海水养殖的大黄鱼,肥满度和肝体指数也显著低于正常海水养殖的大黄鱼(见表1).
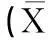
表1 低盐组及对照组大黄鱼的肥满度和肝体指数±SD)
说明:* 表示与对照组(正常海水养殖)相比有显著差异(P<0.05).
Note:Values with an asterisk are significantly different from control(normal sea water)(P<0.05).
2.2 低盐养殖大黄鱼部分器官组织学特征
2.2.1低盐养殖大黄鱼鳃的组织学特征
正常海水养殖大黄鱼的鳃丝细长,排列宽松,细胞大小正常,胞间无明显间隙.鳃丝均向两侧伸出半圆形扁平囊状鳃小片,鳃小片平行排列与鳃丝纵轴垂直,鳃小片上皮细胞结构完整,无损伤.黏液细胞稀少,胞体小,分布于鳃丝上皮中.泌氯细胞散布于鳃小叶基部,胞体较小,呈近椭圆状且数量较少(见图版1-1).
低盐度组大黄鱼的鳃丝的主干部明显较宽;鳃丝上的鳃小片宽且短,彼此间隔变大,均匀分布在鳃丝两侧,鳃小片上皮变厚,鳃小片上皮细胞发生增生、肥大,部分鳃小片上皮明显隆起,上皮细胞脱落、坏死.黏液细胞主要分布在鳃小片之间的鳃丝上皮中,鳃丝上皮中的黏液细胞数量与对照组相比体积变大,且数目大量增多,充斥于鳃丝基部之间(见图版1-2).
2.2.2低盐养殖大黄鱼肾脏的组织学特征
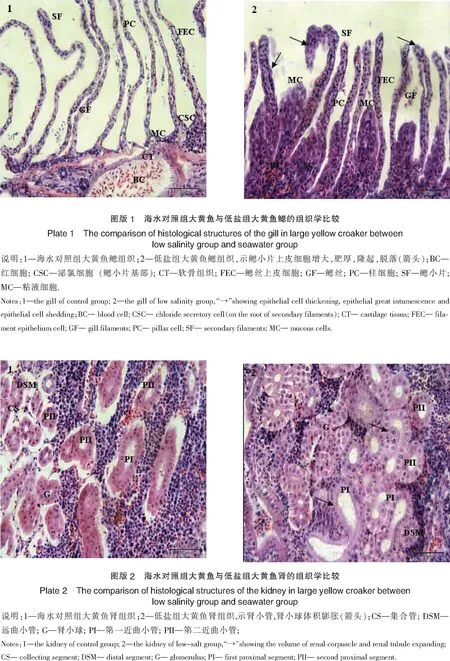
海水对照组大黄鱼的肾脏器官中,肾小球发达,大多数均较饱满,形状规则,肾小管的颈端部分较细,形状规则,上皮细胞呈立方形,胞界清楚,核中位,球形,染色较深,肾小体和各级肾小管外围出现不同的空白隔离区.第一近曲小管(PI)发达,管径较大,管腔大多呈扁卵形,顶部内腔游离面具有发达的刷状缘,上皮细胞呈柱状,细胞界线模糊,核较大,略呈椭圆形,染色较浅,中位,胞体较充实.第二近曲小管(PⅡ)管径逐渐缩小,呈圆形,刷状缘不及第一近曲小管发达,上皮细胞锥柱形,胞间分界亦不清晰,核近圆形,染色深,居中位.远曲小管大多呈近圆形,无刷状缘,管壁上皮为单层立方上皮.肾间质内有许多纵横交错的微血管(见图版2-1).
低盐组肾脏器官的基本结构与海水对照组一致,只是在肾小体及上述各级肾小管的结构上出现了不同程度的肿胀现象.肾小体体积膨大,成不规则形状.各级肾小管管径变大,第一部分近曲小管(PI)与第二部分近曲小管(PⅡ)变化较大,表现为细胞体积增大,管径变大(见图版2-2).
2.2.3低盐养殖大黄鱼肝脏的组织学特征
海水对照组肝细胞胞质均匀,偶有细胞质空泡,细胞核成规则圆形,位于细胞核中央,肝细胞索相互交错,结构清晰(见图版3-1).与对照组相比,低盐组大黄鱼的肝细胞发生肿大、变形,出现大量空泡.部分肝细胞还出现细胞形状不规则、细胞核偏离细胞中心(见图版3-2).
2.2.4低盐养殖大黄鱼性腺发育及组织学特征
海水对照组大黄鱼性腺中,切片所得多为第Ⅱ时相卵母细胞,第Ⅲ、第Ⅳ时相卵母细胞相对较少,第Ⅱ时相卵母细胞体积相对较小,多呈多边形,核型卵圆形,核质透亮,核仁明显,染色较深;第Ⅲ时相卵母细胞体积增大,体型饱满近圆球形,核外周边出现脂肪滴,后向细胞质扩增为数层,同时在细胞膜内缘出现卵黄粒,多而密,且逐渐向细胞质内发展;第Ⅳ时相卵母细胞体积进一步增大,细胞质中充满卵黄,并与脂肪滴混杂(见图版4-1).
低盐组大黄鱼性腺中,切片所得多为第Ⅱ、第Ⅲ时相卵母细胞,第Ⅳ时相卵母细胞几不可见,卵母细胞结构与海水对照组的基本相似.其中,第Ⅲ时相卵母细胞呈多边形,不够饱满,脂肪滴小而密,且卵黄集中在细胞膜内缘,相对于海水对照组明显偏少(见图版4-2).

3讨论
3.1 低盐养殖对大黄鱼鳃的影响
鱼类的鳃与其生活的水环境直接接触,覆盖于鳃丝的表皮细胞对鳃生理功能的正常发挥至关重要.当环境盐度变化时,广盐性鱼类鳃的上皮细胞发生适应性改变[15].本实验中,生活在低盐环境中的大黄鱼,由于鱼体内环境对周围水环境来说是高渗的,水将不断地由鳃和体表进入鱼体内,同时消化道也会吸收一部分水分.为了维持体内的高渗透压,低盐组大黄鱼的肾脏排出过多的水分并大量吸收各种离子,排出大量稀薄的尿液,同时鳃主动吸收Na+和Cl-,因此低盐组的大黄鱼鳃丝和鳃小片变宽,有利于与水体充分接触,从而摄取水中的无机离子以适应低渗环境[16],同时Na+和Cl-通过鳃的氯细胞和辅助细胞进行吸收,结果是氯细胞的数量增多,并且鳃小片发生肥大、增厚.同时,低盐养殖大黄鱼粘液细胞大量增加,分泌的粘液可能导致出现部分鱼苗由于缺氧而死亡.在本实验的低盐条件下养殖大黄鱼鳃的部分鳃小片上皮明显隆起,上皮细胞脱落、坏死,说明该盐度对于大黄鱼生长来说是偏低的.在条件允许时,应适当提高养殖水的盐度,降低低盐对鱼体的损伤程度.
3.2 低盐养殖对大黄鱼肾脏的影响
鱼类的肾脏是鱼体渗透压调节的一个重要器官,由肾小体和肾小管组成.本研究结果表明,大黄鱼的肾脏在低盐的水环境中其组织结构发生了明显的变化,对照组的肾小球饱满、充盈,各级肾小管结构完整,无损伤;低盐度组因外界水体渗透压低,进入鱼体的大量水分需要通过肾脏排出,且糖分、无机离子等重吸收加强,故肾脏各结构充实,肾小体体积膨大,各级肾小管体积膨胀,管径变大.于娜等[11]在盐度对鲻鱼消化生理及渗透调节生理的影响中发现,淡水组和低盐度组鲻鱼的肾组织结构差异不大,肾小球发达,大多数均较饱满,第一近曲小管(PI)十分发达,管径较大,管腔不规则,这与本实验的研究结果有类似的地方.
3.3 低盐养殖对大黄鱼肝脏的影响
正常盐度海水养殖大黄鱼肝组织出现少量空泡,其原因可能是肝细胞内物质合成速度与向循环系统释放的速度失衡导致细胞空泡化[17],也可能是肝糖原在肝细胞中的积累造成组织学方法观察到的空泡[18];而低盐组大黄鱼肝组织出现了更明显的变化,这可能是因为大黄鱼为了适应低渗环境,将体内的能量更多用于调节渗透压,通过激素的调节,使糖代谢向着糖酵解的方向进行,导致肝脏中肝糖原大量贮藏,以供体内渗透压调节所耗的能量,而肝糖原的大量贮藏导致肝细胞中出现大量的空泡以及细胞的增大膨胀.
3.4 低盐养殖对大黄鱼性腺发育的影响
鱼类性腺发育成熟是个复杂的过程,是外在生态条件刺激和内在调控系统各个环节相互协调和配合的结果.盐度对海产鱼类性腺的发育和成熟显得特别重要,尤其是降海洄游产卵的鱼类,其性腺一定要到入海后才能最后发育成熟.河北省水产研究所研究盐度对梭鱼性腺发育影响的结果表明,超过限度的盐度会导致梭鱼性腺在后期出现发育延滞[19].本研究中,低盐养殖大黄鱼第Ⅳ时相卵母细胞几不可见,以及第Ⅲ时相卵母细胞呈不规则多边形,脂肪滴小而密,卵黄集中在细胞膜内缘,相对于海水对照组卵黄明显偏少,说明低盐养殖大黄鱼的性腺发育不如对照组,受到一定程度的抑制.低盐养殖大黄鱼卵母细胞未能发育到第Ⅳ时相,这应该是低盐抑制性腺发育的结果,对于提高大黄鱼的商品价值是有利的.
3.5 盐度对大黄鱼生长的影响
水体中不同的盐度水平对鱼类的生长和存活有显著影响[20-25].鱼类处于盐度适宜的水体中时,鱼的存活率高,特定生长率和肥满度等指标也能达到最大值[26-27].低盐组大黄鱼经过两年的低盐养殖,肥满度和肝体指数均显著低于对照组的水平.其原因可能是由于水体盐度低于鱼体的等渗点,鱼体调节渗透压需要消耗能量,使生长能减少,导致鱼类的生长性能下降[28].此外,盐度变化也可能导致水体的pH值升高或降低,使鱼类肠道中消化酶的活性降低,影响食物转化效率,导致鱼类生长速率降低或停滞,甚至出现负增长[29-30].陈佳等在温度和盐度对大黄鱼生长性能的联合效应研究中发现,当温度在24.1~24.7 ℃时,大黄鱼生长的最佳盐度在13.6~14.1范围内[31].MAGNUSSEN等研究发现,温度对鱼类的最适盐度有调节作用,温度改变时,鱼体对盐度的需求也随之变化,鱼类的等渗点随温度的变化而变化[32].这对本实验有借鉴意义,可以考虑维持水体温度在24~25 ℃范围内,使大黄鱼有最大的盐度适应范围.
本文对低盐养殖大黄鱼的几种器官组织学的研究表明,低盐养殖导致相关器官出现明显的组织学变化.显然,鱼类通过这些组织结构的变化来适应低盐的环境.低盐环境的适应主要在于获取足够的无机盐以稳定鱼体的渗透压,而从水体中吸收无机离子需要消耗能量,从而影响生长.因此,可以尝试在饲料中增加无机盐含量,以提高鱼体无机盐的摄入量.此外,由于渗透调节而能量消耗增大,考虑可以适当增加饲料中糖分的含量来满足低盐养殖大黄鱼的能量消耗的需求,并由此降低饲料成本.
[参考文献]
[1]周旻曦.大黄鱼刺激隐核虫病病原生物学特性的研究[D].宁波:宁波大学海洋学院,2012:1-56.
[2]李兵,王帅,张伟,等.室内低盐度饲养大黄鱼的初步研究[J].上海海洋大学学报,2012,21(4):524-529.
[3]YIN F,PENG S,SUN P,et al.Effects of low salinity on antioxidant enzymes activities in kidney and muscle of juvenile silver pomfretPampusargenteus[J].Acta Ecologica Sinica,2011,31(1):55-60.
[4]IMSLAND A K,GSTAVSSON A,GUNNARSSON S,et al.Effects of reduced salinities on growth,feed conversion efficiency and blood physiology of juvenile Atlantic halibut(Hippoglossus hippoglossusL.)[J].Aquaculture,2008,274(2/4):254-259.
[5]BOLASINA S N,TAGAWA M,YAMASHITA Y.Changes on cortisol level and digestive enzyme activity in juveniles of Japanese flounder,Paralichthysolivaceus,exposed to different salinity regimes[J].Aquaculture,2007,266(1/4):255-261.
[6]陈林,周文玉,潘桂平.盐度对棘头梅童鱼发育和仔鱼存活的影响[J].海洋渔业,2012,34(4):388-392.
[7]SCHULTE P M.Responses to environmental stressors in an estuarine fish:Interacting stressors and the impacts of local adaptation[J].Journal of Thermal Biology,2007,32(3):152-161.
[8]FIELDERA D S,BARDSLEY W J,ALLAN G L,et al.The effects of salinity and temperature on growth and survival of Australian snapper,Pagrusauratuslarvae[J].Aquaculture,2005,250(1/2):201-214.
[9]BEG M U,AL-SUBIAI S,BEG K R,et al.Seasonal effect on heat shock proteins in fish from Kuwait Bay[J].Bull Environ Contam Toxicol,2010(84):91-95.
[10]曹霄,陈炯,史雨红,等.香鱼Apo-14基因的克隆序列分析及其mRNA表达与盐度适应性的关系[J].台湾海峡,2011,30(2):203-209.
[11]于娜.盐度对鲻鱼消化生理和渗透调节生理的影响[D].上海:上海海洋大学水产与生命学院,2012:1-63.
[12]姜明,汝少国,刘晓云,等.不同盐度下蓝非鲫鳃泌氯细胞的结构变化[J].青岛海洋大学学报,1998,28(4):603-608.
[13]李兵,钟英斌,吕为群.大黄鱼早期发育阶段对盐度的适应性[J].上海海洋大学学报,2012,21(2):204-211.
[14]陈惠群,焦海峰,冯坚.盐度突变对大黄鱼受精卵孵化及稚鱼成活的影响[J].水产科学,2005,24(1):20-21.
[15]王晓清,王志勇,何湘蓉.大黄鱼(Larimichthys crocea)耐环境因子试验及其遗传力的估计[J].海洋与湖沼,2009,40(6):781-785.
[16]沈盎绿,陈亚瞿.低盐度驯化对大黄鱼和黑鲷存活的影响[J].水利渔业,2007,27(6):47- 48.
[17]GINGERICH W H.Aquatic toxicity[M].New York:Raven Press,1982:55-105.
[18]WESTER P W,CANTON J H.Histopathological study ofOryziaslatipes(Medaka) after long-term β-hexachlorocyclohexane exposure[J].Aquat Toxicol,1986,9(1):21-45.
[19]河北省水产研究所,中国科学院水生生物研究所.环境盐度对梭鱼脑下垂体及性腺发育的影响[J].水产学报,1980,4(8):229-242.
[20]冯广朋,庄平,章龙珍,等.长江口纹缟虾虎鱼胚胎发育及早期仔鱼生长与盐度的关系[J].水生生物学报,2009,33(2):170-176.
[21]强俊,王辉,李瑞伟,等.盐度对奥尼罗非鱼仔、稚鱼生长、存活及其消化酶活力的影响[J].南方水产,2009,5(5):8-14.
[22]王武,甘炼,张东升,等.盐度对江黄颡鱼生存和生长的影响[J].水产科技情报,2004,31(3):121-124.
[23]SANTORE R C,DI TORO D M,PAQUIN P R,et al.Biotic ligand model of the acute toxicity of metals 2:Application to acute copper toxicity in freshwater fish and Daphnia[J].Environmental Toxicology and Chemistry,2001,20(10):2397-2402.
[24]IMSLAND A K,GUNNARSSON S,FOSS A,et al.Gill Na+,K+-ATPase activity,plasma chloride and osmolality in juvenile turbot(Scophthalmus maximus)reared at different temperatures and salinities[J].Aquaculture,2003,218(1/4):671-683.
[25]FIVELSTAD S,BERGHEIM A,HØLLAND P M,et al.Water flow requirements in the intensive production of Atlantic salmon(Salmo salarL.)parr-smoltattwosalinitylevels[J].Aquaculture,2004,231(1/4):263-277.
[26]姜志强,赵祥东,王国祖.不同盐度下牙鲆幼鱼存活、生长和摄食的研究[J].大连水产学院学报,2002,17(2):79-83.
[27]LUZ R K,MARTNEZ-LVAREZ R M,DE PEDRO N,et al.Growth,food intake regulation and metabolic adaptations in goldfish(Carassius auratus)exposed to different salinities[J].Aquaculture,2008,276(1/4):171-178.
[28]张国政,黄国强,田思娟,等.盐度胁迫及恢复对褐牙鲆幼鱼生长、能量分配和身体成分的影响[J].水产学报,2008,32(3):402- 410.
[29]HIROSE S,KANEKO T,NAITO N,et al.Molecular biology of major components of chloride cells[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2003,136(4):593-620.
[30]FASHINA-BOMBATA H A,BUSARI A N.Influence of salinity on the developmental stages of African catfishHeterobranchuslongifilis(Valenciennes,1840)[J].Aquaculture,2003,224(1/4):213-222.
[31]陈佳,袁重桂,阮成旭.温度和盐度对大黄鱼生长性能的联合效应[J].广州大学学报:自然科学版,2013,12(5):35-39.
[32]MAGNUSSEN A B,IMSLAND A K,FOSS A.Interactive effects of different temperatures and salinities on growth,feed conversion efficiency,and blood physiology in juvenile spotted wolfish,AnarhichasminorOlafsen[J].J World Aqu Soc,2008,59(2):804-811.
(责任编辑朱雪莲英文审校张子平)
The Histological Studies on Some Organs of Large Yellow Croaker,Larimichthys crocea Reared in Low Salinity WaterJIN Xi-zhe1,2,CHEN Qing-kai1,2,3,YE Kun1,2,GONG Shi-qi1,2,WANG Zhi-yong1,2,XIE Yang-jie
(1.Fisheries College,Jimei University,Xiamen 361021,China;
2.Key Laboratory of Mariculture in the East China Sea,Ministry of Agriculture of China,Xiamen 361021,China;
3.Fishery Technical Extension Station of Ningde City,Ningde 352100,China)
Abstract:This paper compared the condition factor,hepatosomatic index and histological characteristics of gill,kidney,liver,gonad of large yellow croaker Yeared in low salinity water(low-salinity groups) to thoses in regular seawater (control group).The standard length,body mass,condition factor and hepatosomatic index of low-salt group were significantly lower than those of the control group(P<0.05).In low salinity group,the gill was obviously wider.Epithelial cell of gill lamella became hyperplasia and hypertrophy,part of them intumesced apparently and some even shed and became necrosis.The volume of mucous cells became larger and the number increased,the chlorine cells showed the same as mucous cells.The renal corpuscle expanded and the diameter of renal tubule became larger.The liver cell swelled,then became out of shape and occurred large number of vacuole and part of their nucleus deviated from the cell center.The oocyte of the phase 2 and phase 3 appeared more frequently than the phase 4.In oocytes of the phase 3,the fat droplets were small and dense,and the yolk localized on the inner edge of cell membrane and were less than those in control group.
Key words:Larimichthys crocea;low salinity culture;gill;kidney;liver;gonads;histological observation
[文献标志码]A
[中图分类号]S 965.322
[文章编号]1007-7405(2015)02-0090-08
[作者简介]金希哲(1990—),男,硕士生,从事水产遗传与育种研究.通讯作者:谢仰杰(1967—),男,副教授,博士,E-mail:yjxie@jmu.edu.cn.
[基金项目]福建省农业科技重大项目(2011N5010)
[收稿日期]2014-12-19[修回日期]2015-03-01

