环境因素对溶藻弧菌HN08155生物膜形成的影响
刘文竹, 李红月,范学亭,周永灿,王世峰,谢珍玉
(海南大学 海洋学院,海南省热带水生生物技术重点实验室,海南 海口 570228)
环境因素对溶藻弧菌HN08155生物膜形成的影响
刘文竹, 李红月,范学亭,周永灿,王世峰,谢珍玉
(海南大学 海洋学院,海南省热带水生生物技术重点实验室,海南 海口 570228)
为了研究不同环境因子对溶藻弧菌(Vibrioalginolyticus)HN08155生物膜形成的影响,本研究采用改良的微孔板方法,结果显示:在3个不同培养基中,于2216E培养基中生物膜形成的速度最快,与其他实验组存在明显差异;在pH4~9范围内,当pH值为7.0时,溶藻弧菌形成的生物膜量最高;质量浓度为0.5%的NaCl最适宜溶藻弧菌生物膜的生成,但NaNO3不能促进生物膜的形成;低浓度CaCl2可促进生物膜形成,MgCl2不参与溶藻弧菌生物膜的生成.由此得出结论:溶藻弧菌生物膜的形成依赖于环境条件,不同环境因子对溶藻弧菌生物膜的形成有不同的影响.
溶藻弧菌;生物膜;环境因子
细菌所形成的生物膜是指浮游阶段生存的细菌粘附在介质表面,通过细菌间的不断扩增伴随着对外分泌大分子产物将细菌自身包裹成有组织的结构性细菌群落[1].大量研究表明,生物膜的形成是细菌为适应不同的环境而形成的一种生存策略,也是许多病原菌难以控制的重要原因[2].细菌通过形成生物膜以抵抗不利环境,摄取营养物质,甚至躲避有毒有害物质.这种生存方式比浮游菌更容易在一些极端的环境下生存.Costerton等于1978年最早提出细菌生物膜的概念[3-4],由于细菌生物膜在环境适应方面具有重要的意义,因而引起了人们的广泛重视,进而掀起了研究细菌生物膜的热潮.细菌生物膜是由蘑菇状或者锥状的大量细菌组成,其含水量高达97%,这些细菌组成生物膜上的“通道”,能够运送营养物质和代谢产物等.实际上,生物膜是有着结构复杂而分工有序的菌落,包括主体生物膜层、连接层、条件层、基质层,其结构具有不均质性[5].
溶藻弧菌为海水养殖动物的主要病原菌之一,对我国特别是南方地区的海水养殖业造成了严重的威胁[6-7].迄今为止,尽管国内外学者对溶藻弧菌的致病机制开展了大量的研究,但对于溶藻弧菌的分子致病机理还缺乏深入了解.因此,对溶藻弧菌毒力基因和致病机理的深入研究尤为重要[9].细菌生物膜形成与否能够明显影响细菌侵染宿主的能力,它们在溶藻弧菌致病过程中很可能具有重要作用.
本文通过研究不同的环境因子对溶藻弧菌HN08155所形成生物膜的影响,确定了溶藻弧菌在形成生物膜的过程中对环境因子有较强的依懒性,为今后深入研究其成膜能力和侵染机制奠定了基础.
1 菌种与方法
1.1菌株及培养条件 本实验室提供的溶藻弧菌HN08155分离自患病凡纳滨对虾(Litopenaeusvannamei), -80℃保藏.菌株接种于2216E培养液中,30 ℃,12 h摇床培养,悬菌液6 000 g离心弃上清,用PBS重悬菌体沉淀,密度调至约OD600=0.5.
1.2 试验方法
1.2.1 溶藻弧菌成膜的定量检测[8]本实验使用0.1%结晶紫染料对溶藻弧菌HN08155进行生物膜染色.取重悬菌液以1∶100比例转接至5 mL新鲜2216E培养液.取200 μL培养液加入到无菌的96孔板中,每组12个平行样,取新鲜的无菌2216E培养液为空白对照.放置30 ℃培养箱,静置培养.用250 μL PBS/孔冲洗2次,60 ℃干燥30min.加入0.1%结晶紫200 μL/孔,染色30 min,弃去染液,加入PBS 250 μL/孔清洗3次,60 ℃干燥30 min.加入200 μL/孔的95%乙醇,至于摇床将结晶紫燃料充分溶解.使用酶标仪测定OD570的值.
1.2.2 溶藻弧菌在不同时间形成生物膜能力测定 按方法1.2.1测定成膜量,每隔12 h取样一次.
1.2.3 溶藻弧菌在不同培养基下形成生物膜能力测定 取重悬菌液以1∶100比例分别转接至2216E、TSB和LB培养液中,静置培养48 h,按照1.2.1的方法测细菌的成膜情况.
1.2.4 溶藻弧菌在不同NaCl和NaNO3质量分数条件下成膜情况测定
取重悬菌液以1:100比例分别转接至NaCl浓度为0、0.5%、1%、1.5%、2%和2.5%的胰蛋白酵母培养液,另取同样重悬液以1:100比例分别转接至NaNO3浓度为0、0.5%、1%、1.5%、2%和2.5%的胰蛋白酵母培养液,静置培养48h,按1.2.1的方法测定细菌的成膜情况.
1.2.5 溶藻弧菌不同初始pH条件下成膜情况测定 取重悬菌液以1∶100比例分别转接至初始pH为4、5、6、7、8和9的1%NaCl胰蛋白酵母培养液,静置培养48 h,按照1.2.1的方法测细菌的成膜情况.
1.2.6 溶藻弧菌不同CaCl2和MgCl2质量分数条件下成膜情况测定 取重悬菌液以1∶100比例分别转接至CaCl2浓度为0、0.1%、0.2%、0.3%、0.4%和0.5%的胰蛋白酵母培养液,另取同样重悬液以1∶100比例分别转接至MgCl2浓度为0、0.02%、0.04%、0.06%、0.08%和0.1%的胰蛋白酵母培养液,静置培养48 h,按1.2.1的方法测定细菌的成膜情况.
1.3 数据处理每组实验均设置12个平行样,结果以平均数±标准偏差表示,利用Excel、SPSS16.0软件进行统计学分析.
2 结果与分析
2.1 溶藻弧菌在不同时间形成生物膜能力情况在溶藻弧菌形成生物膜的初期,随着时间的延长,OD值逐渐增加,说明生物膜的量在逐步增加,当达到72 h,OD值最高,这时生物膜的量达到最大,而后随着培养时间的延长,OD值逐渐降低,生物膜的量逐渐下降(表1、图1),各数据间存在显著差异(p<0.05).
2.2 溶藻弧菌在不同培养基下成膜情况溶藻弧菌在2216E培养基中,OD值最高,溶藻弧菌所形成的生物膜量最大,显著高于其他实验组,其次是TSB培养基,在LB培养基中形成的量最少(表2、图2),各数据存在显著差异(p<0.05).
2.3 溶藻弧菌在不同NaCl和NaNO3质量分数条件下成膜情况当在NaCl为0时,溶藻弧菌几乎无法成膜,当NaCl为0.5%时,OD值达到最高,生物膜的量达到最大.当NaCl达到2%时,OD值与初始值相似,说明溶藻弧菌几乎丧失成膜能力(表3、图3),数据存在显著差异(p<0.05).在仅含有NaNO3的培养基中,随着浓度的增加,OD值几乎没有差异(表4、图4)(p>0.05).
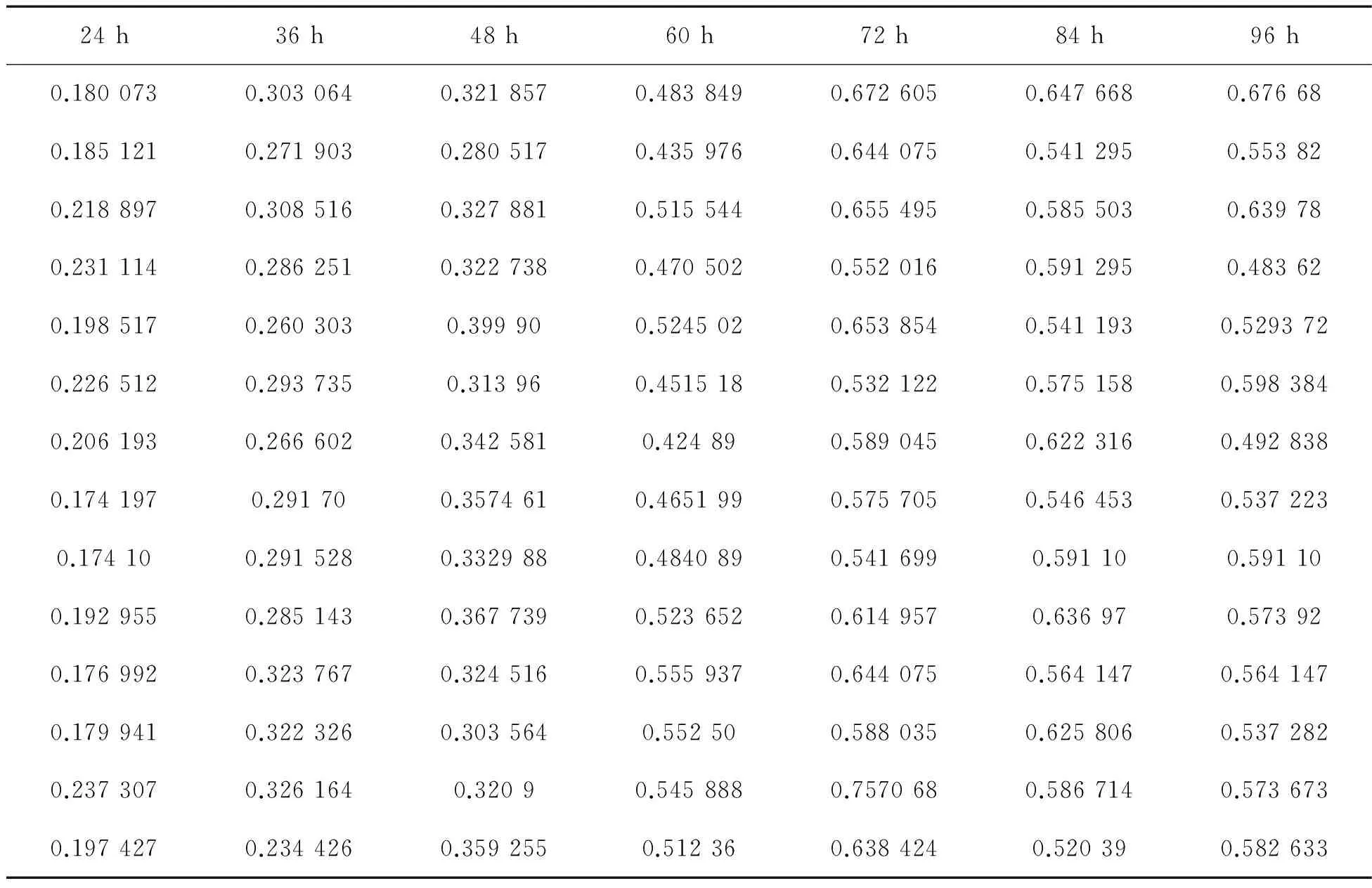
表1 不同培养时间对溶藻弧菌生物膜形成的影响
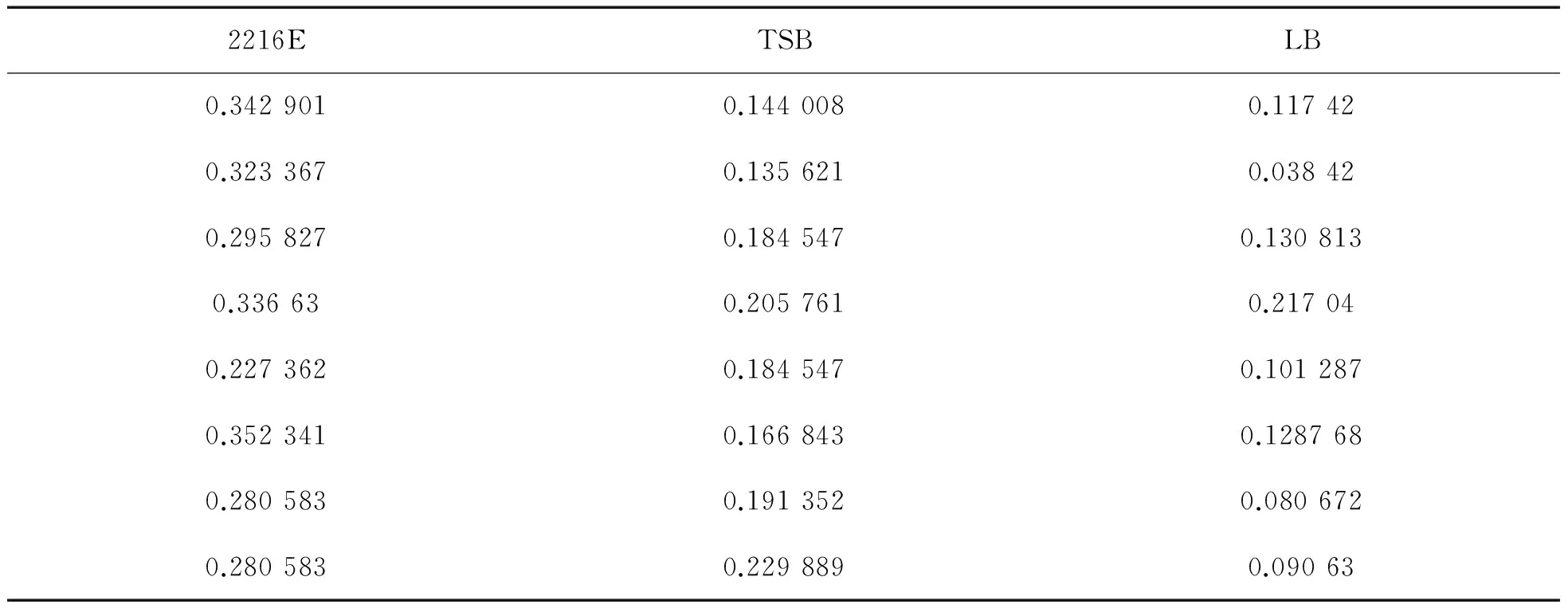
表2 不同培养基对溶藻弧菌生物膜形成的影响
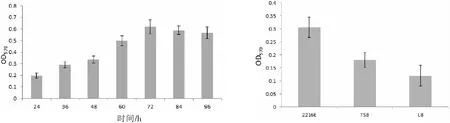
图1 不同培养时间对溶藻弧菌生物膜形成的影响图2 不同培养基对溶藻弧菌生物膜形成的影响
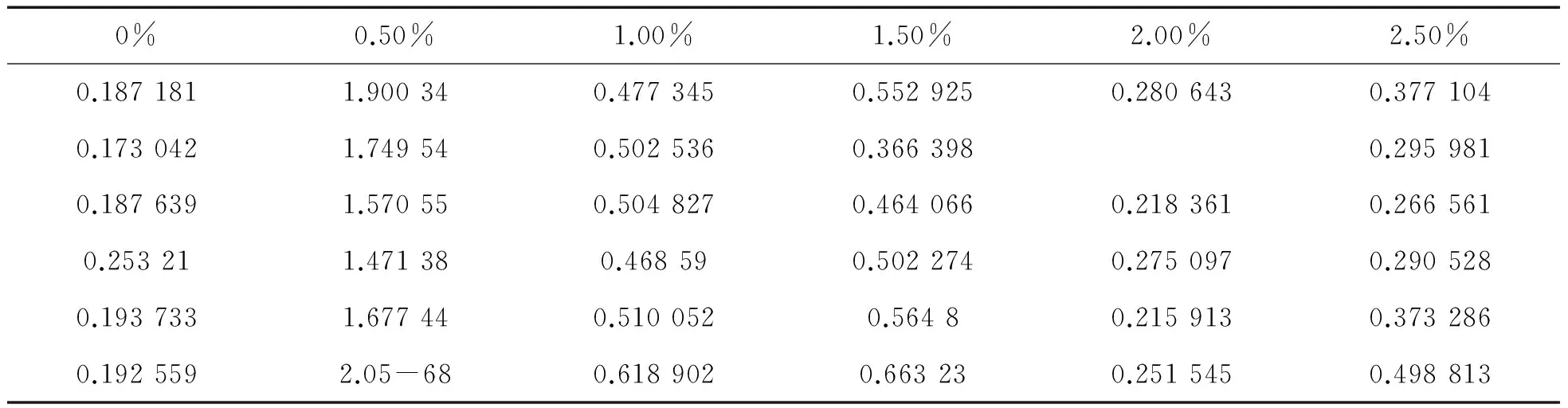
表3 NaCl对溶藻弧菌成膜影响

表4 NaNO3对溶藻弧菌成膜影响

图3 NaCl 对溶藻弧菌成膜影响图4 NaNO3对溶藻弧菌成膜影响
2.4 溶藻弧菌不同初始pH值条件下成膜情况当初始pH值为4、5和6时,溶藻弧菌几乎无法形成生物膜,初始pH值为7时,OD值达到最高,溶藻弧菌生物膜形成量最大,显著高于其他实验组,在初始pH值为8~9时,OD值逐渐降低,生物膜量明显减少(表5、图5),各数据存在显著差异(p<0.05).
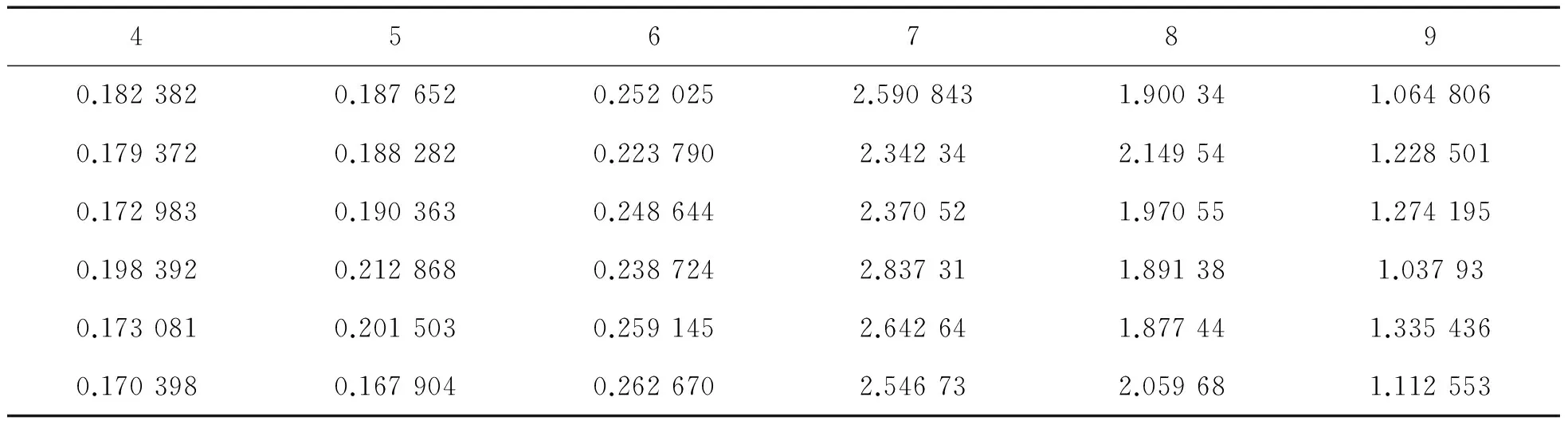
表5 初始pH值对溶藻弧菌成膜的影响
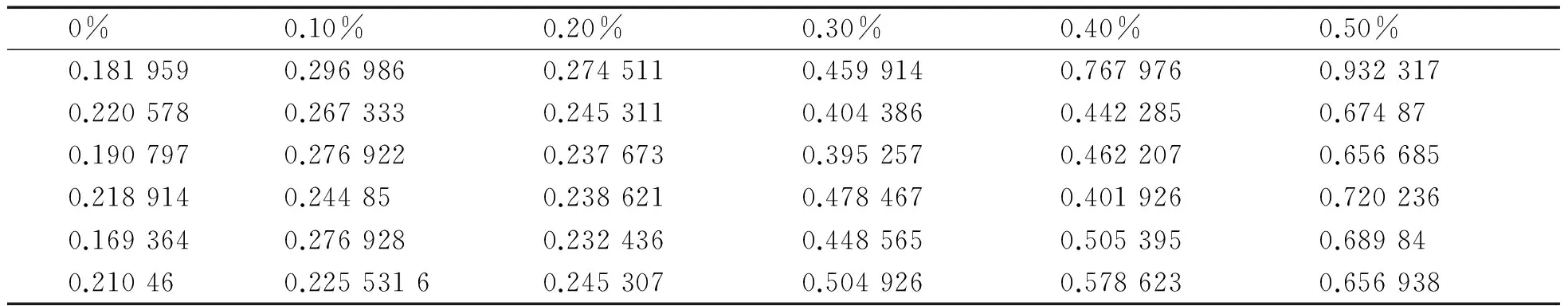
表6 CaCl2对溶藻弧菌成膜影响
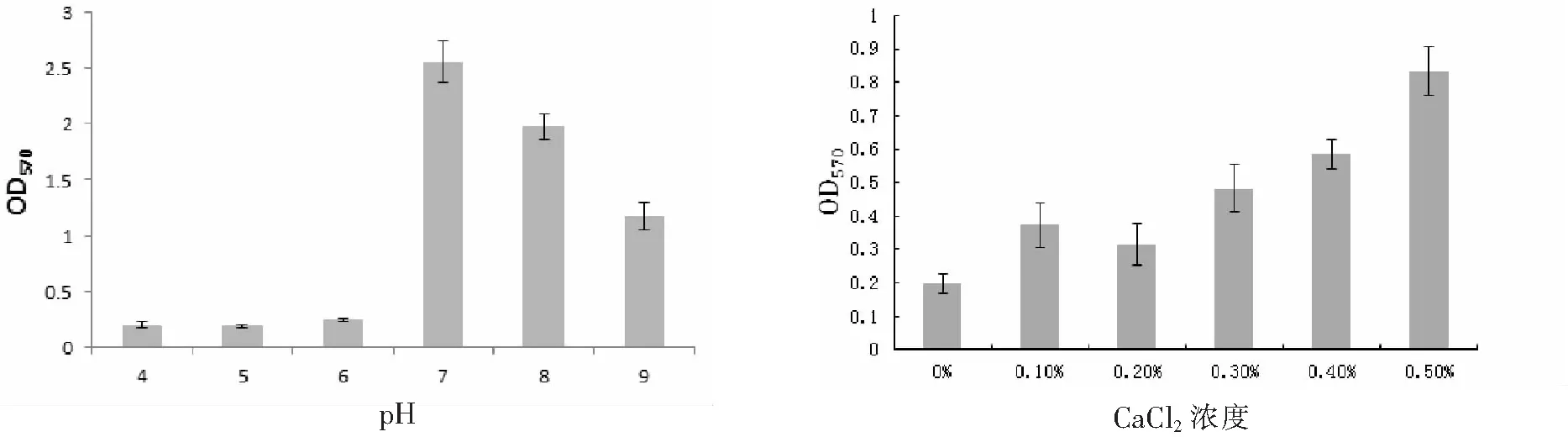
图5 初始pH 值对溶藻弧菌成膜的影响图6 CaCl2对溶藻弧菌成膜影响
2.5 溶藻弧菌不同CaCl2和MgCl2质量分数条件下成膜情况当在CaCl2为0时,溶藻弧菌几乎无法成膜,在0.5%的浓度之内,随着CaCl2浓度的增加,OD值逐渐增高,生物膜的量逐渐增大(表6、图6),数据之间存在显著差异(p<0.05).在仅含有MgCl2的培养基中,OD值几乎没有差异(p>0.05),无法观察细菌生物膜的存在(表7、图7).
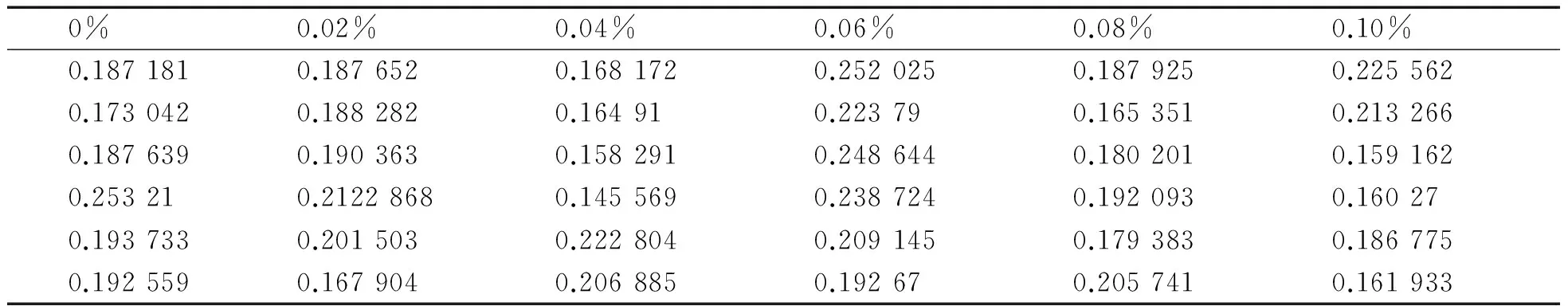
表7 MgCl2对溶藻弧菌成膜影响

图7 MgCl2对溶藻弧菌成膜影响
3 讨 论
Sauer等[10-11]认为生物膜形成过程是一种动态的过程,包括菌落初始粘附、发展、成熟和老化4个阶段.本文通过对生物膜的在不同时间的测定结果表明,在静止环境中,溶藻弧菌HN08155形成的生物膜具有4个时期的变化:24~36 h为初始期,36~60 h为发展期,60~72 h为成熟期,超过72 h为衰老期.
浮游性细菌粘附在介质表面,这是生物膜形成的初始粘附阶段.在这个阶段中,细菌的粘附能力起到重要的作用,其中主要因子包括细菌的粘附素以及细菌的鞭毛.这个阶段所形成的生物膜形成不稳定,对细菌没有形成保护结构,容易被破坏[12].在细菌粘附到介质表面后,细菌会产生大量胞外产物,将菌落包裹起来.这些胞外产物将单个菌落聚起来,形成微菌落,随着胞外产物不断增加,微菌落之间逐渐连接,形成生物膜的框架.这个阶段的生物对外的抗性明显增加.伴随着胞外产物的不断增加,成熟的生物膜逐步形成.细菌生物膜根据所粘附的表面介质,生长环境,营养成分等的不同,会构成形态不一的生物膜结构.这种结构厚薄不一,形态各异[13-14].在这个阶段的生物膜达到稳定状态,对外界干扰的免疫力最强.在达到成熟期后,生物膜逐渐溶解,细菌脱落,形成浮游状态从而形成新的循环过程[15].本文通过在培养基中测定溶藻弧菌在不同环境中所形成生物膜的差异.结果表明在含有丰富离子成分的2216E培养基,生物膜的量最大,在LB低离子培养基中,形成的生物膜最低.这说明,生物膜的形成不单单是依赖于保外多糖的量所决定的,与生存环境中离子成分和浓度也有密不可分的关系.
根据Carli等[16]的研究表明,溶藻弧菌最适生存盐度为1%~4%,在本实验中,溶藻弧菌最适成膜盐度为0.5%,在高于0.5%NaCl的浓度时,成膜能力明显降低,达到2%NaCl浓度时,生物膜几乎无法形成.说明溶藻弧菌在适应海水环境等自然环境中均能正常生长生物膜,盐度过高则会影响溶藻弧菌的成膜能力.另外,本文通过NaNO3培养基与相同浓度NaCl培养基所形成生物膜对比分析,结果表明,在NaNO3培养基中,溶藻弧菌的生物膜几乎不能形成,NaNO3对溶藻弧菌成膜过程无法起到促进作用.NaCl能够促进生物膜的形成,但NaNO3不能促进其形成,这说明溶藻弧菌在形成生物膜的过程中,对钠盐的诱导有选择性调控[17].
溶藻弧菌最适生存pH值为6.0~9.0[18-19],本实验表明,溶藻弧菌在低于pH值为6.0的酸性环境下,成膜能力受到明显抑制,几乎不能形成.pH值达到7.0,生物膜形成的量最大,pH值8.0~9.0,生物膜能够形成,但形成的量明显下降.在天然的海洋环境中,pH值偏弱碱性,当细菌处于低营养的环境时,弱碱性有利于溶藻弧菌粘附在介质表面形成生物膜,间接提高溶藻弧菌抵抗外界不利因素的生存能力.
根据Balebona等[20]研究表明,二价的阳离子能够提高粘附细菌保外产物的产量,从而促进细菌生物膜的形成.林雅茵等[21]对铜绿假单胞菌(Pseudomnasaeruginosa)进行生物膜研究,结果表明Mg2+能够促进生物膜的形成,推测金属二价阳离子对多糖有稳定作用,本文通过仅有CaCl2和MgCl2培养基中培养生物膜结果发现,在CaCl2培养基中,0~0.5%浓度范围内,随着浓度的增高,溶藻弧菌成膜的量越大.这说明, Ca2+参与了溶藻弧菌成膜的调控过程,增强细菌与介质表面负离子结合,形成稳定的二价吸引力,从而提高生物膜粘附在介质表面的稳定性[22].在MgCl2培养基中,随着MgCl2浓度的增大,OD值之间没有差异,没有细菌生物膜的形成.尽管二价镁离子能够增强细菌与表面的介质,但对溶藻弧菌而言,镁离子无法参与成膜的过程.
综合实验结果,致病性溶藻弧菌HN08155具有较强的成膜能力,其生物膜的形成与外界环境密不可分,pH、离子浓度等各种环境因素均能显著影响其生物膜的形成.
[1] Hall-Stoodley, Luanne, Costerton J, William, et al. Bacterial biofilms: from the natural environment to infectious diseases[J]. Nature Reviews Microbiology,2004, 2(2):95-108.
[2] Davies F, David A. Understanding biofilm resistance to antibacterial agents[J]. Nature Reviews Biofilm,2003, 2(2):114-122.
[3] Costerton , William J, Geesey G G, et al. How bacteria stick[J]. Scientific American,1987(238):86-95.
[4] 袁海兰, 苏建, 胡鲲, 等. 环境因子对水霉菌生物膜形成的影响. 微生物学通报, 2014,41(9):1 829-1 836.
[5] Ahmad A, Wiedmann A, Faust M, et al. Biofilm formation and composition on different implant materials in vivo[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2010,95(1):101-109.
[6] 牟海津, 刘志鸿. 水产动物病原菌致病性胞外产物的研究进展.中国水产科学,2000,7(2):93-95.
[7] 权太淑, 李薇, 杨喜玲.自腹泻患者中分离溶藻性弧菌及其病原性的探讨[J].中国公共卫生, 1985,5:10.
[8] Schmidt U,Chmel H,Cobbs C.Vibrioalginolyticusinfections in humans [J]. Journal of Clinical Microbiology, 1979,10(5):666-668.
[9] 王蓬勃, 马悦, 刘琴, 等.溶藻弧菌铁载体合成及外膜蛋白表达的研究[J].微生物学通报,2006,33(2):48-53.
[10] Chen Q, Yan Q, Wang K, et al.Portal of entry forpathogenicVibrioalginolyticusinto large yellow croakerPseudosciaenacroceaand characteristic ofbacterial adhesion to mucus [J] .Biofilm, 2008,80(6):332-335.
[11] Sauer K, Camper A K, EhrlichGarth D, et al.Pseudomonasaeruginosadisplays multiple phenotypes during development as a biofilm[J]. Journal of bacteriology,2002, 184(4):1 140-1 154.
[12] Stoodley P, Sauer K, Davies D, et al.Biofilms ascomplex differentiated communities [J] .Annual Review of Microbiology, 2002 (56): 187-209.
[13] Sternberg C, Christensen B B, Johansen T, et al.Distribution of bacterial growth activity in flow-chamberbiofilms[J].Applied and Environmental Microbiology, 1999,65 (9): 4 108-4 117.
[14] 陈强, 鄢庆枇, 邹文政, 等.环境因子对溶藻弧菌粘附大黄鱼表皮粘液影响的研究[J].海洋与湖沼,2007,38(4):361-366.
[15] O’Toole G A, Kolter R.Initiation of biofilm formation inPseudomonasfluorescensWCS365 proceeds[J] Molecular Microbiology,1998, 28 (3):449-461.
[16] Burgemeister S, Decker E M, Weiger R,et al.Bactericidal effect of delmopinol on attached and planktonicStreptococcusSanguinisCells[J].EuropeanJournal of Oral Sciences, 2001,109 (6): 425-427.
[17] Carli A, Pane L, Casareto L,et al.Occurrence ofVibrioalginolyticusin Ligurian coast rock pools (Tyrrhenian Sea, Italy) and its association with the CopepodTigropusfulvus(Fisher 1860)[J].Applied and Environmental Microbiolology,1993, 59(6):1 960-1 962.
[18] Meluleni G J, Grout M, Evans D J, et al .Pseudomonasaeruginosagrowing in a biofilm in vitro are killed by opsonic antibodies to the mucoid exopolysaccharide capsule but not by antibodies produced during chronic lung infection in cystic fibrosis patients[J]. The Journal of Immunology,1995, 155(4):2 029-2 038.
[19] Klausen M, Heydorn A, Ragas P, et al. Biofilm formation byPseudomonasaeruginosawild type, flagella and type IV pili mutants[J]. Molecular Microbiology, 2003,48(6):1 511-1 524.
[20] Chen F R, Liu P C, Lee K K. Purification and partial characterization of a toxic serine protease produced by pathogenicVibrioalginolyticus[J].Microbios,1998,98(390):95-111.
[21] Balebona M C, Morinigo M A, Faris A,et al.Influence of salinityand pH on the adhesion of pathogenicVibriostrainstoSparusaurata skin mucus[J].Aquaculture,1995,132(1/2):113-120.
[22] 林雅茵,余加林,卢起,等.镁离子对黏液型铜绿假单胞菌生物膜形成过程的影响[J].中国微生态学杂志,2009,6(21):515-518.
[23] Chen X, Stewart P S.Role of electrostatic interactions in cohesion of bacterial biofilms[J].Applied Microbiology and Biotechnology,2002,59(6):718-720.
Effects of Several Environmental Factors on the Biofilm Formation ofVibrioalginolyticusHN08155
Liu Wenzhu, Li Hongyue, Fan Xueting, Zhou Yongcan, Wang Shifeng, Xie Zhenyu
(College of Marine Science, Hainan University, Experimental Teaching Demonstration Center of Marine Biology, Key Laboratory of Tropical Aquatic Biotechnology of Hainan Province, Haikou 570228, China)
In order to analyze the effects of several environmental factors on the biofilm formation ofVibrioalginolyticusstrain HN08155, in the study, the modified microtiter-plate method was performed to detect the biofilm formation under the different conditions. The results indicated that in different medium (2216E, TSB and LB), the formation of biofilm was most rapid in 2216E; from pH 4 to 9, when pH value is 7, the amounts of bacterial biofilm was the highest; 0.5% NaCl was best suitable concentration for the forming of the biofilm ofV.algionlyticus, however,NaNO3cannot promote to produce of biofilm. The conclusion can be drawn that the different environmental factors had different effects on the biofilm formation ofV.alginolyticus.
Vibrioalginolyticus; bio-film; formation; environmental factor
2015-05-30
国家自然科学基金项目(No.31060360);国家科技支撑计划项目(No.2012BAC18B04);海南省重大科技项目(No.ZDZX2013014);海南省自然科学基金项目(No.311031).
刘文竹(1988-),女,山东青岛人,海南大学海洋学字2012级硕士研究生, E-mail:243575001@qq.com
谢珍玉(1974-),男,江西吉水人,教授, 硕士生导师,研究方向:水产动物健康养殖与病害控制,
E-mail:xiezyseuta@163.com
1004-1729(2015)04-0365-07
S 941.42
A DOl:10.15886/j.cnki.hdxbzkb.2015.0064

