Ifi204基因表达对大鼠血管外膜成纤维细胞凋亡和迁移的影响
田茂波,吴 强,宋 方,龙向淑,黄 晶,肖 燕
(1.贵阳医学院内科学专业;2.贵阳医学院附属人民医院心内科,贵州贵阳550002)
血管外膜成纤维细胞(vascular adventitial fibroblast cell,VAF)是血管外膜的主要细胞成分,当血管受损时细胞被激活,发生表型改变、增殖、迁移、分泌胶原蛋白,参与血管的修复过程[1],并获得α-平滑肌肌动蛋白特征,转化为肌成纤维细胞。一部分肌成纤维细胞迁移至内膜分泌细胞外基质,导致了晚期胶原纤维化并促进管腔狭窄[2-3]。干扰素诱导蛋白P204(P204)是鼠类干扰素诱导蛋白P200 家族成员,可促进多种细胞型的凋亡,抑制细胞迁移[4]。前期研究提示在人VAF 细胞中IFI16(P204 的人类同源性蛋白)存在基础表达,干扰素-α 可诱导IFI16 大量表达,抑制人VAF 细胞迁移[5]。本研究旨在通过慢病毒介导ifi204 基因的过表达和ifi204 siRNA 沉默,观察P204 对VAF凋亡和迁移的影响,为血管狭窄性疾病的防治提供理论依据。
1 材料与方法
1.1 材料与试剂
清洁级SD 大鼠,雌雄不限,体质量120~150 g,约6 周龄[贵阳医学院实验动物中心,动物合格证号SCXK (黔)2012-001]。
细胞培养的DMEM 高糖培养基、0.25%胰蛋白酶和青-链霉素(Hyclone 公司);胎牛血清(FBS)(Gibco 公司);ifi204 siRNA、control siRNA(Fluorescein Conjugate)-A:sc36869 和抗p204 一抗(Santa 公司);pv-9000 二步法免疫组化检测试剂盒(北京中衫金桥公司)X-tremeGENE siRNA Transfection Reagent(Roche 公司);Transwell 小室(Coring 公司);含ifi204 基因的慢病毒颗粒(广州复能基因有限公司合成);Trizol 总RNA 提取试剂(Life 公司);FastQuant cDNA第一链合成试剂盒(北京天根公司);iTaq Universal SYBR® Green Supermix (Bio-Rad 公司);real-time PCR 扩增引物(上海生工公司合成);抗P53 一抗和抗Vimentin(Abcam 公司);细胞凋亡检测试剂盒和GAPDH(碧云天公司);通用二抗(Abmart 公司)。
1.2 方法
1.2.1 实验分组:取3~6 代细胞用于实验。实验分为5 组,即含ifi204 基因的慢病毒组(ifi204 lv group)、空载体慢病毒组(blank lv group)、非特异性siRNA 组(control siRNA group)、ifi204 siRNA 转染组和空白对照组(negative group)。
1.2.2 细胞分离、纯化、培养及鉴定:采用组织块贴壁法培养SD 大鼠主动脉原代VAF 细胞,传代过程中用差速贴壁法去除血管平滑肌细胞来纯化VAF[6]。将3~6 代VAF 悬液制备细胞爬片。待细胞增殖汇合度达50%~80%,取出细胞爬片,用4%多聚甲醛固定细胞爬片。用vimentin 抗体对大鼠VAF 作形态学及免疫化学鉴定。具体方法按pv-9000 二步法免疫组化检测试剂盒说明书。
1.2.3 基因转染:取对数增殖期细胞按5 ×104个/孔接种于6 孔板中,用10%正常培养基培养,待细胞汇合度达50%左右,按慢病毒转染说明书操作,分别干预72 h 后收集细胞。另外取同一批细胞接种于6 孔板中,0.8 ×105个/孔,用不含双抗的10%DMEM 培养液培养,观察待细胞达50%左右汇合度时进行siRNA 转染,按X-tremeGENE siRNA Transfection Reagen 说明书进行转染,以非特异性siRNA(control siRNA)阴性对照组、ifi204 siRNA 实验组分别干预6 h,换液48 h,收集细胞,空白对照细胞不做任何处理。
1.2.4 细胞划痕法和Transwell 法测细胞迁移:1)细胞划痕法:在6 孔板背后均匀画出6 条横穿过孔的线条,待孔内空白组、control siRNA 组、ifi204 siRNA 组、ifi204 基因慢病毒组、空载慢病毒组细胞汇合度达90%以上后,用划线工具垂直于孔背面横线划痕。吸弃孔内液体,并用PBS 液清洗2 遍,加入低血清培养基。显微镜下拍照后放入5% CO2、37 ℃培养箱培养,24 h 后取样,拍照。计算迁移距离,迁移距离=划痕0 h 后划痕宽度-划痕24 h 后划痕宽度,以像素(px)作为长度单位。2)Transwell法:消化细胞计数后,用无血清DMEM 培养基重悬细胞至1×106个/L。每个小室(上室)中加入100 μL上述细胞悬液,在24 孔板内(下室)加入含5 %胎牛血清的DMEM 培养基600 μL,将24 孔板置于5% CO2、37 ℃培养箱培养8 h 后,吸弃孔内培养液,上室用PBS 液洗涤3 遍后,将小室置于4%多聚甲醛中固定20 min,随后将其置于超净台中自然晾干。再将小室置于0.1%结晶紫中染色20 min,毕后用PBS 液洗涤5 遍。晾干后,显微镜下随机选取4 个视野,观察细胞并计数。
1.2.5 Real-time PCR 检测mRNA 表达:按Trizol 总RNA 提取试剂盒说明提取总RNA,取1 μg 按试剂盒说明书反转录合成cDNA,取2 μL 进行real-time PCR,ifi204 基因上游引物:5'-AAGAAGCCACAGCC AAGTGT-3',下游引物:5'-CCTCTGGGAATGTTCTG GTT-3',扩增片段长度200 bp;P53 上游引物:5'-GCTGAGTATCTGGACGACAGG-3 ',下游引物:5'-A GCGTGATGGTAAGGATG-3',扩增片段长度253 bp;GAPDH 上游引物:5'-ACCACAGTCCATGCCATCAC-3 ',下游引物:5'-TCCACCCTGTTGCTGTA-3',扩增片段长度452 bp。PCR 反应条件为:预变性95 ℃10 min、变性95 ℃15 s、延长60 ℃1 min,经41 个循环。以GAPDH 为内参照,2-ΔΔCt法计算各组P204、P53 mRNA 的相对表达量。
1.2.6 Western blot 检测蛋白表达:提取经上述方法干预的细胞总蛋白,BCA 定量,每样品孔加蛋白30 μg,进行SDS-PAGE,湿法转印蛋白条带至PVDF 膜。将膜用Western blot 封闭液封闭过夜,次日取出TBST 洗5 min ×3 次,加稀释好的一抗(1∶500)孵育2~4 h,TBST 摇床漂洗5 min ×3 次后,与通用型二抗于室温下摇床孵育2 h,再用TBST 摇床漂洗5 min ×5 次,最后加入混合的ECL发光剂,保鲜膜固定PVDF 膜。X 线片显影、定影、冲洗后对胶片扫描,最后用相关图像软件对目的蛋白/内参的吸光度比值的均数±标准差(±s)来表示。
1.2.7 流式细胞术检测细胞凋亡:收集经上述处理的5 组细胞,制成细胞悬液。碘化丙啶染色液按说明书配制。每管加入0.5 mL 碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37 ℃避光温浴30 min。染色完成后当日内行流式细胞仪检测。
1.3 统计学分析
2 结果
2.1 细胞形态及鉴定
原代培养的大鼠VAF 细胞贴壁后呈长梭形生长,部分交织呈网状(图1A)。大鼠VAF 经vimentin蛋白免疫印迹,阳性胞质棕黄色,阳性率95%以上(图1B),阴性对照见非特异性着色(图1C)。
2.2 慢病毒介导携带绿色荧光ifi204 基因转染效率
按慢病毒操作手册转染大鼠VAF 细胞,72 h 后在荧光显微镜下可见80%左右大鼠VAF 细胞内出现绿色荧光(图2)。
2.3 细胞迁移变化

图1 VAF 形态及鉴定结果Fig 1 Cell morphology and identification(×100)
细胞划痕24 h 后计算迁移距离,与blank lv 组、control siRNA 组、ifi204 siRNA 组或negative 组比较,ifi204 lv 组的迁移距离较短(P<0.05);与control siRNA 组、negative 组和blank lv 组比较,ifi204 siRNA组迁移距离延长(P<0.05);通过Transwell小室计算迁移细胞,与blank lv 组、control siRNA 组、ifi204 siRNA 组或negative 组比较,ifi204 lv 组的迁移细胞较少(P<0.05);与control siRNA 组、negative 组或blank lv 组比较,ifi204 siRNA 组迁移细胞较多(P<0.05)(图3,4)。
图2 慢病毒介导携带绿色荧光ifi204 基因转染效率Fig 2 Translation efficient of ifi204 gene with GFP was mediated by lentivirus(×100)
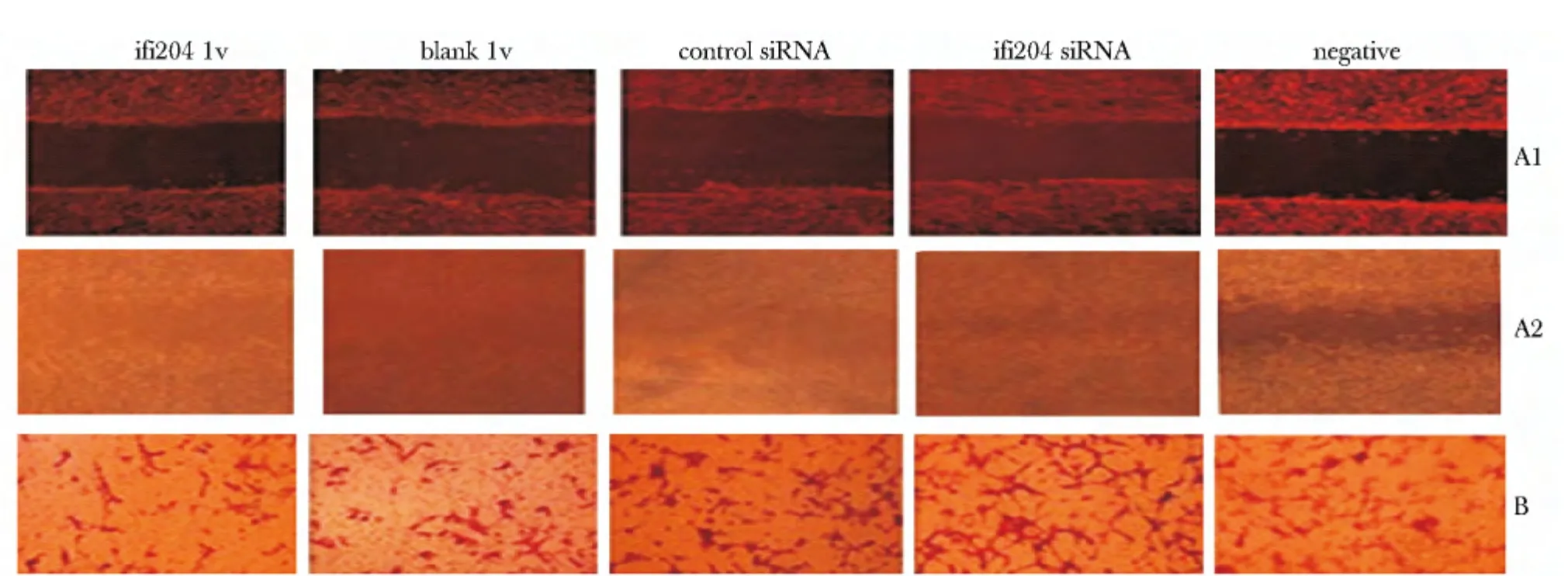
图3 干预对VAF 迁移距离和数量的影响Fig 3 Effect of intervention on migration distance and number of rat VAF(×100)
2.4 Real-time PCR 结果
ifi204 lv 组P204 mRNA 过表达,同时促进P53 mRNA 表达;ifi204 siRNA 组P204 mRNA 沉默,亦抑制P53 mRNA 表达。与blank lv 组、control siRNA 组、ifi204 siRNA 组或negative 组比较,ifi204 lv 组P204、P53 mRNA 表达上调(P<0.05);与control siRNA 组、negative 组或blank lv 组比较,ifi204 siRNA 组P204、P53 mRNA 表达下调(P<0.05)(图5)。
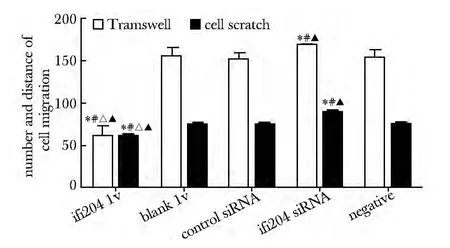
图4 干预对VAF 迁移距离和数量的影响Fig 4 Effect of intervention on migration distance(pix)and number of rat VAF(±s,n=4)

图5 干预对各组P204/P53 mRNA 表达的影响Fig 5 Effect of intervention on expression of P204/P53 mRNA of rat VAF(±s,n=4)
2.5 Western blot 结果
ifi204 lv 组P204 蛋白过表达,同时促进P53 蛋白表达;ifi204 siRNA 组P204 蛋白沉默,亦抑制P53蛋白表达。与blank lv 组、control siRNA 组、ifi204 siRNA 组或negative 组比较,ifi204 lv 组P204、P53蛋白表达上调(P<0.05);与control siRNA 组、negative 组或blank lv 组比较,ifi204 siRNA 组P204、P53蛋白表达下调(P<0.05)(图6)。
2.6 流式细胞术检测细胞凋亡的结果
与blank lv 组、control siRNA 组、ifi204 siRNA 组或negative 组比较,ifi204 lv 组晚期凋亡百分比增加(P<0.05);与control siRNA 组、negative 组或blank lv 组比较,ifi204 siRNA 晚期凋亡百分比减少 (P<0.05)。与control siRNA 组或negative 组比较,blank lv 组晚期凋亡百分比增加(P<0.05)(图7)。
3 讨论
研究发现血管重构是血管增殖性疾病及相关治疗术后再狭窄的主要病理生理机制。以前的研究忽视了血管外膜改变在血管重构中的作用[7]。近年的研究结果指出VAF 在血管重构中并非仅起支持及营养作用。在血管损伤后,位于血管外膜的VAF由“静止”状态转为“激活”状态,迁移至内膜下参与新生内膜形成[8]。因此,将VAFs 作为治疗靶点,有效地抑制其迁移、促进凋亡对防治血管增殖性疾病有重要意义。
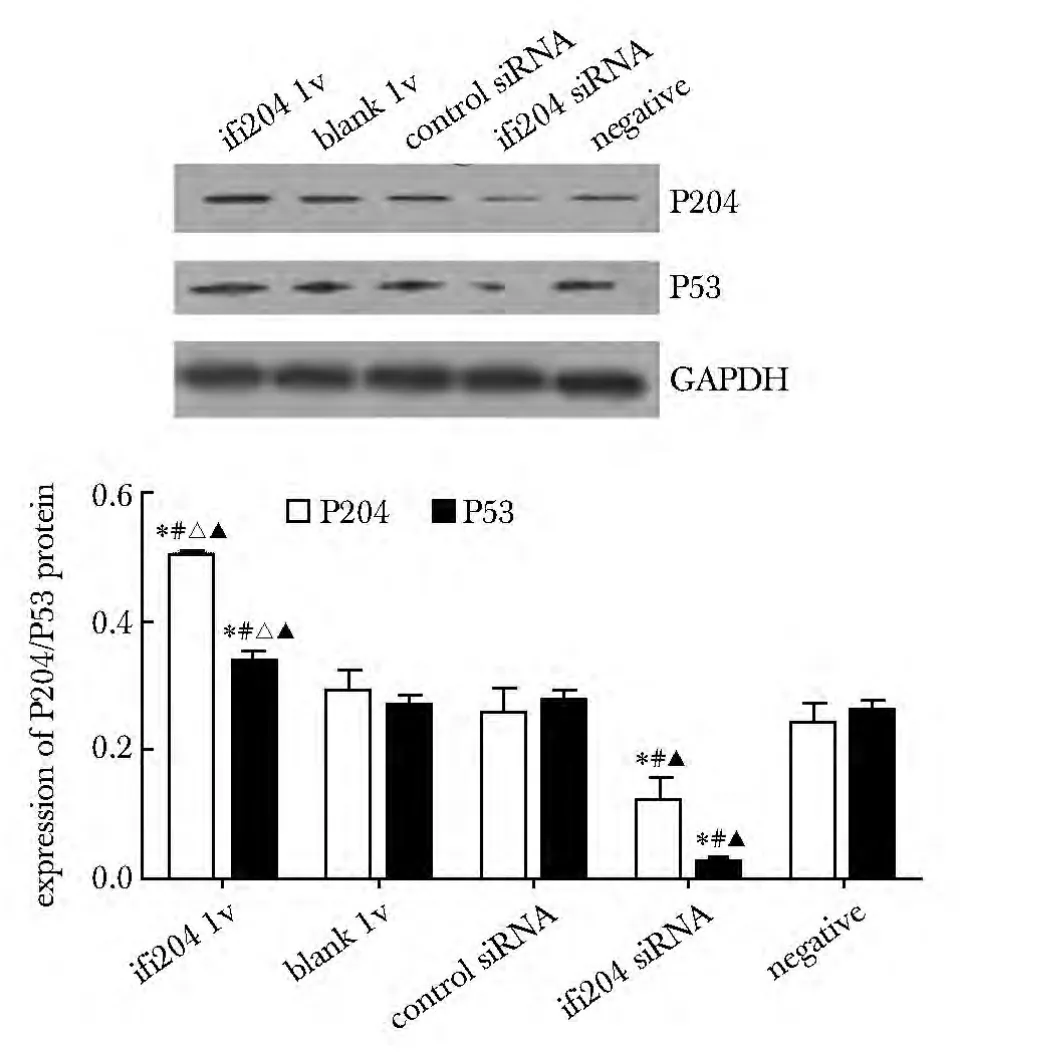
图6 干预对P204 和P53 蛋白在大鼠VAF 中的影响Fig 6 Effect of intervention on expression of P204/P53 protein of rat VAF(±s,n=4)
干扰素诱导蛋白P204(interferon-inducible protein 204,P204)是鼠类干扰素(interferon,INF)诱导蛋白P200 家族的鼠类蛋白成员,P204 可通过多种机制促进多种细胞的凋亡及抑制细胞迁移[4]。P204 通过其200 X 的MF/LHATVAT/S 模序介导和53BP1 的结合从而激活P53,抑制肿瘤细胞迁移[9]。细胞凋亡是细胞受到外界因素刺激时,经过复杂而严格的信号通路促进了细胞程序化死亡,它具有典型的caspase 依赖性,通常caspase 在被活化后,调节结构域被切除,形成异聚体蛋白酶,后者再裂解细胞周期蛋白如Rb、P21,使细胞周期得以继续,在其他因素下,促进受损细胞凋亡。
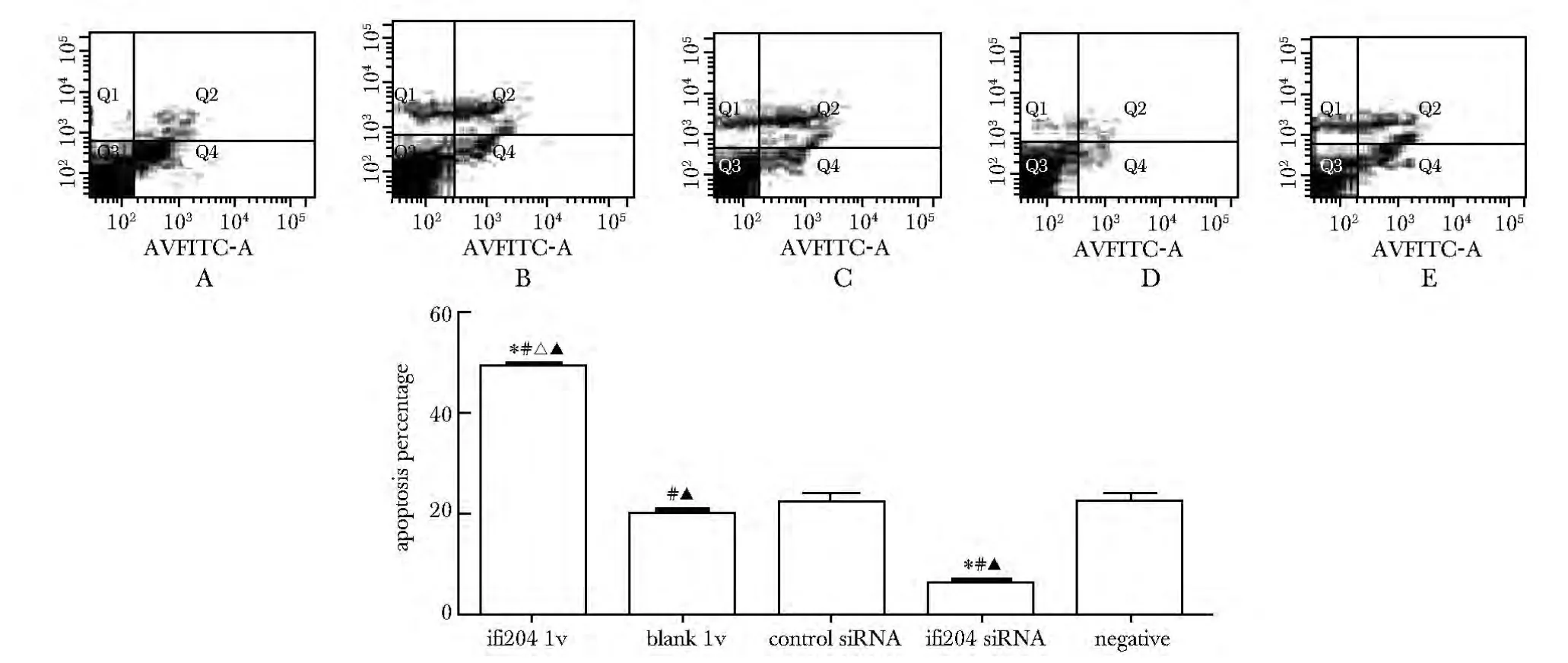
图7 流式细胞术分析干预对大鼠VAF 晚期细胞凋亡的影响Fig 7 Effect of intervention on late apoptosis of rat VAF by flow cytometry(±s,n=4)
前期研究提示P204 蛋白在大鼠血管外膜及培养的主动脉原代VAF 细胞均存在结构性表达[10]。本研究通过转染特异性ifi204 基因来观察该基因对细胞生物学功能的影响,结果显示在P204 过表达组中,P204 表达上调与正常组差异无成倍数增加(可能与P204 在VAF 细胞基础表达较多有关),细胞凋亡率上调,细胞迁移速度降低;在沉默组中,P204 的表达下调,细胞活力提高,细胞凋亡减少,细胞迁移速度加快。提示P204 蛋白过表达不仅可以促进大鼠VAF 细胞凋亡,而且可以抑制细胞迁移。与control siRNA 组或negative 组比较,blank lv 组晚期凋亡百分比增加,可能是慢病毒外源性介入对该细胞的影响,具体机制和原因有待研究。另外发现,P53 和P204 mRNA 或蛋白的表达变化呈一致性趋势,提示P53 参与了P204 介导的细胞凋亡和迁移。结合本研究结果认为,在VAF 中,P204 通过活化P53 使其表达上调是抑制VAF 迁移及促进其凋亡的机制之一,至于P204 介导VAF 迁移和凋亡是否还有其他路径和机制有待进一步研究。
综上所述,P204 在鼠VAF 中存在基础表达,具有抑制VAF 迁移,促进其凋亡的生物学效应,P53 可能同时参与了该效应的调控过程。
[1]Sartore S,Chiavegato A,Faggin E,et al.Contribution of adventitial fibroblasts to neointima formation and vascular remodeling:from innocent bystander to active participant[J].Circ Res,2001,89:1111-1121.
[2]Strauss BH,Rabinovitch M.Adventitial fibroblasts:defining a role in vessel wall remodeling[J].Am J Respir Cell Mol Biol,2000,22:1-3.
[3]Chiang HY,Korshunov VA,Serour A,et al.Fibronectin is an important regulator of flow-induced vascular remodeling[J].Arterioscler Thromb Vasc Bio,2009,29:1074-1079.
[4]Liu CJ,Wang H,Zhao Z,et al.Myod-dependent induction during myoblast differentation of p204,a protein also inducible by interferon[J].Mol Cell Biol,2000,20:7024-7036.
[5]黄晶,宋方,吴强,等.干扰素诱导蛋白16 对人脑血管外膜成纤维细胞增殖与迁移的影响及机制[J].中国病理生理杂志,2013,29:584-589.
[6]宋方,吴强,陆德琴,等.一套系统培养鼠主动脉血管壁细胞简单可靠方[J].中国动脉硬化杂志,2011,19:361-366.
[7]沈丹彤,傅向阳,黄巧冰.衰老和低氧对体外培养大鼠肺动脉平滑肌细胞形态的影响[J].中国病理生理杂志,2007,23:284-287.
[8]郭淑杰,吴凌云,魏坚,等.血管外膜成纤维细胞分化相关蛋白研究[J].化学学报,2007,65:1504-1510.
[9]Ding Y,Wen Y,Spohn B,et al.Proapoptotic and antitumor activities of adenovirus-mediated p202 gene transfer[J].Clin Cancer Res,2002,8:3290-3297.
[10]宋方,吴强,谭洪文,等.IFNα 通过p204 抑制大鼠主动脉外膜成纤维细胞增殖[J]基础医学与临床,2012,32:1431-1436.

