胃癌细胞中长链非编码RNA SNHG5与miR-26b间的相互作用
李延爽,赵连梅,孙佳增,刘彦信,郑德先,史 娟
(中国医学科学院基础医学研究所医学分子生物学国家重点实验室,北京100005)
LncRNA 是一种长度大于200nt 的功能RNA,无蛋白质编码功能,越来越多的证据表明lncRNA在胃癌中异常表达,且与肿瘤的生长、转移、诊断及预后高度相关。SNHG5 是长度为524 bp 的lncRNA,为snoRNA U50 和U50'的宿主基因外显子的成熟剪接体,U50 位于染色质基因组断点位置[1]。U50 在多种癌症中被证实其与肿瘤细胞的增殖密切相关[2],可作为筛选肿瘤相关基因的重要指标。因此作为U50 宿主基因成熟剪接体的SNHG5 可能在肿瘤的发生发展中也发挥着重要作用。
MicroRNA 是一种长度为19~23 nt 的内源性小分子。miR-26b 在大多数恶性肿瘤中表达下调[3],同时miR-26b 能够通过靶向CDK8 抑制肿瘤细胞的增殖[4]。ceRNA(competing endogenous RNA)通过竞争性结合microRNA 来调节基因表达,是RNA 间相互作用的一种新机制。胃癌中lncRNA HOTAIR 可通过结合miR-331-3p 来调节HER2 的表达[5];过表达lncRNA GAS5 可抑制miR-21 的表达但对其前体的表达没有影响[6]。目前关于microRNA 与lncRNA 间相互作用的研究较少。通过生物信息学方法预测发现lncRNA SNHG5 可与miR-26b 的种子序列结合,因此本研究选取SNHG5 和miR-26b 作为研究对象,旨在探讨miR-26b 与lncRNA SNHG5 在胃癌细胞中的相互作用,进而为胃癌的发生发展及其治疗提供新的研究方向。
1 材料与方法
1.1 材料
胎牛血清(Hyclone 公司),RPMI1640 培养基(Life Technologies 公司),lipofectamine 2000 和Trizol(Invitrogen 公司),反转录缓冲液、M-MLV 反转录酶及RNA 酶抑制剂(Promega 公司),2 × qPCR mix(Takara 公司),Taq Man Small RNA Assays 试剂盒(Applied Biosystems 公司)。
1.2 方法
1.2.1 构建SNHG5 过表达质粒:在SNHG5 序列两端除poly A 尾外的序列处设计扩增引物,经PCR 方法扩增SNHG5 全长序列,将全长序列克隆至真核过表达载体pSilencerTM-CMV。经测序正确后用于后续实验。
1.2.2 细胞转染:SNHG5 过表达质粒4 μg 或miR-26b mimics(100 nm)及其对照质粒或NC mimics(100 nm)分别与无血清1640 培养基混合,最终体积为250 μL。同时将4 μL lipofectamine 2000 与246 μL无血清培养基混合,充分混匀后在室温静置5 min。将含有脂质体的培养基与质粒或mimics 的培养基混合并充分混匀,静置20 min,均匀的将混合物滴加至含500 μL 无血清培养基的6 孔板中,在37 ℃培养箱中继续培养48 h 后用于提取细胞总RNA。
1.2.3 实时定量PCR 检测SNHG5 的表达:用Trizol法提取细胞总RNA(按照Trizol 说明书操作)。Nanodrop 紫外分光光度计测定RNA 的浓度及纯度,以1 μg 总RNA 进行反转录。以反转录产物为模板进行PCR 反应,反应体系为20 μL,反应条件为95 ℃5 min,95 ℃15 s,58 ℃30 s,72 ℃30 s,循环40次。miR-26b 的检测以U6 为内参,检测SNHG5 表达情况以GAPDH 为内参,数据以2-△△Ct法进行分析。所用引物(表1)由上海生工生物工程有限公司合成。
1.2.4 Taq Man 定量PCR 检测microRNA 的表达变化:将以Trizol 法提取的细胞总RNA 作为反转录模板,参照Applied Biosystems 公司TaqMan Small RNA Assays 说明书进行反转录以及PCR 检测,Taq Man 定量PCR 反应体系为20 μL,反应条件为50 ℃2 min,95 ℃10 min,40 个循环(95 ℃15 s,60 ℃60 s),以U6 为内参,数据以2-△△Ct法进行分析。
1.3 统计学分析
所有实验数据均为3 次独立重复实验得出,实验数据以均数±标准差(±s)表示,用SPSS19.0进行统计分析。

表1 PCR 引物序列Table 1 The primer sequences
2 结果
2.1 SNHG5 在胃癌细胞中高表达
SNHG5 在胃癌细胞SNU-1、MGC-803、HGC-27、SGC-7901、MKN-45 和MKN-28 中的表达均高于在GES-1 细胞中的表达(P<0.05)(图1)。
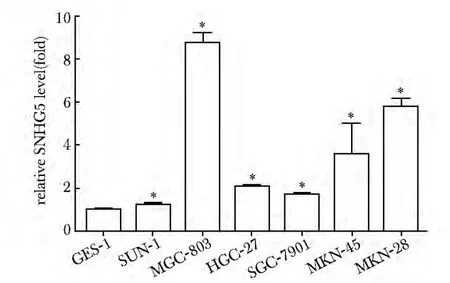
图1 SNHG5 在胃癌细胞中表达明显高于在正常胃上皮细胞GES-1 中的表达Fig 1 Expression level of SNHG5 in gastric cancer cells is significantly higher than that in normal gastric epithelial cell GES-1(±s,n=3)
2.2 过表达SNHG5 可抑制miR-26b 及pri-miR-26b 的表达
SNHG5 序列上存在miR-26b 种子序列的结合位点(图2A)。过表达SNHG5 后,miR-26b(图2B)的水平明显下降(P<0.01),pri-miR-26b(图2C)的表达也受到显著抑制(P<0.01)。

图2 SNHG5 过表达抑制miR-26b 和pri-miR-26b的表达Fig 2 SNHG5 suppressed the expression of miR-26b and pri-miR-26b(±s,n=3)
2.3 过表达miR-26b mimics 不能抑制SNHG5 的表达
MGC-803 细胞转染miR-26b mimics 后,miR-26b的表达明显高于对照组(P<0.01)(图3A),SNHG5 的表达基本不变(图3B)。
3 讨论
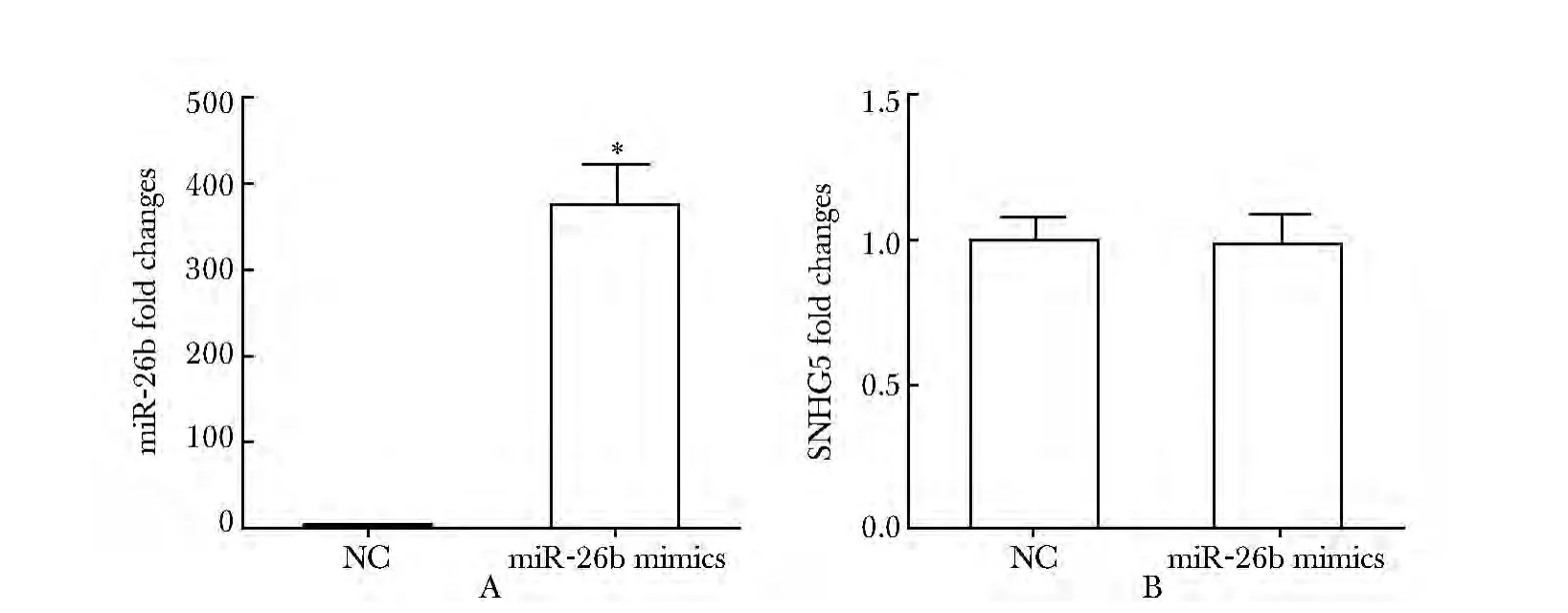
图3 miR-26b 不能影响SNHG5 的表达Fig 3 miR-26b could not affect the expression of SNHG5(±s,n=3)
LncRNA 在基因组中普遍发生转录,可参与调节基因表达的几乎各个过程,然而lncRNA 在很多疾病中的作用机制还不是很清楚。SNHG5 作为位于染色质基因组断点U50 的宿主基因外显子的剪接体,可能是重要的肿瘤相关基因。SNHG5 在经X-线照射的TK6 细胞及其邻近的未经照射的细胞中表达均发生显著变化[7]。因此SNHG5 可能在肿瘤中发挥重要作用。
本研究首先检测到SNHG5 在胃癌细胞中高表达,而通过软件预测发现miR-26b 与SNHG5 间存在结合位点。miR-26b 在乳腺癌组织中通过作用于CDK8 抑制肿瘤细胞的增殖[4],在肝癌细胞中能够抑制NF-κB 信号通路,同时通过靶作用于TAK1 和TAB3 而增强细胞的化学敏感性[8],在全血中可作为检测胰腺癌的重要生物标志[9],这些已有结果提示研究SNHG5 和miR-26b 之间的相互作用将在胃癌的治疗中发挥重要作用。在胃癌细胞中过表达SNHG5 能够抑制miR-26b 及primiR-26b 的表达,随后检测到在过表达miR-26b 的MGC-803 细胞中SNHG5 的表达没有发生显著变化。结果提示SNHG5 抑制miR-26b 及pri-miR-26b 的表达可能是通过其他更复杂的机制发生作用,而不是通过两者的直接结合。
目前关于lncRNA 与miRNA 间相互作用的研究甚少,lncRNA 与miRNA 相互作用的复杂性可能是由于它们在细胞核内形成了一个复杂的调节网络,在这个网络中lncRNA 通过作用于网络内的其他成员而抑制miRNA 的表达。ceRNA 假说揭示了RNA 间相互作用的新机制,lncRNA HOTAIR 通过结合miR-331-3p 抑制其表达进而调节miR-331-3p 靶基因HER2 的表达,lncRNA H19 通过与miR-19a 相互作用影响MYCN 的表达。本研究发现lncRNA SNHG5 可抑制miR-26b 及pri-miR-26b的表达,为lncRNA 与miRNA 间相互作用的研究奠定了基础,为胃癌的发生发展及其治疗提供了新的研究方向。
[1]Tanaka R,Satoh H,Moriyama M,et al.Intronic U50 small-nucleolar-RNA (snoRNA)host gene of no proteincoding potential is mapped at the chromosome breakpoint t(3;6)(q27;q15)of human B-cell lymphoma[J].Genes Cells,2000,5:277-287.
[2]Pacilli A,Ceccarelli C,Treré D,et al.SnoRNA U50 levels are regulated by cell proliferation and rRNA transcription[J].Int J Mol Sci,2013,14:14923-14935.
[3]Li J,Kong XJ,Zhang JF,et al.MiRNA-26b inhibits proliferation by targeting PTGS2 in breast cancer[J].Cancer Cell Int,2013,13:1-7.
[4]Li J,Li XY,Kong XJ,et al.MiRNA-26b inhibits cellular proliferation by targeting CDK8 in breast cancer[J].Int J Clin Exp Med,2014,7:558-565.
[5]Liu XH,Sun M,Nie FQ,et al.Lnc RNA HOTAIR functions as a competing endogenous RNA to regulate HER2 expression by sponging miR-331-3p in gastric cancer[J].Mol Cancer,2014,13:92.doi:10.1186/1476-4598-13-92.
[6]Zhang Z,Zhu Z,Watabe K,et al.Negative regulation of lncRNA GAS5 by miR-21[J].Cell Death Differ,2013,20:1558-1568.
[7]Chaudhry MA.Small nucleolar RNA host genes and long non-coding RNA responses in directly irradiated and bystander cells[J].Cancer Biother Radiopharm,2014,29:135-141.
[8]Zhao N,Wang RZ,Zhou LJ,et al.MicroRNA-26b suppresses the NF-κB signaling and enhances the chemosensitivity of hepatocellular carcinoma cells by targeting TAK1 and TAB3[J].Mol Cancer,2014,13:35.doi:10.1186/1476-4598-13-15..
[9]Schultz NA,Dehlendorff C,Jensen BV,et al.MicroRNA biomarkers in whole blood for detection of pancreatic cancer[J].JAMA,2014,311:392-404.

