干热处理对米糠蛋白结构与功能特性的影响
王长远,郝天舒,张 敏
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.北京工商大学食品学院,北京 100037)
干热处理对米糠蛋白结构与功能特性的影响
王长远1,郝天舒1,张 敏2
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.北京工商大学食品学院,北京 100037)
摘 要:对干热处理后米糠蛋白的结构及功能特性变化进行探讨,结果表明:90 ℃干热处理下米糠蛋白组分发生明显的热变性,米糠蛋白的β-折叠结构含量有较大程度降低,并主要转变为无规卷曲结构和β-转角结构。随着干热处理温度的升高,α-螺旋结构含量逐渐增大,无规卷曲结构和β-转角结构含量并未表现出明显的线性变化趋势。干热处理条件下无序结构的增多促进了米糠蛋白的水合作用,使米糠蛋白溶解性增加,而随着干热处理温度升高至100 ℃,米糠蛋白的溶解度有所降低;无序结构增多使米糠蛋白整体柔性增强,随着干热处理温度的升高,米糠蛋白的乳化性呈现先减小后增大的变化趋势,在100 ℃干热处理下米糠蛋白乳化性达到最大值45.56 m2/g,而米糠蛋白的乳化稳定性亦有所增加;米糠蛋白起泡性随干热处理温度的升高呈现先增大后减小的变化趋势,干热处理温度80 ℃时米糠蛋白起泡性达到最大值为87.36%,米糠蛋白的泡沫稳定性随干热处理温度升高逐渐降低。
关键词:干热处理;米糠蛋白;蛋白质结构;功能特性
米糠蛋白作为一种高营养价值的植物源蛋白质,其必需氨基酸组成齐全,氨基酸组成接近联合国粮食及农业组织(Food and Agriculture Organization,FAO)/世界卫生组织(World Health Organization,WHO)的推荐模式,且生物效价接近于牛乳中的酪蛋白,消化率较高。另外,由于米糠蛋白具有低过敏性的优点,可将其较好地应用于婴幼儿食品中[1-3]。尽管米糠蛋白的营养价值较高,但米糠蛋白的有效提取及功能性质发挥相对受到限制,因而现今的研究多围绕增进米糠蛋白提取率及合理的蛋白改性展开[4-8]。其中干热处理是米糠蛋白较常用的处理方法,但目前对此处理方法的研究多集中在以提高蛋白得率为目标的提取工艺上,对于干热处理下米糠蛋白结构特征及功能特性变化的研究尚未见报道。
本实验拟采用红外光谱研究干热处理对米糠蛋白结构的影响,并探究干热处理对米糠蛋白功能特性的影响,以期为米糠蛋白的功能特性改良提供指导。
1 材料与方法
1.1材料与试剂
米糠蛋白由实验室制备(蛋白质含量为89.21%);实验所用化学试剂均为国产分析纯。
1.2仪器与设备
DHG-9240A型电热恒温鼓风干燥箱 上海一恒科技有限公司;PE Spectrum Two红外光谱仪 美国PE公司;Pyris6 DSC差示扫描量热仪 美国Perkin Elmer公司;TD5A-WS台式低速离心机 湖南湘仪实验室仪器开发有限公司;pHS-3D pH计 上海雷磁仪器厂;Xo-400SD多频超声细胞破碎仪 南京先欧仪器制造有限公司。
1.3方法
1.3.1 米糠蛋白的粗提取
将新鲜粗米糠(蛋白质含量约为14.0%)过60 目筛除杂质,向过筛米糠中以1∶6(m/V)的比例加入正己烷,室温下搅拌2 h,然后停止搅拌,静置5 min将上清液倒入回收瓶待回收,再以料液比1∶4(m/V)加入正己烷继续搅拌2 h,4 000 r/min离心5 min,沉淀在通风橱中室温风干,制得脱脂米糠备用。
脱脂米糠100 g,按料液比 1∶10(m/V)加入1 000 mL水,用NaOH溶液调pH值至9,45 ℃条件下恒温水浴搅拌2 h,4 000 r/min离心20 min,收集上清液,调节pH值至4.5,静置沉淀后4 000 r/min离心15 min,倾去上清液,沉淀于4 ℃条件下对蒸馏水透析48 h,将沉淀真空冷冻干燥,即得到米糠蛋白粉粗品,于-20 ℃条件下保存备用。
1.3.2 米糠蛋白的干热处理
将米糠蛋白粉溶解在pH 7.4、10 mmol/L的磷酸盐缓冲液(标准缓冲液)中,配制成质量分数为3%的米糠蛋白溶液,磁力搅拌2 h使米糠蛋白充分溶解。4 000×g离心10 min除去不溶物,以用作储备液。将储备液用标准缓冲液稀释分装在三角瓶中,用软胶塞塞住瓶口避免水分蒸发。储备液经-40 ℃冰箱冷冻48 h,在-55 ℃条件下冻干处理成米糠蛋白粉样品备用。
将米糠蛋白粉分别于60、70、80、90、100 ℃的恒温箱中干热处理30 min,然后取出一部分冷冻干燥成为干粉,于-20 ℃冰箱中保存备用,另外一部分于4 ℃冰箱中保存备用。对应于干热处理温度60、70、80、90、100℃,将干热处理米糠蛋白样品分别记为G-1、G-2、G-3、G-4、G-5;未经干热处理的米糠蛋白作为对照样品,记为RBP。
1.3.3 差示扫描量热法(differential scanning calorimetry,DSC)分析
称取5 mg样品放入铝盒中,再向其中加入10 μL 0.01 mol/L的磷酸盐缓冲溶液(pH 7.0),压盘密封,室温条件下放置6 h;将平衡好的样品铝盒放入到DSC操作台左侧,空白铝盒放置在右侧。温度扫描范围:30~150 ℃;升温速率:10 ℃/min;在150 ℃保持1 min;随后从150 ℃降温至30 ℃,降温速率:30 ℃/min。记录此过程中米糠蛋白的变性温度(Td)和热焓变(ΔH)。
1.3.4 红外光谱扫描
准确称量2 mg米糠蛋白样品,加入一定量的KBr至200 mg,用研钵研磨成均匀粉末,压制成薄片,再用红外光谱仪做全波段扫描(4 000~400 cm−1),扫描次数32。
1.3.5 溶解度测定
蛋白质的溶解度以氮溶指数表示。精确称取2.00 g米糠蛋白样品,溶解于45 mL蒸馏水中,调节pH值至7.0,室温条件下搅拌1 h后,4 000 r/min离心20 min除去沉淀,测定上清液中的氮含量。按照公式(1)计算米糠蛋白的溶解度。

1.3.6 乳化活性指数及乳化稳定性测定
准确称取1.00 g米糠蛋白样品,加入到0.05 mol/L pH 7.0的磷酸盐缓冲液中,使之充分溶解,配制成质量分数为1%的蛋白溶液100 mL。取75 mL蛋白溶液与25 mL大豆油充分混合,在高速剪切乳化机下10 000 r/min乳化2 min,然后立刻在烧杯底部吸取20 μL乳状液(此时计为0 min),加入到5 mL 0.1%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中混合均匀,使之稀释250 倍。以质量分数为0.1%的SDS溶液为空白样品,测定500 nm波长处的吸光度。按照公式(2)计算米糠蛋白的乳化活性指数(emulsifying activity index,EAI)。
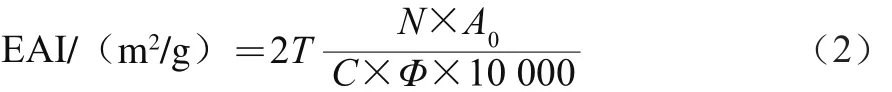
式中:T为经验常数,2.303;N为稀释倍数,250;C为乳化液未形成前蛋白质溶液的质量浓度(g/mL);Φ为乳化液中的油相体积分数,0.25;A0为0 min时的吸光度;10 000是比色皿光径的换算数,单位为m。
米糠蛋白的乳化稳定性:待上述乳化液放置10 min后,再从烧杯底部吸取乳状液(确保与0 min取样点的高度相同),按如上方法测定吸光度。按照公式(3)计算米糠蛋白的乳化稳定性(emulsion stability,ES)。

式中:A0为0 min时的吸光度;A10为10 min时的吸光度;t为间隔时间,10 min。
1.3.7 起泡性及泡沫稳定性测定
取一定量米糠蛋白样品加入到0.01 mol/L pH 7.0磷酸盐缓冲液中,配制成质量分数为5%的蛋白溶液,取200 mL在高速均质机下10 000 r/min搅打2 min,快速移至500 mL量筒中(此时计为0 min),记录0、15 min时泡沫的高度,以此表示蛋白起泡能力的大小,并进行3 次重复实验。分别按照公式(4)、(5)计算米糠蛋白的泡沫膨胀率和泡沫稳定性。
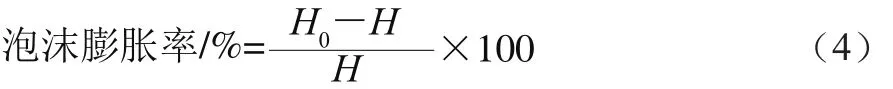
式中:H为未搅打时蛋白溶液的高度/cm;H0为搅打停止时泡沫的高度/cm。
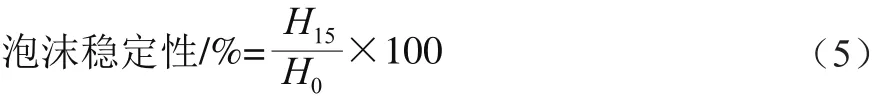
式中:H15为搅打停止静置15 min时泡沫的高度/cm。
1.4数据处理
采用SPSS 19.0对数据进行差异显著性分析,其他数据拟合处理采用Origin 8.5软件。
2 结果与分析
2.1米糠蛋白的DSC图谱分析

图1 不同干热处理下米糠蛋白的DSC图谱Fig.1 DSC analysis of untreated and heat-treated rice bran protein
应用差示扫描量热仪测定热处理过程中米糠蛋白的变性程度主要表现为两个指标,即变性温度(Td)和热焓变(ΔH),其中Td可用于推测蛋白质的热稳定性,而ΔH是疏水作用与蛋白质结构紧密性的重要指标。
由图1a可知,未经热处理的米糠蛋白变性温度为73.59 ℃,热焓变值为1.478 J/g。由图1b和图1c可知,80 ℃和90 ℃干热处理下米糠蛋白的热变性温度高于天然米糠蛋白,但80 ℃干热处理下的米糠蛋白尚未发生变性,不过热焓变值(0.638 1 J/g)有所降低,表明此处理条件下米糠蛋白结构发生局部展开,非极性基团更多地暴露于溶剂中,部分蛋白质分子内的氢键断裂,致使其热焓变值小于天然米糠蛋白。而由图1c可知,米糠蛋白在90 ℃干热处理后已发生明显的变性,米糠蛋白的热变性峰消失。
2.2米糠蛋白的红外光谱分析
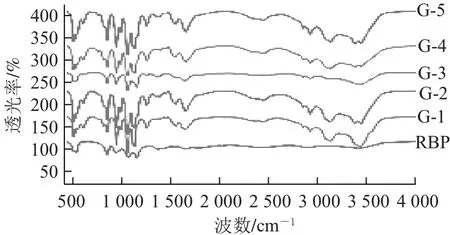
图2 不同干热处理下的米糠蛋白FT-IR光谱Fig.2 FT-IR spectra of rice bran protein subjected to different dry heat-treatments
选取红外光谱的酰胺Ⅰ带来分析米糠蛋白的二级结构组成[9],采用Peakfit软件对蛋白质酰胺Ⅰ带进行解析,首先对所得红外光谱的酰胺Ⅰ带进行傅里叶去卷积处理[10],控制半峰宽为5 cm-1,增强因子为1.0。结合原始图谱和去卷积谱得到的子峰峰位,进行相应二级结构构象指认。各峰位的归属指认依据:β-折叠结构,1 637、1 615、1 695 cm-1;β-折叠或β-转角结构,1 684 cm-1;β-转角结构,1 670 cm-1;α-螺旋结构,1 640 cm−1;无规卷曲结构,1 649 cm-1[11]。
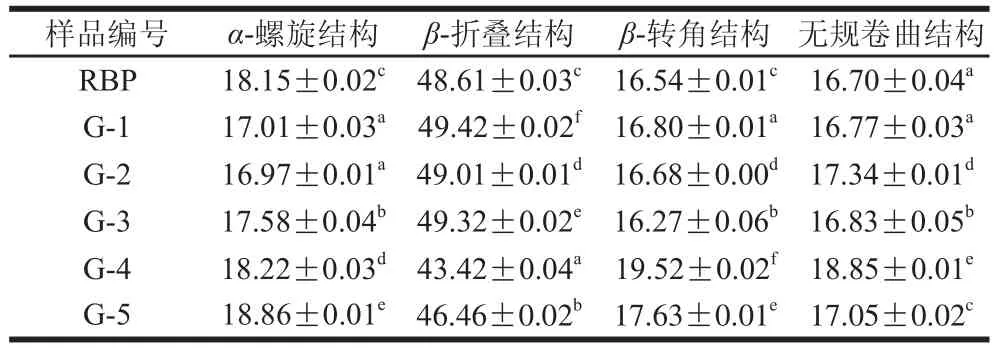
表1 利用酰胺Ⅰ带拟合米糠蛋白二级结构组成比例Table 1 Secondary structure of rice bran protein fitted by amide I band %
由表1可知,天然米糠蛋白(RBP)的主要组成为β-折叠结构,占二级结构总量的48.61%。而干热处理后米糠蛋白的主要二级结构仍为β-折叠结构,低于90 ℃干热处理下的米糠蛋白的β-折叠结构含量高于天然米糠蛋白,而90 ℃干热处理下的米糠蛋白的β-折叠结构含量有较大程度的降低,这表明米糠蛋白热变性造成了β-折叠结构的损失。通过比较可知,90 ℃干热处理下的米糠蛋白β-折叠结构主要转变为了无规卷曲结构和β-转角结构,更多的无序结构也是蛋白质变性的典型体现。另外,蛋白质热变性下聚集现象也是β-折叠结构含量降低的一个可能原因[12]。而在100 ℃干热处理下的米糠蛋白β-折叠结构含量增加可能是由于β-转角结构转变而成。
随着干热处理温度的升高,米糠蛋白α-螺旋结构含量逐渐增高,无规卷曲结构和β-转角结构含量并没有表现出明显的线性变化趋势,但在干热处理温度高于90 ℃时,米糠蛋白因热变性而体现出这两种结构的含量明显高于天然米糠蛋白。
2.3米糠蛋白的溶解性
蛋白质的溶解性是蛋白质最主要的功能特性,溶解性的强弱在很大程度上影响着其他功能性质,另外,蛋白质的溶解性也会较为显著地影响蛋白质的商用及营养价值。
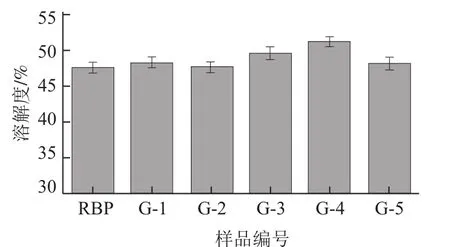
图3 干热处理对米糠蛋白溶解性的影响Fig.3 Effect of dry heat treatment on the solubility of rice bran protein
由图3可知,天然米糠蛋白(RBP)的溶解性较差,约为47.5%,而干热处理后,米糠蛋白的溶解性部分增大,主要是在90 ℃干热处理下的米糠蛋白溶解性提升了近5%。这可能是由于米糠蛋白热变性后结构遭到破坏,促进了蛋白质的水合作用,从而使米糠蛋白的溶解性有所增加。干热处理下米糠蛋白之所以溶解性增加并不明显可能与此条件易于促进米糠蛋白的分子聚集有关[13]。而随着干热处理温度升高到100 ℃,蛋白质空间构象中的某些弱键断裂,破坏了肽键的特定结构,使原来埋藏在分子内部的一些非极性基团暴露在分子表面,因而降低了蛋白质的溶解度,促使蛋白质分子之间相互结合而凝结沉淀[14]。
2.4米糠蛋白的乳化性及乳化稳定性
乳化性是指互不相溶的液体在机械搅拌后形成乳状液的能力。乳化性是蛋白质较为重要的表面性质之一,这主要是由于蛋白质分子链内分布有较多的亲水性或疏水性基团,决定了蛋白质的表面活性特点。米糠蛋白的乳化性在食品加工过程中起到了重要作用,因此现今的许多研究都围绕此功能性质开展。
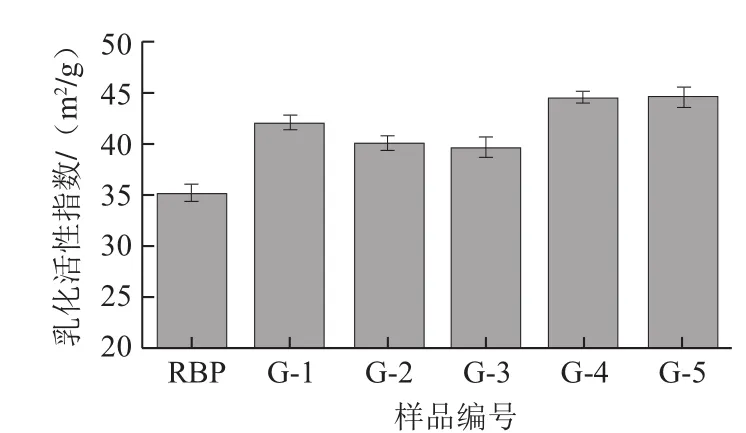
图4 干热处理对米糠蛋白乳化性的影响Fig.4 Effect of dry heat treatment on the emulsifying activity of rice bran protein
由图4可知,天然米糠蛋白(RBP)的乳化性较好(35.1 m2/g),而经干热处理后米糠蛋白的乳化性进一步提升,并且随着干热处理温度的增加,米糠蛋白的乳化性呈现先降低后升高的变化趋势。90 ℃干热处理下的米糠蛋白溶解性增加(图3)主要是由于米糠蛋白分子发生了热变性,蛋白质结构逐渐展开,有序的β-折叠结构被破坏,逐渐转变为无规卷曲及β-转角结构,故蛋白质整体柔顺性增强,并暴露出更多的疏水性位点,使米糠蛋白更易于分散于乳化界面中,从而提高了米糠蛋白的乳化性[15]。
当干热处理温度低于90 ℃时,米糠蛋白的乳化性随着处理温度的升高而降低,其可能的原因是此时的处理温度低于米糠蛋白的热变性温度,米糠蛋白结构解折叠程度较低,二级结构组成中有序结构单元的含量变化相对较小,无规则结构的含量并未呈现较大幅度增加,更多的疏水基团并未能完全暴露出来,而干热处理下米糠蛋白的热聚集效应随着温度的增加而逐渐增强,降低了蛋白质与油脂之间的结合,因而米糠蛋白的乳化性会出现随着干热处理温度增高而降低的变化趋势。
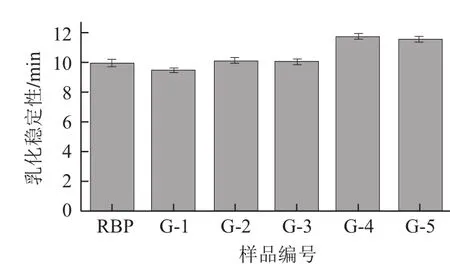
图5 干热处理对米糠蛋白乳化稳定性的影响Fig.5 Effect of dry heat treatment on the emulsion stability of rice bran protein
如图5所示,干热处理下米糠蛋白的乳化稳定性部分有提高,即仅在超过米糠蛋白热变性温度时乳化稳定性有所增加,此条件下米糠蛋白的乳化性也有所升高,这主要是由于更多疏水性基团的暴露对于乳化液起到了稳定作用。
2.5米糠蛋白的起泡性
为了测定米糠蛋白的起泡性,实验采用泡沫膨胀率为指标进行分析。干热处理对米糠蛋白起泡性的影响如图6所示,未经干热处理的米糠蛋白(RBP)起泡性较差,这主要是由于天然米糠蛋白的结构相对致密,内部富含二硫键,增进了结构的紧实性,因此难以分散形成泡沫[16-17]。
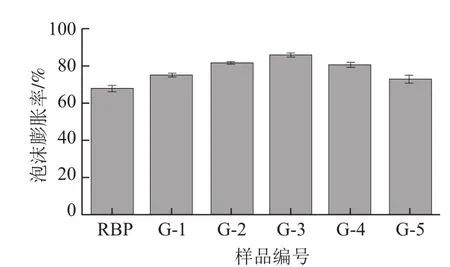
图6 干热处理对米糠蛋白起泡性的影响Fig.6 Effect of dry heat treatment on the foaming capacity of rice bran protein
由图6可知,干热处理后米糠蛋白的起泡性呈现先增大后降低的变化趋势,在低于90 ℃时米糠蛋白的起泡性随着处理温度的升高而增大,这主要是由于干热处理下米糠蛋白结构逐渐展开,形成更多的无规卷曲结构,展开的蛋白质分子间彼此作用构成更加稳定的网络结构及界面膜,使米糠蛋白的起泡性得以增强[18-20]。当干热处理温度高于90 ℃时,随着干热处理温度的进一步升高,米糠蛋白产生明显的热变性,蛋白质分子展开程度增大,内部的疏水基团和巯基暴露程度增加,米糠蛋白分子之间通过非共价键重新连接形成更大的分子聚集体,水-空气界面膜的稳定性降低,使米糠蛋白在高干热处理温度下起泡性下降[21-23]。

图7 微波处理对米糠蛋白起泡稳定性的影响Fig.7 Effect of dry heat-treatment on the foaming stability of rice bran protein
由图7可知,干热处理后米糠蛋白的泡沫稳定性逐渐降低,这主要是由于干热处理下蛋白质的疏水作用降低,米糠蛋白黏性降低,弹性也受到一定影响,使其所形成泡沫容易因空气膨胀而发生泡沫崩溃[10,24-25]。
3 结 论
本研究通过对干热处理后米糠蛋白的结构及功能特性变化规律进行研究,发现米糠蛋白的主要组成为β-折叠结构,低于90 ℃的干热处理下米糠蛋白的β-折叠结构含量高于天然米糠蛋白,90 ℃干热处理下米糠蛋白因其蛋白质组分发生明显的热变性,β-折叠结构含量有较大幅度降低,并主要转变为无规卷曲结构和β-转角结构。随着干热温度的升高,α-螺旋结构含量逐渐增高,无规卷曲结构和β-转角结构含量并未表现出明显的线性变化趋势。
干热处理下米糠蛋白的溶解性有部分增大,主要是在90 ℃干热处理下米糠蛋白的溶解性提升较为显著。米糠蛋白热变性后结构的破坏以及无序结构的增加促进了米糠蛋白的水合作用,使米糠蛋白溶解性有所增加。而随着温度继续升高至100 ℃,米糠蛋白的溶解度又有所降低。
未经干热处理的米糠蛋白乳化性较好,为35.1 m2/g,随着干热处理温度的升高,米糠蛋白的乳化性呈现先降低后升高的变化趋势。米糠蛋白乳化性的增加与有序的β-折叠结构被破坏,逐渐转变为无规卷曲及β-转角结构,蛋白质整体柔顺性增强,并暴露出更多的疏水性位点有关。干热处理下米糠蛋白的乳化稳定性仅在干热处理温度超过米糠蛋白热变性温度时有所增加。
米糠蛋白起泡性随干热处理温度的升高呈现先增大后降低的变化趋势,起泡性的增加与米糠蛋白中更多无规则结构的形成有关。干热处理后米糠蛋白的泡沫稳定性逐渐降低,在100 ℃时较天然米糠蛋白降低近5%。
参考文献:
[1]PRAKASH J, RAMASWAMY H S. Rice bran proteins: properties and food uses[J]. Critical Reviews in Food Science & Nutrition, 1996, 36(6): 537-552.
[2]王腾宇, 周凤超, 李红玲, 等. 米糠蛋白的提取及其功能性质研究[J].粮油加工, 2010(11): 45-48.
[3]刘颖, 田文娟. 复合米糠蛋白粉的研制与营养价值评价[J]. 食品科学, 2012, 33(4): 292-295.
[4]SHIH F F, DAIGLE K. Use of enzymes for the separation of protein from rice fl our[J]. Cereal Chemistry, 1997, 74(4): 437-441.
[5]GNANASAMBANDAM R, HELTIARACHCHY N S. Protein concentrates from unstabilized and stabilized rice bran: preparation and properties[J]. Journal of Food Science, 1995, 60(5): 1066-1069.
[6]WANG M, HETTIARACHCHY N S, QI M, et al. Preparation and functional properties of rice bran protein isolate[J]. Journal of Agricultural and Food Chemistry, 1999, 47(2): 411-416.
[7]FANG Y, CATRON B, ZHANG Y, et al. Distribution and in vitro availability of selenium in selenium-containing storage protein from selenium-enriched rice utilizing optimized extraction[J]. Journal of Agricultural and Food Chemistry, 2010, 58(17): 9731-9738.
[8]陈季旺, 姚惠源, 张小勇, 等. 米糠可溶性蛋白的提取工艺和特性研究[J]. 中国油脂, 2003, 28(2): 46-50.
[9]孙秀发, 周才琼, 肖安红. 食品营养学[M]. 郑州: 郑州大学出版社, 2011: 151.
[10]ICONOMIDOU V A, CHRYSSIKOS D G, GIONIS V, et al. Secondary structure of chorion proteins of the teleostean fi sh Dentex dentex by ATR FT-IR and FT-Raman spectroscopy[J]. Journal of Structural Biology, 2000, 132(2): 112-122.
[11]VENYAMINOV S Y, KALNIN N N. Quantitative IR spectrophotometry of peptide compounds in water (H2O) solutions. Ⅱ. Amide absorption bands of polypeptides and fi brous proteins in α-, β-, and random coil conformations[J]. Biopolymers, 1990, 30(13/14): 1259-1271.
[12]STATHOPULOS P B, SCHOLZ G A, HWANG Y M, et al. Sonication of proteins causes formation of aggregates that resemble amyloid[J]. Protein Science, 2004, 13(11): 3017-3027.
[13]朱磊, 汪学德, 于新国. 米糠蛋白的综合研究进展[J]. 中国油脂, 2013, 38(2): 81-83.
[14]王艳玲. 米糠中四种蛋白的提取工艺及特性研究[D]. 哈尔滨: 东北农业大学, 2013.
[15]郑煜焱, 曾洁, 李晶, 等. 米糠蛋白的组成及功能性[J]. 食品科学, 2012, 33(23): 143-149.
[16]王喜波, 迟玉杰, 胥伟. 超声辅助琥珀酰化改性大豆蛋白研究[J]. 东北农业大学学报, 2011, 42(5): 6-14.
[17]尤梦圆, 何东平, 邹翀, 等. 从米糠高温粕中提取米糠蛋白及其功能特性的研究[J]. 食品工业, 2014, 35(4): 125-128.
[18]VIJITPUNYARUK T, THEERAKULKAIT C. Preparation of alcalase hydrolysed rice bran protein concentrate and its inhibitory effect on soybean lipoxygenase activity[J]. International Journal of Food Science & Technology, 2014, 49(2): 501-507.
[19]管骁, 金周筠, 金晶, 等. 米糠蛋白提取中的关键影响因素及其优化[J].食品科学, 2012, 33(10): 24-28.
[20]HAMADA J S. Characterization and functional properties of rice bran proteins modifi ed by commercial exoproteases and endoproteases[J]. Journal of Food Science, 2000, 65(2): 305-310.
[21]袁德保. 大豆蛋白热聚集行为及其机理研究[D]. 广州: 华南理工大学, 2010.
[22]EISSA A S. Newtonian viscosity behavior of dilute solutions of polymerized whey proteins. Would viscosity measurements reveal more detailed molecular properties?[J]. Food Hydrocolloids, 2013, 30(1): 200-205.
[23]PURWANTI N, van der GOOT A J, BOOM R, et al. New directions towards structure formation and stability of protein-rich foods from globular proteins[J]. Trends in Food Science & Technology, 2010, 21(2): 85-94.
[24]ZHOU Peng, LIU Xiaoming, LABUZA T P. Effects of moistureinduced whey protein aggregation on protein conformation, the state of water molecules, and the microstructure and texture of high-proteincontaining matrix[J]. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4534-4540.
[25]TANG Chuanhe, WANG Changsheng. Formation and characterization of amyloid-like fi brils from soy β-conglycinin and glycinin[J]. Journal of Agricultural and Food Chemistry, 2010, 58(20): 11058-11066.
Effect of Dry Heat Treatment on Structural and Functional Properties of Rice Bran Protein
WANG Changyuan1, HAO Tianshu1, ZHANG Min2
(1. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China; 2. School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100037, China)
Abstract:The changes in structure and functional properties of rice bran protein caused by dry heat treatment were studied in this research. Results showed that dry heat treatment at 90 ℃ caused obvious denaturation of rice bran protein, which was manifested by a considerable decrease in β-sheet content and consequently an increase in random coil and β-turn contents. The α-helix content increased gradually with an increase in heating temperature, while random coil structure and β-sheet structure did not exhibit an obvious linear trend. The dry heat treatment resulted in the formation of more disordered structures and promoted the hydration of rice bran protein, in turn improving its solubility. However, rice bran protein became less soluble after undergoing dry heat treatment at 100 ℃. The overall fl exibility of rice bran protein was enhanced due to the formation of more disordered structures, and the emulsifying activity tended to decrease and then increase with increasing temperature. Maximum emulsifying activity index (EAI) of 45.56 m2/g was obtained by dry heat treatment at 100 ℃, accompanied with an increase in emulsion stability. The foaming capacity of rice bran protein displayed an upward and then downward trend with increasing temperature. Heat treatment at 80 ℃ gave maximum foam overrun of 87.36%, and the foam stability was decreased by increasing temperature.
Key words:dry heat treatment; rice bran protein; protein structure; functional properties
doi:10.7506/spkx1002-6630-201507003
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2015)07-0013-06
作者简介:王长远(1976—),男,副教授,博士,研究方向为食品科学、粮油及植物蛋白。E-mail:byndwcy@163.com
基金项目:国家自然科学基金青年科学基金项目(31101387);国家自然科学基金面上项目(31371830);黑龙江省教育厅科学技术研究项目(12531446)
收稿日期:2014-06-18

