高甲氧基果胶对酸性大豆蛋白体系的稳定机理
李新新,刘志胜,邬 娟,李保国,*,谢曼曼
(1.上海理工大学医疗器械与食品学院,上海 20 0093;2.丰益全球研发中心,上海 200137)
高甲氧基果胶对酸性大豆蛋白体系的稳定机理
李新新1,刘志胜2,邬 娟2,李保国1,*,谢曼曼1
(1.上海理工大学医疗器械与食品学院,上海 20 0093;2.丰益全球研发中心,上海 200137)
摘 要:为揭示高甲氧基果胶对酸性豆乳体系稳定的作用机理,通过添加不同质量浓度果胶,研究在pH值由7.0~3.0降低过程中大豆蛋白的粒径、ζ-电位以及微观结构变化。结果表明:当体系pH<6.0时,果胶通过静电作用吸附在大豆蛋白胶粒上,阻止了大豆蛋白颗粒在酸性状态的聚集。果胶质量浓度≤0.2 g/100 mL,质量浓度1.5 g/100 mL的大豆蛋白聚集,体系失稳;果胶质量浓度≥0.4 g/100 mL,质量浓度1.5 g/100 mL的大豆蛋白体系在一定pH值内稳定,果胶质量浓度越大,稳定性越好。酸性大豆蛋白体系的 稳定性与大豆蛋白和果胶之间的静电吸附作用以及果胶质量浓度有关。
关键词:大豆蛋白;果胶;pH值;粒径;ζ-电位
随着人们对大豆蛋白保健作用认识的提高,大豆蛋白的需求也在不断的增大。但大豆蛋白在其等电点pH 4.5附近溶解性差,限制了它在酸性食品中的应用[1-3],而加入阴离子多糖果胶可改善大豆蛋白在酸性条件下的稳定性[4-7]。
果胶是酸性蛋白饮料中应用广泛的稳定剂,不仅能提高产品的稳定性,还可改善产品风味和质构特性[5]。果胶的主链是由D-半乳糖醛酸通过α-1,4-糖苷键键合在一起组成的D-半乳糖醛酸聚合体,支链为中性小分子糖。根据酯化度(degree of esterification,DE)分为高甲氧基果胶(high-methyl pection,HMP,DE>50%)和低甲氧基果胶(low-methyl pectin,LMP,DE<50%)。低甲氧基果胶因带有大量的负电荷,在蛋白表面吸附一定量后会与体系中的果胶发生静电排斥作用,阻碍果胶的进一步吸附,而高甲氧基果胶因电荷少而在蛋白表面吸附较多,提供空间位阻作用维持酸性体系的稳定,Liu Jinru[8]、Lam[9]等研究表明高甲氧基果胶比低甲氧基果胶更有利于酸性乳饮料的稳定。
果胶与酪蛋白形成复合物,其相互作用机理已有大量的研究[10-13],研究表明pH<5.0时阴离 子多糖果胶和酪蛋白表面的正电荷通过 静电吸引力结合,并通过静电斥力和空间位阻作用维持体系的稳定。但果胶与大豆蛋白之间的相互作用机理研究较少。Lam等[14]研究了pH 3.8和pH 7.2时果胶与大豆蛋白的相互结合,表明高甲氧基果胶和大豆蛋白在酸性条件下能够结合形成复合物,并且大豆蛋白体系能够在pH 3.8条件下维持稳定。Jaramillo等[15]研究了pH值对高甲氧基果胶和大豆分离蛋白混合物的影响。研究表明果胶与大豆蛋白在酸性体系下也能够形成复合物,维持酸性大豆蛋白体系的稳定。
本实验通过考察大豆蛋白和果胶在酸化过程中聚合物的粒径、ζ-电位的变化和酸性状态下的微观结构,研究不同的pH值、不同质量浓度的高甲氧基果胶与大豆蛋白相互作用,从而进一步揭示果胶对酸性大豆蛋白体系稳定机理,为酸性豆乳生产工艺提供理论参考。
1 材料与方法
1.1材料与试剂
大豆分离蛋白(蛋白质含量90%) 益海嘉里秦皇岛食品有限公司;果胶(食品级) 美国CP Kelco公司;柠檬酸(分析纯) 国药集团(上海)化学试剂有限公司。
1.2仪器与设备
BSA2202S型电子天平 德国Sartorius公司;FA25型高剪切分散乳化机 德国Fluko公司;RCT BS25型磁力搅拌器 德国IKA公司;S20 SevenEasypH型酸度计瑞士Mettler Toledo公司;ZetasizerNano ZS90型纳米粒度仪 英国Malvern公司;BX41型显微镜 日本Olympus公司;Milli-Q超纯水制造系统 美国Millipore公司。
1.3方法
1.3.1 样品的制备
将质量浓度1.5 g/100 mL大豆分离蛋白在40 ℃的超纯水中800 r/min搅拌分散不同的时间,冷却至室温后用高速剪切机10 000 r/min剪切1 min使大豆蛋白充分水合,用超纯水稀释100 倍,测定不同分散时间的粒径。纳米粒度仪的参数设定为:散射角度90 º,激光波长63 3 nm;温度25 ℃;颗粒折射率1.470,颗粒吸收率0.001;分散剂为水,分散剂折射率1.330[13]。每个样品重复3 次,取平均值。
1.3.2 粒径和ζ-电位的测定
将质量浓度1.5 g/100 mL大豆分离蛋白在40 ℃的超纯水中800 r/min搅拌分散3 h,冷却至室 温,用高速剪切机10 000 r/min剪切1 min。将质量浓度1 g/100 mL的果胶在75 ℃热水中溶解至少30 min,冷却备用。将大豆分离蛋白和果胶混合后用超纯水稀释100 倍,得到1.5 个蛋白分别对应0.2、0.4、0.6、0.8 个果胶的混合液,通过动态光散射法测定pH值下降过程中大豆蛋白和果胶混合液中胶粒的粒径和ζ-电位。参数设定同1.3.1节。
1.3.3 酸性大豆蛋白饮料的制备和微观结构观察
配制质量浓度为3 g/100 mL的大豆蛋白溶液和2 g/100 mL的果胶溶液,将两种液体按不同比例混合均匀,得到蛋白质量浓度为1.5 g/100 mL,果胶质量浓度分别为0.2、0.4 g/100 mL和0.6 g/100 mL的混合液。将混合液酸调至pH 4.2,混匀后200 bar均质后100 ℃水浴杀菌10 min,冷却至室温得到酸性大豆蛋白饮料。400 倍显微镜下观察混合液的状态。
2 结果与分析
2.1搅拌时间对大豆蛋白胶粒粒径的影响
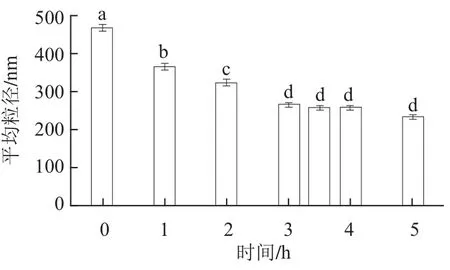
图1 搅拌时间对大豆蛋白平均粒径的影响Fig.1 Influence of mixing time of soybean protein on average particle size
由图1可知,随着搅拌时间的延长,大豆蛋白的平均粒径不断减小,搅拌溶解3 h后,大豆蛋白在水中已充分水合分散,平均粒径达到一个较为稳定的值(252.30±13.17) nm。
2.2果胶对大豆蛋白酸化过程中粒径的影响
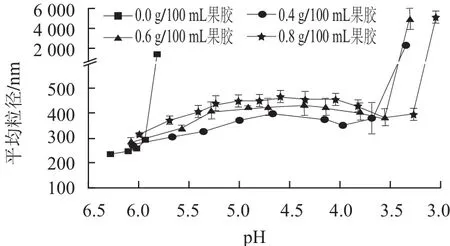
图2 果胶质量浓度对大豆蛋白酸化过程中胶粒平均粒径变化的影响Fig.2 Influence of pectin concentration on the average particle size of colloidal particles during acidification
由图2可知,因果胶为酸性阴离子多糖,添加果胶后,体系的pH值有所降低,平均粒径增大,果胶质量浓度越大,pH值越低,平均粒径越大,表明果胶吸附在了大豆蛋白表面。预备实验表明,当1.5 g/100 mL大豆蛋白体系中含有0.2 g/100 mL的果胶时,混合液中会出现明显的絮凝,这是由于果胶质量浓度低,单个聚合物分子连接两个或多个蛋白分子引起“架桥絮凝”的结果[16]。
由图2可知,随着pH值的减小,不含果胶的对照组大豆蛋白平均粒径不断增大,聚集点的pH值为5.8,与Ringgenberg等[17]用葡萄糖酸内酯(gluconolactone,GDL)酸化豆浆凝胶,Roesch等[18]将酪蛋白与大豆蛋白混合,蛋白质的聚集pH值从5.3上升到了5.8相类似。果胶质量浓度从0.4 g/100 mL增加到0.8 g/100 mL时,大豆蛋白平均粒径的变化趋势相同,呈现先增加后平稳再略微下降,然后颗粒聚集粒径大于1 μm,聚集点的pH值分别降到3.9、3.5和3.0,并且果胶的质量浓度越大,大豆蛋白胶粒的平均粒径越大,聚集点的pH值越低。当pH值为4.2时,添加不同质量浓度果胶大豆蛋白胶粒的粒径分如图3所示,颗粒大小呈正态分布,而且随着果胶质量浓度的增大,粒径分布峰值右移,果胶质量浓度为0.6 g/100 mL 和0.8 g/100 mL时的粒径分布相似,只是峰值不同。实验结果表明,在酸化过程中,果胶通过静电作用吸附在大豆蛋白颗粒的表面而使颗粒的粒径变大,可能是由于当大豆蛋白表面吸附力与质子化作用平衡时,大豆蛋白表面吸附的果胶和吸附层的塌陷量相同,大豆蛋白粒径保持不变,随着H+增多,质子化作用加大,吸附层塌陷粒径减小,当吸附层不足以提供足够的空间位阻作用时,颗粒聚集,体系失稳[19-20]。果胶质量浓度越大,果胶吸附层的厚度和空间阻力越大,聚集点pH值降低,体系可以在低酸性条件下稳定。果胶吸附层的厚度是维持体系酸性状态稳定的重要因素之一。
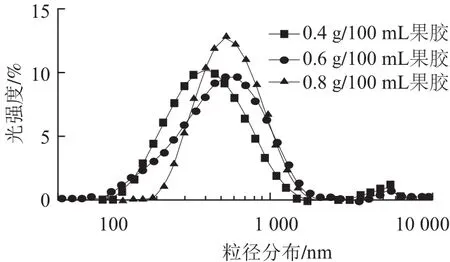
图3 大豆蛋白和果胶混合液在pH 4.2的粒径分布Fig.3 Particle size distribution of soy protein isolate-pectin mixture at pH 4.2
2.3果胶质量浓度对大豆蛋白酸化过程中ζ-电位的影响
由图4可知,添加果胶后,因果胶为酸性阴离子多糖,体系的pH值降低,少量果胶吸附到大豆蛋白表面,胶粒ζ-电位绝对值略微地增大,酸性状态下ζ-电位绝对值始终大于对照组,表明聚阴离子多糖果胶分子在静电作用下吸附到大豆蛋白分子的表面。胶粒ζ-电位的绝对值越大,颗粒间的静电排斥作用越强,阻止粒子间相互聚集[21],有利于维持体系的稳定。
在pH 6.0~4.0范围内,当果胶质量浓度从0.4 g/100 mL增加到0.8 g/100 mL,与对照的ζ-电位绝对值线性减小相比,ζ-电位绝对值先略微增大后减小并始终大于对照组,果胶质量浓度对ζ-电位的绝对值没有影响,pH<4.0时,果胶质量浓度为0.4、0.6 g/100 mL和0.8 g/100 mL的ζ-电位绝对值显著变化点分别为pH 3.9、3.5和3.0,与粒径结果一致。实验结果表明酸化过程中果胶通过静电作用吸附在大豆蛋白表面,大豆蛋白颗粒表面的负电荷与体系中带有负电荷的阴离子多糖果胶间的静电排斥作用阻止聚合电解质的进一步吸附而使体系的ζ-电位绝对值减小[22]。果胶质量浓度越大,吸附量越大,大豆蛋白的ζ-电位越负,静电斥力越强,体系失稳的pH值点越低。因此酸性状态下果胶吸附层的静电斥力也是酸性豆乳体系稳定的因素之一。
2.4果胶质量浓度对大豆蛋白微观结构的影响

图5 果胶质量浓度对pH 4.2胶粒微观结构的影响(400×)Fig.5 Effect of pectin concentration on the microstructure of colloidal particles at pH 4.2 (400 ×)
由图5可知,对照组和添加0.2 g/100 mL果胶的体系中均有聚集颗粒,而且添加0.2 g/100 mL果胶的颗粒粒径明显大于对照组中大豆蛋白颗粒的粒径,可能由于大豆蛋白颗粒未被果胶全部覆盖,从而聚合物架桥连接两个或者多个大豆蛋白的“架桥絮凝”所致[23]。添加0.4 g/100 mL和0.6 g/100 mL果胶后则呈现均匀细小的分散颗粒,添加0.6 g/100 mL果胶大豆蛋白颗粒分散性优于添加0.4 g/100 mL果胶。因此,酸性状态大豆蛋白胶体颗粒的稳定性与果胶的质量浓度相关。
3 结 论
在大豆蛋白中加入0.4~0.8 g/100 mL的果胶,酸化过程中大豆蛋白的平均粒径在一定pH值内保持稳定,聚集点从pH 5.8降低到pH 3.9、3.5和3.0,果胶质量浓度越大,大豆蛋白的平均粒径越大,吸附层越厚,空间位阻作用越强,聚集点越低,酸性豆乳体系稳定的pH值越低。酸化过程中的大豆蛋白和果胶混合体系的ζ-电位绝对值始终大于大豆蛋白体系,ζ-电位绝对值在各个质量浓度的聚集点时减小速率加快,静电排斥作用减弱,体系失稳。高甲氧基果胶对大豆蛋白酸性状态的稳定性具有显著效果,可为酸性豆乳的生产提供理论依据。
参考文献:
[1]MALHOTRA A, COUPLAN J N. The effect of surfactants on the solubility, zeta potential, and viscosity of soy protein isolates[J]. Food Hydrocolloids, 2004, 18(1): 101-108.
[2]NISHNARI K, FANG Y, GUO S, et al. Soy proteins: a review on composition, aggregation and emulsification[J]. Food Hydrocolloids, 2014, 39: 301-318.
[3]CAMPBELL J L, GU X, DEWAR J S, et al. Effects of heat treatment and glucono-σ-lactone-induced acidification on characteristics of soy protein isolate[J]. Food Hydrocolloids, 2011, 44(9): 1952-1957.
[4]LAURENHT M A, BOULENGUER P. Stabilization mechanism of acid dairy drinks (ADD) induced by pectin[J]. Food Hydrocolloids, 2003, 17(4): 445-454.
[5]TROMP R H, de KRUIF C G, van EIJK M, et al. On the mechanism of stabilisation of acidified milk drinks by pectin[J]. Food Hydrocolloids, 2004, 18(4): 565-572.
[6]NAKAMURA A, YOSHIDA R, MAEDA H, et al. The stabilizing behaviour of soybean soluble polysaccharide and pectin in acidified milk beverages[J]. International Dairy Journal, 2006, 16(4): 361-369.
[7]JENSEN S, ROLIN C, IPSEN R. Stabilisation of acidified skimmed milk with HM pectin[J]. Food Hydrocolloids, 2010, 24(4): 291-299.
[8]LIU Jinru, NAKAMURA A, CORREDIG M. Addition of pectin and soy soluble polysaccharide affects the particle size distribution of casein suspensions prepared from acidified skim milk[J]. Journal of Agricultural and Food Chemistry, 2006, 54(17): 6241-6246.
[9]LAM M, SHEN R, PAULSEN P, et al. Pectin stabilization of soy protein isolates at low pH[J]. Food Research International, 2007, 40(1): 101-110.
[10]TUINIER R, ROLIN C, de KRUIF C G. Electrosorption of pectin onto casein micelles[J]. Biomacromolecules, 2002, 3(3): 632-638.
[11]YE Aiqian. Complexation between milk proteins and polysaccharides via electrostatic interaction: principles and applications: a review[J]. International Journal of Food Science & Technology, 2008, 43(3): 406-415.
[12]KAZMIERSKI M, WICKER L, CORREDIG M. Interactions of β-lactoglobulin and high-methoxyl pectins in acidified systems[J]. Journal of Food Science, 2003, 68(5): 1673-1679.
[13]BEDIE G K, TURGEON S L, MAKHLOUF J. Formation of native whey protein isolate-low methoxyl pectin complexes as a matrix for hydro-soluble food ingredient entrapment in acidic foods[J]. Food Hydrocolloids, 2008, 22(5): 836-844.
[14]LAM M, PAULSEN P, CORREDIG M. Interactions of soy protein fractions with high-methoxylpectin[J]. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4726-4735.
[15]JARAMILLO D P, ROBERTS R F, COUPLAND J N. Effect of pH on the properties of soy protein-pectin complexes[J]. Food Research International, 2011, 44(4): 911-916.
[16]MAROZIENE A, de KRUIF C G. Interaction of pectin and casein micelles[J]. Food Hydrocolloids, 2000, 14(4): 391-394.
[17]RINGGENBERG E, ALEXANDER M, CORREDIG M. Effect of concentration and incubation temperature on the acid induced aggregation of soymilk[J]. Food Hydrocolloids, 2013, 30(1): 463-469.
[18]ROESCH R, JUNEJA M, MONAGLE C, et al. Aggregation of soy/milk mixes during acidification[J]. Food Research International, 2004, 37(3): 209-215.
[19]PEREYRA R, SCHMIDT K A, WICKER L. Interaction and stabilization of acid casein dispersions with low and high methoxyl pectins[J]. Journal of Agricultural and Food Chemistry, 1997, 45: 3448-3451.
[20]WU Juan, LIU Junliang, DAI Qiaoyu, et al. The stabilisation of acidified whole milk drinks by carboxymethylcellulose[J]. International Dairy Journal, 2013, 28: 40-42.
[21]MORRISON I D, ROSS S. Colloidal dispersions: suspensions, emulsions, and foams[M]. New York: Wiley-Interscience, 2002: 333-354.
[22]DU Baiqiao, LI Jing, ZHANG Hongbin, et al. The stabilization mechanism of acidified milk drinks induced by carboxymethylcellulose[J]. Le Lait, 2007, 87(4/5): 287-300.
[23]SYRBE A, BAUER W J, KLOSTERMEYER H. Polymer science concepts in dairy systems: an overview of milk protein and food hydrocolloid interaction[J]. International Dairy Journal, 1998, 8(3): 179-193.
Mechanism of Stabilization of Acidic Soy Protein System by High Methoxyl Pectin
LI Xinxin1, LIU Zhisheng2, WU Juan2, LI Baoguo1,*, XIE Manman1
(1. School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Wilmar Global Research and Development Center, Shanghai 200137, China)
Abstract:The interactions of soy protein isolate with high methoxyl pectin (HMP) at various concentrations were studied over a pH range of 7.0–3.0 to understand the stabilization mechanism of acidic soymilk system. The particle diameter, ζ-potential and microstructure of the system during the acidification of soy protein in the presence of HMP demonstrated that the electrostatical adsorption of HMP could take place below pH 6.0 and prevent the formation of aggregates. The acidic soy protein system had flocculation and instability at 0.2 g/100 mL or less pectin concentration. It was stable within a certain pH range at 0.4 g/100 mL or more pectin concentration. More pectin could result in better stability. The stability of the colloid particles at acidic condition depended on both the electrostatical interaction of the protein with pectin and HMP concentration.
Key words:soy protein; pectin; pH; particle size; ζ-potential
doi:10.7506/spkx1002-6630-201507008
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2015)07-0041-04
*通信作者:李保国(1961—),男,教授,博士,研究方向为食品科学与工程。E-mail:lbaoguo@126.com
作者简介:李新新(1989—),女,硕士研究生,研究方向为多糖与大豆蛋白的结合。E-mail:lixinxin_19891110@163.com
基金项目:上海市教委科研创新项目(14ZZ133);上海市科促会联盟计划项目(LM201337);上海理工大学研究生创新基金项目
收稿日期:2014-06-15

