犬瘟热病毒囊膜糖蛋白在杆状病毒-昆虫细胞系统中的表达及鉴定
虞一聪,冯 娜,闫飞虎,盖微微,王铁成,王化磊,3,郑学星,3,赵永坤,3,黄 耕,杨松涛,高玉伟,夏咸柱,3,4*
(1.吉林农业大学动物科学技术学院,长春 130118;2.军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,长春 130122;3.中国农业科学院长春兽医研究所,长春 130122;4.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
犬瘟热病毒囊膜糖蛋白在杆状病毒-昆虫细胞系统中的表达及鉴定
虞一聪1,2,冯 娜2,3*,闫飞虎2,盖微微2,王铁成2,王化磊2,3,郑学星2,3,赵永坤2,3,黄 耕2,杨松涛2,高玉伟2,夏咸柱2,3,4*
(1.吉林农业大学动物科学技术学院,长春 130118;2.军事医学科学院军事兽医研究所,吉林省人兽共患病预防与控制重点实验室,长春 130122;3.中国农业科学院长春兽医研究所,长春 130122;4.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
为表达具有天然构象的犬瘟热病毒(CDV)囊膜糖蛋白融合蛋白(F)和血凝素蛋白(H),本研究扩增小熊猫源CDV驯化致弱株LP的F、H基因,克隆至pFastBacTM1载体中,测序验证后转化至DH10BacTM感受态细胞,同源重组获得穿梭质粒rBacmid-F、rBacmid-H,将其分别转染Sf9细胞获得重组杆状病毒rpFB-F、rpFB-H,并将表达的重组融合蛋白(rF)和血凝素蛋白(rH)进行IFA和Western blot鉴定。以犬抗CDV高免血清对重组杆状病毒感染细胞进行IFA鉴定,在感染细胞的细胞膜上可见特异性荧光反应;以鼠抗F、H蛋白的主要抗原表位区多克隆抗体对重组杆状病毒感染细胞进行Western blot检测,可见相对分子质量为63和68 ku左右的条带,分别为重组融合蛋白(rF)和血凝素蛋白(rH),大小与预期相符。两种囊膜糖蛋白在杆状病毒-昆虫细胞系统中均成功表达,且具有良好的反应原性。本研究为CDV病毒样颗粒疫苗的开发等工作奠定了基础。
犬瘟热病毒;融合蛋白;血凝素蛋白;杆状病毒-昆虫细胞系统
犬瘟热(canine distemper,CD)是由副黏病毒科麻疹病毒属的犬瘟热病毒(canine distemper virus,CDV)引起犬科动物的一种高度传染性、致死性疾病,全世界广泛分布[1]。该病的传染性强,发病率高,临床症状多样,容易继发混合感染和二次感染[2]。近年来,CDV自然感染宿主不断扩大,除犬科动物外,还可感染大熊猫、小熊猫和虎等珍稀野生动物[3-5],且已扩大到非人灵长类动物[6],严重危害我国乃至世界养犬业、经济动物养殖业和野生动物保护业。目前对 CD 尚无特效的治疗药物和方法,疫苗接种是唯一有效的防制措施[7]。
CDV为单股、负链、不分节段的RNA病毒。其主要结构蛋白有核衣壳蛋白(N)、磷蛋白(P)、大蛋白(L)、基质膜蛋白(M)、融合蛋白(F)、附着或血凝素蛋白(H)。负链RNA基因组被螺旋形衣壳包裹,形成核衣壳结构,外面由双层囊膜包裹。CDV囊膜上有1.3 nm的杆状纤突,纤突由两种囊膜糖蛋白F和H蛋白组成,纤突只含血凝素,而无神经氨酸酶[8]。融合蛋白(F)和血凝素蛋白(H)是病毒的主要结构蛋白,在病毒侵入宿主细胞的过程中共同介导细胞膜发生融合,同时也是诱导中和抗体的主要免疫原[9]。H蛋白使病毒趋向并接近敏感细胞,F蛋白是病毒和宿主细胞融合过程中所必需的,在病毒感染过程中,H和F蛋白两者缺一不可。具有中和活性的抗H蛋白抗体和抑制细胞融合的抗F抗体,在抗犬瘟热病毒的感染机制中也发挥了重要的作用[10]。本研究以实验室驯化致弱的小熊猫源CDV LP毒株为模板扩增F、H基因,并将目的基因克隆到表达载体pFastBacTM1,利用杆状病毒-昆虫细胞表达系统进行表达,并以犬抗CDV高免血清及鼠抗CDV F、H蛋白多克隆抗体对重组病毒蛋白质进行反应原性鉴定,为后期亚单位疫苗尤其是病毒样颗粒疫苗的开发奠定了基础。
1 材料与方法
1.1 材料
杆状病毒表达系统(Bac-to-Bac®Baculovirus Expression System)、Lipofectamine®2000转染试剂和Sf9细胞购自Invitrogen 公司;ExTaqDNA聚合酶、T4DNA连接酶、限制性内切酶购自大连宝生物技术公司;质粒快速提取试剂盒、DNA胶回收纯化试剂盒购自OMEGA biotek公司;基因组DNA提取试剂盒购自Axygen公司;Grace’s昆虫培养基购自AppliChem 公司;BacPAKTMBaculovirus Rapid Titer Kit试剂盒购自Clontech公司;His标签镍离子蛋白纯化柱(HisPurTMNi-NTA Spin Columns)和SuperSignal West Dura持久性化学发光底物购自Thermo scientific公司;荧光素(FITC)标记羊抗犬IgG 购自Sigma-Aldrich公司;辣根过氧化物酶(HRP)标记兔抗鼠IgG购自Bioworld公司。
CDV LP驯化致弱毒株F、H基因cDNA克隆质粒pMD18-T-CDV-F、pMD18-T-CDV-H、感受态细胞E.coliDH5α、BL21(DE3)、犬抗CDV高免血清均由军事医学科学院军事兽医研究所动物病毒学与特种动物疫病学实验室保存;6周龄BALB/c小鼠购自长春生物制品研究所实验动物中心。
1.2 目的基因的扩增及纯化
以pMD18-T-CDV-F和pMD18-T-CDV-H为模板,PCR扩增F、H基因(CDV F For:5′-CGAGGATCCATGCACAACAAAATCCCCAAAATAT-CC-3′,CDV F Rev:5′-ATAGCGGCCGCTCAGA-GTGATCTTACATAGG-3′;CDV H For:5′-CGA-GGATCCATGCTCTCCTACCAAGA-3′,CDV H Rev:5′-ATAGCGGCCGCTCAAGGTTTTGAACGG-3′;下划线部分为BamHⅠ、NotⅠ酶切位点)。反应体系:ExTaqDNA聚合酶(5 U·μL-1)0.5 μL,反转录产物cDNA 8 μL,上、下游引物(20 μmol·L-1)各1 μL,dNTP(2.5 mmol·L-1)4 μL,10× ExTaqBuffer 5 μL,加ddH2O补足至总体积50 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共33个循环;72 ℃延伸10 min。扩增的目的片段胶回收纯化后4 ℃保存。
1.3 重组供体质粒的构建
将目的片段和pFastBacTM1载体均分别用BamHⅠ、NotⅠ进行双酶切,37 ℃作用2 h,酶切片段和载体纯化后在T4DNA连接酶作用下于16 ℃连接过夜。连接体系(20 μL):载体4 μL,目的片段10 μL,10×缓冲液2 μL,T4DNA连接酶2 μL,用ddH2O补足至总体积20 μL。连接产物转化至感受态细胞E.coliDH5α。提取阳性重组质粒pFastBacTM1-F和pFastBacTM1-H,经PCR及双酶切鉴定正确后送至长春库美生物公司测序。
1.4 重组穿梭质粒的构建
参考Invitrogen公司Bac-to-Bac®Baculovirus Expression System操作手册,分别将测序正确的重组质粒pFastBacTM1-F和pFastBacTM1-H转化至含杆状病毒穿梭载体的感受态细胞DH10BacTM,37 ℃培养48 h,通过蓝白斑筛选,挑取白色阳性菌落,抽提纯化重组杆状病毒质粒,并用M13通用引物和CDV FF/CDV FR、CDV HF/CDV HR同时进行PCR鉴定,将鉴定为阳性的质粒分别命名为rBacmid-F和rBacmid-H。
1.5 重组杆状病毒的制备
利用脂质体Lipofectamine®2000将rBacmid-F和rBacmid-H转染Sf9细胞,于27 ℃培养96 h,待细胞出现病变后,收集细胞上清获得重组杆状病毒。基因组DNA提取试剂盒抽提病毒基因组DNA,分别用M13通用引物和特异性引物PCR验证CDVF和H基因在纯化病毒中是否获得稳定重组,重组病毒分别命名为rpFB-F和rpFB-H。扩增种毒至第3代,并按BacPAKTMBaculovirus Rapid Titer Kit试剂盒对种毒进行滴定,于4 ℃保存备用。
1.6 间接免疫荧光
将上述rpFB-F和rpFB-H种毒液按1∶20体积比感染Sf9细胞,并以野生型杆状病毒作为对照,于27 ℃培养48 h,弃细胞上清液,用PBS洗涤后用3%多聚甲醛室温固定30 min。以1∶100倍稀释的犬高免血清和犬阴性血清为一抗,室温孵育1 h。PBST洗涤后加入1∶200倍稀释的荧光素(FITC)标记的羊抗犬二抗,室温避光作用1 h,PBST洗涤后荧光显微镜(Olympus Corp,Tokyo,Japan)观察结果。
1.7 F和H蛋白主要抗原表位区多克隆抗体的制备
1.7.1 F和H片段的原核表达 应用在线生物分析软件BepiPred分析CDV LP弱毒株F、H蛋白的氨基酸序列,预测F、H基因的主要抗原表位区片段,去除跨膜区和信号肽序列,结合pET-30a(+)表达载体,利用Primer Premier 5.0软件,分别设计合成CDV-F-pET30-F 5′-GAATTCCAATCCAACCTCAATGC-3′(下划线部分为EcoRⅠ酶切位点)和CDV-F-pET30-R 5′-CTCGAGCCTAACCGT-CTCAAGG-3′(下划线部分为XhoⅠ酶切位点)为引物PCR扩增F基因1 050 bp片段(第751—1 800 bp);分别设计合成CDV-H-pET30-F 5′-GATATCATCTCAGACGGAGTGTAT-3′(下划线部分为EcoRⅤ酶切位点)和CDV-H-pET30-R 5′-CTCGAGGGTTGTAAAGTTGGTGATGT-3′(下划线部分为XhoⅠ酶切位点)为引物PCR扩增H基因1 104 bp片段(第667—1 770 bp)。分别以pMD18-T-CDV-F和pMD18-T-CDV-H为模板PCR扩增F、H蛋白胞外主要抗原表位区(体系同1.2),克隆至pET-30a(+)表达载体,构建成与His标签融合表达的重组质粒pET-30a(+)-Fec、pET-30a(+)-Hec,转化BL21(DE3)表达菌株后,经IPTG诱导融合蛋白质表达。表达的目的蛋白质经His标签镍离子蛋白质纯化柱(HisPurTMNi-NTA Spin Columns)纯化后,进行SDS-PAGE分析。
1.7.2 重组抗原免疫血清的制备 将纯化的重组F、H蛋白与弗氏完全佐剂等体积乳化,肌肉注射免疫6周龄BALB/c小鼠,50 μg·只-1。2周后将重组蛋白质与弗氏不完全佐剂等体积乳化进行第2和第3次免疫,间隔2周。三免后2周眼球采血,分离血清。
1.8 Western blot
参照文献方法进行[11]。将上述rpFB-F和rpFB-H种毒液按1∶10体积比感染正常Sf9细胞,72 h后3 000 r·min-1离心10 min收获感染细胞,PBS离心洗涤,按原培养液10%体积加入PBS悬起细胞,反复冻融3次,离心后收获上清,制备成细胞裂解抗原液进行SDS-PAGE电泳,并电转印至PVDF膜,封闭液室温封闭2 h;分别以鼠抗CDV F、H蛋白主要抗原表位区多克隆抗体(1∶100倍稀释)为一抗,4 ℃孵育过夜;以辣根过氧化物酶(HRP)标记兔抗鼠IgG(1∶2 000倍稀释)为二抗,室温孵育1 h,加入SuperSignal West Dura持久性化学发光底物进行检测。
2 结 果
2.1 含目的基因的重组Bacmid的筛选与鉴定
首先将CDV F和H基因亚克隆至pFastBacTM1,将鉴定正确的穿梭质粒pFastBacTM1-F和pFastBacTM1-H转化至DH10BacTM感受态细胞后,经含卡那霉素、四环素和庆大霉素的平板筛选,抽提质粒分别进行PCR鉴定,以M13F/M13R为引物PCR扩增出长度约为4 289 bp和4 124 bp的特异产物,以CDV FF/CDV FR和CDV HF/CDV HR为引物获得约为1 989 bp和1 824 bp的特异产物,与理论值相符(图1),表明重组杆状病毒表达质粒rBacmid-F和rBacmid-H构建成功。
2.2 重组杆状病毒的制备
将rBacmid-F和rBacmid-H分别转染对数生长期的Sf9细胞,27 ℃连续培养96 h,收获P1代重组杆状病毒,然后将重组杆状病毒连续传3代,感染Sf9细胞48 h后均可见细胞变大、变圆,细胞间隙增大,停止生长,由贴壁变为脱落漂浮,感染末期细胞溶解破裂等典型致细胞病变效应。将扩增的第三代种毒rpFB-F P3用BacPAKTMBaculovirus Rapid Titer Kit试剂盒对种毒进行滴定,镜下可见散在的染色斑点,结果显示,rpFB-F滴度为8.0×107IFU·mL-1(图2),应用同样的方法测得rpFB-H P3滴度为8.4×107IFU·mL-1。

M1.DNA相对分子质量标准;M2.DNA相对分子质量标准;1.M13引物鉴定重组质粒rBacmid-H;2.特异性引物鉴定重组质粒rBacmid-H;3.M13引物鉴定Bacmid阴性对照;4.M13引物鉴定重组质粒rBacmid-F;5.特异性引物鉴定重组质粒rBacmid-FM1.λ-EcoT14 I digest DNA marker;M2.DL2000 DNA marker;1.PCR products from rBacmid-H with M13F/M13R;2.PCR products from rBacmid-H with CDV HF/HR;3.PCR products from Bacmid with M13F/F13R;4.PCR products from rBacmid-F with M13F/M13R;5.PCR products from rBacmid-F with CDV FF/FR图1 重组质粒rBacmid-F和rBacmid-H的鉴定Fig.1 Identification of rBacmid-F and rBacmid-H
2.3 重组杆状病毒 IFA 鉴定
分别以rpFB-F和rpFB-H感染Sf9细胞48 h,弃细胞上清液,用3%多聚甲醛室温固定30 min以犬抗CDV高免血清为一抗及FITC标记羊抗犬IgG为二抗进行免疫荧光染色。荧光显微镜观察可见rpFB-F和rpFB-H感染Sf9细胞膜均显示较强的阳性荧光信号(图3A和3B),而野生型杆状病毒感染Sf9细胞(图3C)和未感染病毒细胞的荧光信号均呈阴性(图3D)。结果表明重组杆状病毒能在昆虫细胞中高效表达CDV囊膜糖蛋白,且能够被犬抗CDV高免血清特异性识别。
2.4 F和H蛋白主要抗原表位区的原核表达及多克隆抗体的制备
将pET-30a(+)-Fec、pET-30a(+)-Hec分别转化至E.coliBL21(DE3),经IPTG诱导后以镍离子蛋白质纯化柱对目的蛋白质进行纯化,SDS-PAGE可见单一的大小约为40和46 ku的目的片段(图4)。将纯化的重组F、H蛋白与弗氏佐剂乳化后,肌肉注射连续免疫3次,每次间隔2周,制备鼠多克隆抗体。
2.5 重组CDV F和H蛋白Western blot检测
Western blot检测杆状病毒表达的重组融合蛋白(rF)和血凝素蛋白(rH)与鼠抗主要抗原表位区多克隆抗体的反应性,结果显示分别在63和68 ku左右处有清晰的特异的反应条带,大小与预期值相符(图5),表明获得的两种重组蛋白质具有良好的反应原性。

A.重组杆状病毒103稀释;B.重组杆状病毒104稀释;C.重组杆状病毒105稀释;D.阴性对照A.Dilutions of 103 of recombinant baculovirus;B.Dilutions of 104 of recombinant baculovirus;C.Dilutions of 105 of recombinant baculovirus;D.Negative control图2 重组杆状病毒rpFB-F滴定Fig.2 Titration of recombinant baculovirus rpFB-F

A.重组杆状病毒rpFB-F感染的Sf9细胞;B.重组杆状病毒rpFB-H感染的Sf9细胞;C.野生型杆状病毒感染的Sf9细胞;D.正常Sf9细胞对照A.Sf9 cells infected with rpFB-F;B.Sf9 cells infected with rpFB-H;C.Sf9 cells infected with wild baculovirus;D.Normal Sf9 cells as control group图3 IFA检测重组蛋白质rF和 rH的表达Fig.3 Identification of expressed rF and rH by IFA
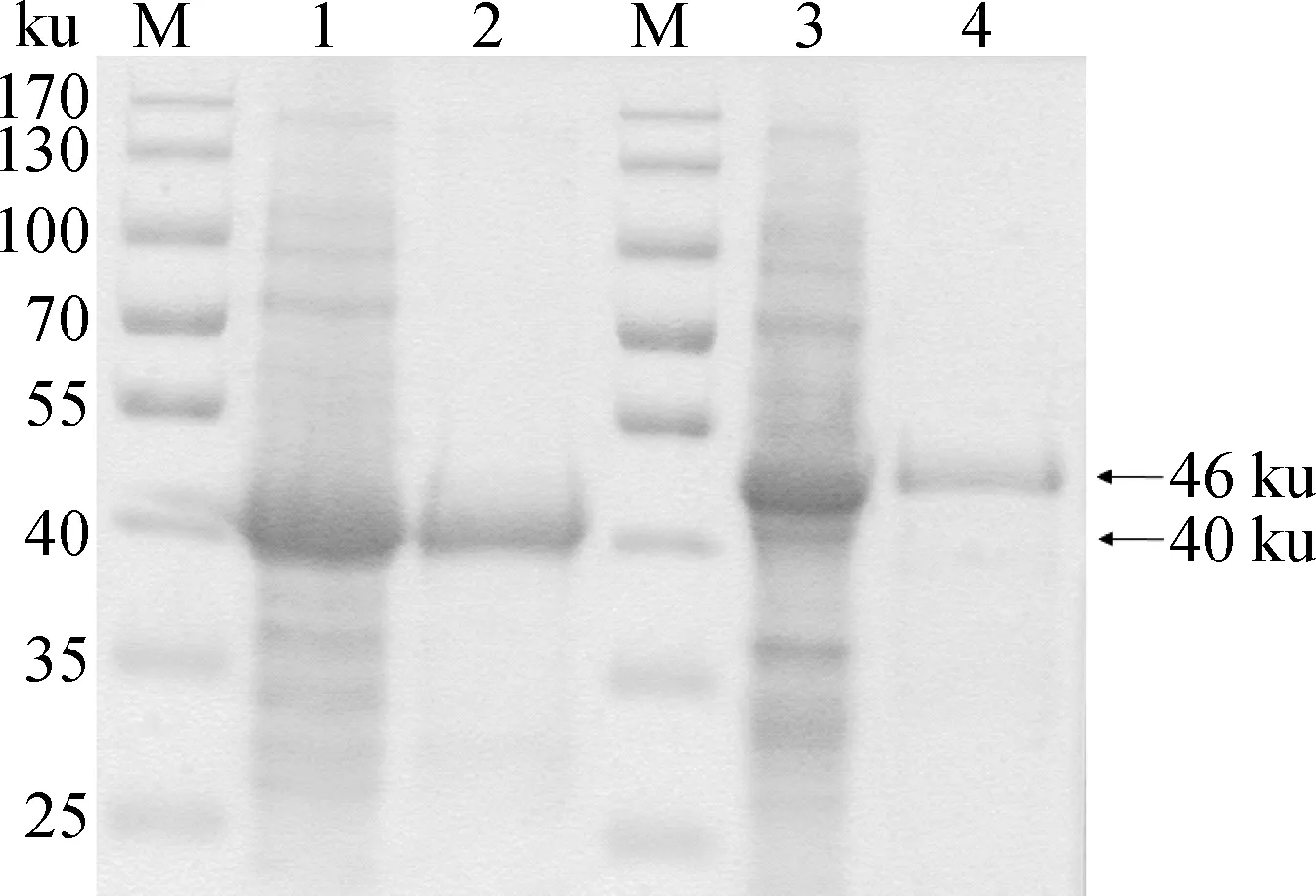
M.蛋白质相对分子质量标准;1.未纯化F蛋白SDS-PAGE检测;2.纯化F蛋白SDS-PAGE检测;3.未纯化H蛋白SDS-PAGE检测;4.纯化H蛋白SDS-PAGE检测M.Protein molecular weight marker;1.Detection of unpurified F protein by SDS-PAGE;2.Detection of purified F protein by SDS-PAGE;3.Detection of unpurified H protein by SDS-PAGE;4.Detection of purified H protein by SDS-PAGE图4 原核表达F、H蛋白的SDS-PAGE检测Fig.4 Detection of prokaryotic expressed F and H protein by SDS-PAGE

M.蛋白质相对分子质量标准;1.野生型杆状病毒感染的Sf9细胞;2.重组杆状病毒rpFB-F感染的Sf9细胞;3.野生型杆状病毒感染的Sf9细胞;4.重组杆状病毒rpFB-H感染的Sf9细胞M.Protein molecular weight marker;1.Sf9 cells infected with wild baculovirus;2.Sf9 cells infected with rpFB-F;3.Sf9 cells infected with wild baculovirus;4.Sf9 cells infected with rpFB-H图5 重组蛋白质rF和rH的Western blot检测Fig.5 Detection of rF and rH by Western blot
3 讨 论
犬瘟热呈世界性分布,拥有广泛的哺乳动物宿主[12-13]。疫苗免疫在20世纪20年代已有研究和使用,灭活疫苗因诱导产生的抗体下降快,抗原性差且仅能诱导体液免疫,免疫时间短等缺点,现已很少使用[14]。国内外对犬瘟热的预防仍然主要依赖于弱毒疫苗,由于不同动物对CDV 的敏感性存在差异,弱毒苗对野生食肉动物和某些免疫缺陷幼犬的毒力过强、安全性差[15-16],且在使用过程中存在热稳定差、易受母源抗体干扰等缺陷[17]。因此,亟需更安全有效的新型疫苗防控犬瘟热的流行,其中基因工程疫苗是研究开发的主要方向。
研究表明囊膜糖蛋白(F、H)是产生CDV中和抗体的主要保护性抗原,是基因工程亚单位疫苗主要候选抗原。犬瘟热病毒对理化因素极为敏感,难以通过常规纯化病毒的方法获得主要保护性抗原,因此基因工程表达成了制备亚单位疫苗的有效技术手段。当前国内外关于犬瘟热结构蛋白基因的表达,多是利用原核表达系统表达截短蛋白序列,很少有全长序列的报道,且表达产物易受空间构象影响。杆状病毒-昆虫细胞表达系统是一个以昆虫杆状病毒为外源基因载体,以昆虫细胞或昆虫为受体的表达系统,由于其操作简便、生产周期短,对人及其他哺乳动物无危害,表达产物可被正确地加工修饰,形成天然构象,具有完整的生物学功能,已被公认为是当今基因工程四大表达系统之一[18-21]。目前,已有多种利用该系统表达制备的亚单位疫苗通过批准上市[22-23]。
国内很多研究者都尝试利用杆状病毒表达麻疹病毒属成员囊膜糖蛋白。全传松等[24]、隋修锟等[25]分别利用杆状病毒表达系统在昆虫细胞中成功表达了CDV 和小反刍兽疫病毒(peste des petits ruminants virus,PPRV)H蛋白。目前尚未有CDV F蛋白在昆虫细胞成功表达的报道。冯佩平[26]分别构建了表达犬瘟热病毒主要结构蛋白N、F和H的重组杆状病毒,通过Western blot、间接免疫荧光证明N蛋白和H蛋白获得了成功表达,然而F基因仅在表达后的细胞液中测得,Western blot并没有如期检测到F蛋白。同样,有研究认为PPRV F蛋白在昆虫细胞中可以获得转录却无法翻译,分析称密码子偏嗜性也许是影响多肽翻译的因素之一[27]。病毒样颗粒(virus-like particles,VLPs)疫苗作为新型的亚单位疫苗既能激发体液免疫,又能激发细胞和黏膜免疫;且不含病毒核酸,不能复制,具有安全、高效的特点,是很有发展前景的候选疫苗。对同属的PPRV病毒样颗粒疫苗的研究表明,共表达基质蛋白M与表面糖蛋白(F、H)所形成VLPs的大小与真实病毒粒子相似,同时又具有足够的保护性抗原[28]。由此可见,重组杆状病毒表达犬瘟热病毒囊膜糖蛋白是制备犬瘟热病毒样颗粒疫苗的必要前提。
4 结 论
成功构建表达CDV 囊膜糖蛋白F、H的重组杆状病毒,IFA和Western bolt检测结果表明F和H蛋白分别在感染昆虫细胞中得到成功表达,并且与犬抗CDV高免血清及鼠抗F、H蛋白主要抗原表位区的多克隆抗体均具有良好的反应原性,这为后期利用重组杆状病毒包装犬瘟热病毒样颗粒,开发安全、有效的亚单位疫苗尤其是病毒样颗粒疫苗奠定了物质基础。
[1] WANG F,YAN X,CHAI X,et al.Differentiation of canine distemper virus isolates in fur animals from various vaccine strains by reverse transcription-polymerase chain reaction-restriction fragment length polymorphism according to phylogenetic relations in China[J].VirolJ,2011,8:85.
[2] 蔡宝祥.家畜传染病学 [M].2版.北京:中国农业出版社,1999:301-304. CAI B X.Livestock infectious disease [M].2ed edition.Beijing:China Agriculture Press,1999:301-304.(in Chinese)
[3] APPEL M J G,MONTALI R J.Canine distemper and emerging morbillivirus diseases in exotic species[C].ProcAmAssocZooVet,1994:336-339.
[4] 李金中,夏咸柱,邱 薇,等.小熊猫等四种动物犬瘟热病毒的分离与鉴定[J].中国兽医科技,1998,28(8):8-10. LI J Z,XIA X Z,QIU W,et al.Isolation and identification of canine distemper virus from lesser panda,dog,raccoon dog and fox[J].ChineseJournalofVeterinaryScienceandTechnology,1998,28(8):8-10.(in Chinese)
[5] 胡桂学,夏咸柱,李金中.大熊猫犬瘟热致死性感染的首次报告[C].中国微生物学会兽医微生物学学术年会论文集.北京,1997,1(997):1. HU G X,XIA X Z,LI J Z.The first report of giant panda infected with lethal canine distemper[C].Chinese Society for Microbiology Veterinary Microbiology Academic Conference.Beijing,1997,1(997):1.(in Chinese)
[6] QIU W,ZHENG Y,ZHANG S,et al.Canine distemper outbreak in rhesus monkeys,China[J].EmergInfectDis,2011,17(8):1541-1543.
[7] NORRIS J M,KROCKENBERGER M B,BAIRD A A,et al.Canine distemper:re-emergence of an old enemy[J].AustVetJ,2006,84(10):362-363.
[8] 殷 震,刘景华.动物病毒学 [M].2版.北京:科学出版社,1997:756-762. YIN Z,LIU J H.Animal virology[M].2ed edition.Beijing:Science Press,1997:756-762.(in Chinese)
[9] VON MESSLING V,ZIMMER G,HERRLER G,et al.The hemagglutinin of canine distemper virus determines tropism and cytopathogenicity[J].JVirol,2001,75(14):6418-6427.
[10] 潘耀谦.犬瘟热发病机理的免疫及分子病理学研究——脑组织及淋巴器官病变观察[D].北京:中国农业大学,2005. PAN Y Q.Studies of pathogenesis of immune and molecular pathology on dogs with canine distemper—pathologic observation in brain tissues and lymphatic tissues[D].Beijing:China Agricultural University,2005.(in Chinese)
[11] 萨姆布鲁克 J,弗里奇 E F,曼尼阿蒂斯 T.分子克隆实验指南[M].2版.北京:科学出版社,1993:674-683. SAMBMOK J,FRITSEH E F,MANIATIS T.Molecular cloning a laboratory manual[M].2ed edition.Beijing:Science Press,1993:674-683.(in Chinese)
[12] DEEM S L,SPELMAN L H,YATES R A,et al.Canine distemper in terrestrial carnivores:a review[J].JZooWildlMed,2000,31(4):441-451.
[13] MARTELLA V,ELIA G,BUONAVOGLIA C.Canine distemper virus[J].VetClinNorthAmSmallAnimPract,2008,38(4):787-797.
[14] 孔庆波.犬瘟热免疫预防研究进展[J].动物医学进展,2007,28(6):69-75. KONG Q B.Progress on immune prevention of canine distemper[J].ProgressinVeterinaryMedicine,2007,28(6):69-75.(in Chinese)
[15] BARRETT T.Morbillivirus infections,with special emphasis on morbilliviruses of carnivores[J].VetMicrobiol,1999,69(1-2):3-13.
[16] 王 磊,李天松,刘玉秀,等.犬瘟热新型疫苗研究进展[J].动物医学进展,2011,32(3):99-103. WANG L,LI T S,LIU Y X,et al.Progress on new type vaccines of canine distemper[J].ProgressinVeterinaryMedicine,2011,32(3):99-103.(in Chinese)
[17] WELTER J,TAYLOR J,TARTAGLIA J,et al.Vaccination against canine distemper virus infection in infant ferrets with and without maternal antibody protection,using recombinant attenuated poxvirus vaccines[J].JVirol,2000,74(14):6358-6367.
[18] 高炳淼,李宝珠,于津鹏,等.外源基因在昆虫杆状病毒表达系统中的表达[J].中国生物工程杂志,2011,31(11):123-129. GAO B M,LI B Z,YU J P,et al.Expression of foreign genes in insect baculovirus expression systems[J].ChinaBiotechnology,2011,31(11):123-129.(in Chinese)
[19] AILOR E,BETENBAUGH M J.Modifying secretion and post-translational processing in insect cells[J].CurrOpinBiotechnol,1999,10(2):142-145.
[21] SANDOVAL C,CURTIS H,CONGOTE L F.Enhanced proliferative effects of a baculovirus-produced fusion protein of insulin-like growth factor and α1-proteinase inhibitor and improved anti-elastase activity of the inhibitor with glutamate at position 351[J].ProteinEng,2002,15(5):413-418.
[22] FRAZER I H.Cervical cancer vaccine development[J].SexHealth,2010,7(3):230-234.
[23] MENA J A,KAMEN A A.Insect cell technology is a versatile and robust vaccine manufacturing platform[J].ExpertRevVaccines,2011,10(7):1063-1081.
[24] 全传松,姜 骞,于 作,等.犬瘟热病毒血凝蛋白在昆虫细胞中的表达与抗原性分析[J].中国畜牧兽医,2014,41(8):25-29. QUAN C S,JIANG Q,YU Z,et al.Expression of hemagglutinin of canine distemper virus in the insect cell and its antigenic analysis[J].ChinaAnimalHusbandry&VeterinaryMedicine,2014,41(8):25-29.(in Chinese)
[25] 隋修锟,金红岩,李文超,等.小反刍兽疫病毒H基因在杆状病毒中的表达及其免疫原性研究[J].畜牧兽医学报,2014,45(6):974-980. SUI X K,JIN H Y,LI W C,et al.Expression ofHgene of Peste des Petits Ruminants virus in baculovirus and its immunogenicity study[J].ActaVeterinariaetZootechnicaSinica,2014,45(6):974-980.(in Chinese)
[26] 冯佩平.犬瘟热病毒主要结构蛋白基因在昆虫细胞中的表达及间接 ELISA 检测方法的建立[D].长春:吉林农业大学,2012. FENG P P.Expression of CDV major structural protein in Sf9 cells and establishment of indirect ELISA assay[D].Changchun:Jilin Agricultural University,2012.(in Chinese)
[27] 刘拂晓.小反刍兽疫病毒样颗粒的构建及对小鼠免疫效力的评价[D].长春:吉林大学,2013. LIU F X.Construction of Peste des Petits Ruminants virus-like particles and evaluation of their immune effects in mice[D].Changchun:Jilin University,2013.(in Chinese)
[28] LI W,JIN H,SUI X,et al.Self-assembly and release of peste des petits ruminants virus-like particles in an insect cell-baculovirus system and their immunogenicity in mice and goats[J].PLoSOne,2014,9(8):e104791.
(编辑 白永平)
Expression and Identification of Glycoprotein of Canine Distemper Virus in the Baculovirus-Insect Cell System
YU Yi-cong1,2,FENG Na2,3*,YAN Fei-hu2,GAI Wei-wei2,WANG Tie-cheng2,WANG Hua-lei2,3,ZHENG Xue-xing2,3,ZHAO Yong-kun2,3,HUANG Geng2,YANG Song-tao2,GAO Yu-wei2,XIA Xian-zhu2,3,4*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun130118,China;2.KeyLaboratoryofZoonosisPreventionandControlofJilinProvince,MilitaryVeterinaryInstituteoftheAcademyofMilitaryMedicalSciences,Changchun130122,China;3.ChangchunVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Changchun130122,China; 4.JiangsuCo-innovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonosis,Yangzhou225009,China)
The objectives of this study were to express the native structure of fusion protein (F) and hemagglutinin glycoprotein (H) of canine distemper virus (CDV).TheFandHgene of lesser panda attenuated strain were amplified by PCR and cloned into pFastBacTM1 vector.The recombinant plasmids were sequenced,and then were transformed into competent DH10BacTME.colicells to construct shuttle plasmids,rBacmid F and rBacmid H,by homologous recombination.The recombinant plasmids were then transfected into Sf9 cells to construct recombinant baculoviruses and the expression products of rF and rH were identified with IFA and Western blot.The expression of rF and rH in insect cells infected with recombinant baculoviruses were identified by IFA with dog anti-CDV hyperimmune serum and were detected by Western blot with mouse polyclonal antibody against F and H major epitopes of CDV.The molecular weight of expressed F and H protein were identified as 63 and 68 kD,which were consistent with the expected value.The results show that both envelope glycoproteins are successfully expressed in baculovirus-insect cell expression system and have a good immunoreactivity.Our study laid the foundation for the development of the CDV virus-like particle vaccine.
canine distemper virus;fusion protein;attachment glycoprotein;baculovirus-insect cell system
10.11843/j.issn.0366-6964.2015.06.014
2014-09-28
国家公益性行业(农业)科研专项(201303042)
虞一聪(1989-),男,浙江慈溪人,硕士生,主要从事动物分子病毒学研究,E-mail:jordanyuyicong@163.com
*通信作者:夏咸柱,E-mail:xiaxzh@cae.cn;冯 娜,E-mail:fengna0308@126.com
S852.659.5
A
0366-6964(2015)06-0981-08

