SLP—2基因在乳腺癌细胞系中的表达及对MCF—7细胞增殖的影响
谢贵娥等

摘 要 人的SLP-2基因在乳腺癌组织的高表达与病人的存活率相关.为了研究SLP-2在乳腺癌中的功能,应用免疫印记的方法检测SLP-2在不同乳腺癌细胞中的蛋白表达水平,发现随着细胞癌化程度的增强其表达也增强. 成功构建pCMV-Myc-SLP-2重组质粒,证明了其在MCF-7细胞的表达,MTT实验结果表明SiRNA转染乳腺癌细胞MCF-7可以抑制细胞增殖,同时发现SLP-2在乳腺癌细胞系中表达量与HER2/nue呈负相关.这些结果为深入研究乳腺癌的发生和发展奠定了基础.
关键词 乳腺癌;SLP-2;免疫印记;细胞增殖
中图分类号 Q78 文献标识码 A 文章编号 1000-2537(2014)06-0019-05
Abstract High-level Human stomatin like protein 2 (SLP-2) expression was associated with significantly decreased survival in breast cancer. To study the function of SLP-2 in breast cancer furtherly, the expression of SLP-2 protein was detected in different breast cancer cells by western blotting, and the expression of its protein in breast cancer cells was found to increase with the increase of the degree of cancer. Recombinant plasmid pCMV-Myc-SLP-2 was successfully constructed and demonstrated that it can express well in MCF-7. The MTT assay showed that the cell proliferation was significantly inhibited after transfection of pCMV-Myc-SLP-2, the expression of SLP-2 was negatively correlated with HER2/nue in MCF-7, thus providing a useful clue to further research on the occurring and development of breast cancer.
Key words breast cancer; SLP-2; western blotting; cell proliferation
乳腺癌是严重威胁妇女身体健康的常见恶性肿瘤之一,其发生的分子机制尚不明确[1-2].人的Stomatin like protein 2(SLP-2)基因由Wang首先从人心脏cDNA文库中克隆,由10个外显子和9个内含子组成,编码约1.5 kb的mRNA形成含有356个氨基酸的多肽[3].该蛋白在人体组织中都有表达,其中在心脏和骨骼肌中表达较高.研究表明SLP-2在多种恶性肿瘤组织中表达较高,如上皮性卵巢癌组织和食管鳞状细胞癌组织,且有研究报道,SLP-2基因与子宫内膜腺癌细胞生长相关[4-6].有研究表明在乳腺癌组织中,病人的存活率与SLP-2的高表达负相关,因此在乳腺癌的发生中SLP-2基因很可能发挥着重要作用[2,7] .在本研究中,作者通过Western blotting分析SLP-2基因在乳腺癌细胞系中的表达水平,发现癌化程度越高的细胞中SLP-2表达越高,并运用脂质体介导法将外源SLP-2基因转染入人乳腺癌MCF-7细胞系中,使之得到稳定表达,以探讨SLP-2基因在乳腺癌细胞增殖中的作用.这些实验结果为从乳腺癌细胞增殖周期入手来探讨乳腺癌治疗新途径打下了实验基础.
1 材料与方法
1.1 材料
大肠杆菌DH5α,细胞株MCF-7、MDA-MB-231、MDA-MB-453均为本实验室保存, pCMV-Myc(载体)为Clontech公司产品;pMD18-T(vector)购自Takara公司;反转录试剂盒及EX TaqDNA聚合酶购自Qiagen公司;各种限制性内切酶以及T4DNA连接酶等购自New England Biolabs公司; LipofectamineTM 2000转染试剂盒和DMEM 培养基购自Invitrogen 公司;胎牛血清购于杭州四季青公司;Myc单抗和碘化丙啶(propidium iodine, PI) 为Sigma 产品;SLP-2多抗购自Proteintech Group公司;anti-Myc单抗购自Sigma 公司;GAPDH的单抗购自Santa Cruz公司;actin的单抗购自Boster生物公司.
1.2 方法
1.2.1 目的基因的扩增以及重组载体的构建 根据GenBank中小鼠SLP-2基因序列设计特异性引物, 其反向引物为5′GGTACCGTCCCCAGACTCCCTGGCC 3′正向引物为5′-GGAATTCATGGGAAATGCTGGCGCG-3′,(引物中划线部分的碱基序列分别为Kpn I和EcoR I的酶切位点).以人脑cDNA 文库为模板,进行常规PCR, PCR扩增的反应条件为:94 ℃×5 min; 94 ℃×30 s,60 ℃×30 s, 72 ℃×1 min, 30个循环,72 ℃×10 min结束扩增.1.2%琼脂糖凝胶电泳鉴定并分离纯化PCR 产物, 然后先直接连接到pMD18-T载体上,再用Kpn I和EcoR I双酶切消化、分离、纯化,将纯化得到的SLP-2目的片段与真核表达载体pCMV-Myc连接.酶切验证, 选择鉴定正确的质粒送上海生工公司测序,确认序列的正确性.
1.2.2 细胞培养 在37 ℃及5%CO2条件下置于培养箱中用DMEM 完全培养基(补加10%新生牛血清、100 mg/L青霉素、100 mg/L链霉素和2 mol/L谷氨酰胺)培养MCF-7、MDA-MB-231、MDA-MB-453细胞.
1.2.3 细胞转染和Western-blot检测 用购自Invitrogen公司的LipofectamineTM 2000转染试剂将pCMV-Myc-SLP-2 质粒和SiRNA转染(方法参考LipofectamineTM 2000转染试剂盒说明书)到MCF-7细胞.转染后培养24~72 h,收集细胞并抽提总蛋白.取50 μg变性蛋白进行SDS-GAGE电泳,转膜,5%脱脂奶粉封闭,分别用anti-Myc单抗(1∶1 000 稀释和SLP-2为一抗,用辣根过氧化物酶标记的羊抗IgG(1∶1 000 稀释) 为二抗进行免疫反应,最后用化学发光法显影.
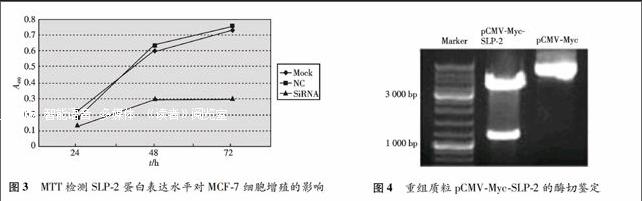
1.2.4 MTT检测细胞活力 MCF-7细胞分别于转染NC RNA和SiRNA后24、48和72 h,用MTT检测细胞活力.实验分组:MCF-7细胞组、NC RNA组、SiRNA组,在酶联免疫监测仪上使用490 nm波长进行检测,记录吸光度,每组3个平行孔.对数据进行统计学分析.以A值为纵坐标,以时间为横坐标作细胞生长曲线.
1.2.5 统计分析 数据以均值±标准差表示,采用方差分析,检验水准(α)定为0.05,用SPSS 13.0软件处理.
2 结果与分析
2.1 不同侵袭转移能力的乳腺癌细胞间SLP-2的表达水平
MCF-7、MDA-MB-231和MDA-MB-453细胞株都是人乳腺癌细胞,它们的侵袭转移能力和癌化程度按以上顺序逐渐增强.收集此3种细胞,提取细胞总蛋白经过Western blotting检测内源SLP-2的表达情况,结果表明随着细胞癌化程度的增强,SLP-2表达水平也相应增强.GAPDH作内参(见图1).
2.2 SLP-2对人乳腺癌细胞MCF-7细胞增殖的影响与调节作用
2.2.1 Western检测SiRNA干扰后不同时间SLP-2表达水平 为了研究SLP-2在乳腺癌细胞MCF-7中的作用,作者设计了SiRNA干扰SLP-2的表达.用NC RNA和SiRNA转染MCF-7细胞组以及MCF-7细胞组(Mock),分别于24、48和72 h收细胞做Western检测SLP-2的表达情况(如图2).Western结果显示,24 h时干扰效果不太明显,随着时间的推移,干扰效果越来越明显,72 h时干扰效果最好.
2.2.2 MTT检测SLP-2对人乳腺癌细胞MCF-7细胞活力的影响 分别比较NC RNA和SiRNA转染MCF-7细胞组以及MCF-7细胞组(Mock)的细胞增殖能力,结果发现SiRNA干扰组的吸光度低于NC RNA转染组和MCF-7细胞组(见图3),二者增殖活性比较,差别有统计学意义(P≤0.001),说明SLP-2可以增强乳腺癌细胞活力.MTT结果显示,转染后48 h效果开始显现,72 h效果最佳,与Western干扰效果相符.
2.3 SLP-2与HER2/nue相关性研究
2.3.1 SLP-2过表达载体的构建及表达检测 以人脑cDNA 文库为模板,用SLP-2特异性引物进行PCR 扩增,获得SLP-2 基因编码区片段,1%琼脂糖凝胶电泳,显示其分子大小与1 071 bp预期值一致, 且阴性对照中无此大小的条带(资料未显示).将线性pCMV-Myc及回收的SLP-2片段以T4DNA连接酶进行连接,连接产物经转化大肠杆菌DH5α并用氨苄青霉素筛选扩增, 提取质粒,用Kpn I和EcoR I 酶双切,产生1 071 bp左右的DNA条带,与预期相符(见图4),说明目的片段SLP-2已成功插入pCMV-Myc的多克隆位点上.
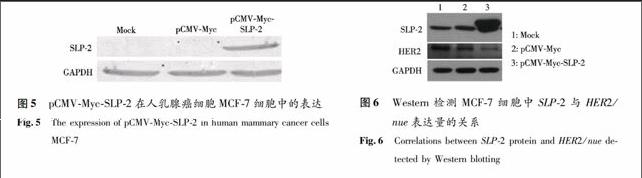
利用脂质体lipofectamine 2000将质粒pCMV-Myc-SLP-2转染入人乳腺癌细胞MCF-7,24 h后收集细胞,提取细胞总蛋白用anti-Myc单抗进行Western分析外源SLP-2的表达.SLP-2基因编码的天然蛋白分子含356个氨基酸,相对分子质量为39 000,加上Myc接头和多克隆位点表达的氨基酸,则大小为42 000左右.Myc单抗检测转染了pCMV-Myc-SLP-2的细胞组应在42 000左右有条带,而转染空质粒pCMV-Myc组和Mock组是没有明显条带的,结果与预期相符(见图5),GAPDH作内参.结果提示,利用lipofectamine 2000转染的pCMV-Myc-SLP-2重组质粒后,可在人乳腺癌细胞MCF-7中高表达SLP-2.
2.3.2 MCF-7细胞中SLP-2与HER2/nue基因表达量的关系 neu基因编码一种与表皮生长因子受体同源的磷酸蛋白, 具有酪氨酸激酶的活性,在多种癌细胞中发现有neu基因的扩增和过量表达.为了探究乳腺癌细胞系MCF-7中SLP-2与HER2/neu基因的关系,利用脂质体lipofectamine 2000分别将pCMV-Myc空载体和质粒pCMV-Myc-SLP-2转染入MCF-7细胞,过表达SLP-2蛋白,48 h后收集细胞,Western分析SLP-2与HER2/nue基因表达量的关系.Western结果显示:SLP-2与HER2/nue基因呈现负相关的关系,说明在MCF-7细胞中过表达SLP-2可以抑制HER2/nue的表达.
3 讨论
SLP-2是stomatin基因家族的一员[8],在脊椎动物中的同源基因有两类,分别是SLP-1和SLP-3.其中SLP-1主要分布在大脑,SLP-3是从嗅觉上皮中分离的嗅觉神经元蛋白[9].Stomatin家族的基因都具有决定stomatin基因家族的一致氨基酸序列和N端的疏水性结构域,这表明它们可能作为细胞骨架和离子通道之间的连接分子,从而影响通道质膜的组织和稳定性 [5].因为SLP-2基因具有stomatin家族的共有氨基酸序列,而缺乏N端疏水性结构域,所以它可能作为外周膜蛋白将其他细胞骨架蛋白与膜蛋白连接起来,调控离子通道的传导等[5,10].而现有的研究数据表明,SLP-2基因在多种人类恶性肿瘤中高表达,比如食管癌、宫颈鳞癌等,很可能是一种肿瘤相关蛋白[4-7,11],同时还发现SLP-2与肿瘤的侵袭、转移过程密切相关 [4].而SLP-2基因在乳腺癌组织的高表达还与乳腺癌病人的存活率呈负相关性,这说明SLP-2基因在乳腺癌的发生中发挥重要作用,但其在乳腺癌中具体的作用机制还不清楚.
为了进一步研究SLP-2基因的功能,有必要构建其真核表达载体并检测其在乳腺癌细胞中的表达水平.本文通过免疫印记的方法分析SLP-2在乳腺癌细胞系中的表达水平,发现SLP-2的表达随着乳腺癌细胞癌化程度的增高而递增.然而,用SiRNA干扰SLP-2的表达,发现24 h干扰效果很小,48 h效果显著,72 h效果最佳,与Wang等[12-15]在食管鳞状癌细胞中的研究结果一致.MTT法检测其对MCF-7细胞活力的影响,结果表明SiRNA干扰后细胞活力受到抑制,即SLP-2可以增加细胞活力.
在探究SLP-2与HER2/neu基因的关系时,作者过表达SLP-2蛋白发现HER2/neu表达受抑制,SLP-2能下调HER2/neu的表达.HER2/neu是一种癌基因,在多种癌细胞( 如乳腺、卵巢、子宫、子宫颈、前列腺、肺、十二指肠、胃、胰、鼻咽、唾液腺等的癌变细胞) 中发现有neu基因的扩增和( 或) 过量表达[16],成为癌症的重要预后因子.在乳腺癌中,HER2/neu表达量与乳腺癌的转移情况有重要相关性,曹等[2,7]发现在乳腺癌中,缺少HER2/neu基因表达的情况下,SLP-2可以促进淋巴结转移.作者发现在乳腺癌细胞中,随着癌化程度的升高SLP-2的表达量也会上升,而在乳腺癌细胞系MCF-7中过表达SLP-2会使HER2/neu表达量下降,与曹等观点一致.在很多癌症中,HER2/neu表达量与癌症转移成正相关,与病患术后5年生存率成反比,然而在乳腺癌中HER2/neu表达量与癌症转移成负相关,而具体的机制还不清楚,进一步探索其机制对乳腺癌治疗具有重大意义.
参考文献:
[1] KRISTIANSEN G, WINZER K J, MAYORDOMO E, et al. CD24 expression is a new prognostic marker in breast cancer[J]. Clin Cancer Res, 2003,9(13):4906-4913.
[2] CAO W, ZHANG B, LIU Y, et al. High-level SLP-2 expression and HER-2/neu protein expression are associated with decreased breast cancer patient survival[J]. Am J Clin Pathol, 2007,128(3):430-436.
[3] WANG Y, MORROW J S. Identification and characterization of human SLP-2, a novel homologue of stomatin (band 7.2b) present in erythrocytes and other tissues[J]. J Biol Chem, 2000,275(11):8062-8071.
[4] SU L, ZHANG J, WEI X Q, et al. The correlation between the differential expression of Slp2 gene(stomatin like protein-2) and the differentiation and metastasis of the lung cancer[J]. Chin J Clin, 2005,32(12):678-680.
[5] ZHANG L Y, DING F, LIU Z M,et al. Effect of stomatin-like protein 2(SLP-2)gene on growth and proliferation of esophagealsquamous cell carcinoma cell line TE12[J]. Ai Zheng, 2005,24(2):155-159.
[6] CUI Z, ZHANG L, HUA Z, et al. Stomatin-like protein 2 is overexpressed and related to cell growth in human endometrial adenocarcinoma[J]. Oncology Rep, 2007,17(4):829-833.
[7] CAO W, ZHANG B, LI J, et al. SLP-2 overexpression could serve as a prognostic factor in node positive and HER2 negative breast cancer[J]. Pathology, 2011,43(7):713-718.
[8] SALZER U, AHORN H, PROHASKA R. Identification of the phosphorylation site on human erythrocyte band 7 integral membrane protein:implications for a monotopic protein structure[J]. Biochim Biophys Acta, 1993,1151(19):149-152.
[9] GOLDSTEIN B J, KULAGA H M, REED R R, et al. Cloning and characterization of SLP3: a novel member of the stomatin family expressed by olfactory receptor neurons[J]. J Assoc Res Otolaryngol, 2004,4(1):74-82.
[10] SPRENGER R R, SPEIJER D, BACK J W, et al. Comparative proteomics of human endothelial cell caveolae and rafts using two-dimensional gel electrophoresis and mass spectrometry[J]. Electrophoresis, 2004,25(1):156-172.
[11] 张 剑, 李建生, 吴 敏, 等. SLP-2在胃癌中的表达及意义[J]. 世界华人消化杂志, 2012,20(19):1778-1781.
[12] WANG Y, CAO W, YU Z, et al. Downregulation of a mitochondria associated protein SLP-2[J]. Cancer Biology Therapy, 2009,8(17):1651-1658.
[13] MARK G, KIRCHHOF L A C, CAITLIN D. Lemke, modulation of T cell activation by stomatin-like protein 2[J]. J Immunology, 2008,181(3):1927-1936.
[14] DA CRUZ S, PARONE P A, GONZALO P, et al. SLP-2 interacts with prohibitins in the mitochondrial inner membrane and contributes to their stability[J]. Biochim Biophys Acta, 2008,1783(5):904-911.
[15] HAJEK P, CHOMYN A, ATTARDI G. Identification of a novel mitochondrial complex containing mitofusin 2 and stomatin-like protein 2[J]. J Biol Chem, 2007,282(8):5670-5681.
[16] 龚海彪,张惟杰,徐晋麟. 肿瘤中neu基因的过量表达及其抑制[J]. 生物化学与生物物理进展, 1998,25(2):99-101.
(编辑 王 健)

