术后早期肠内免疫营养对老年胃癌患者营养状况及免疫功能的影响
罗晓东 李晓辉
胃癌在全球范围内发病率均较高,其中以超过50岁人群为主要发病群体。老年胃癌患者基础营养状况差,受到手术创伤、术后禁食、肿瘤消耗等因素影响,机体容易出现高分解代谢状态及营养不良,致使免疫功能受到抑制,伤口愈合速度受到影响并引发各种并发症,不利于术后恢复[1]。研究表明,术后早期应用膳食纤维、核苷酸、ω-3多不饱和脂肪酸、谷氨酰胺、精氨酸等可有效缓解患者营养不良及免疫抑制状态,降低并发症发生率,促进伤口愈合进而改善预后[2]。本文选择本院2011年4月-2014年4月期间所收治82例胃癌患者作为研究对象,观察术后早期肠内免疫营养对老年胃癌患者营养状况及免疫功能所造成影响,报告如下。
1 资料与方法
1.1 一般资料 选取本院2011年4月-2014年4月收治82例胃癌患者作为研究对象,所有患者均经术前胃镜活检及术后病理检查予以确诊,排除高胆固醇血症、高三酰甘油血症、糖尿病、甲亢等内分泌系统疾病者,合并严重肝、肾功能异常者及发病前1个月时间内进行过胃肠营养治疗者。按照患者入院顺序进行编号,奇数号纳入观察组,偶数号纳入对照组,每组各为41例。观察组中男24例,女17例,年龄29~74岁,平均(61.32±5.51)岁;体重52~73 kg,平均(61.36±3.57)kg;22例患者行远端胃切除术,11例行近端胃切除术,8例行全胃切除术;病理分期结果:4例为Ⅰ期,10例为Ⅱ期,21例为Ⅲ期,6例为Ⅳ期。对照组中男25例,女16例,年龄29~74岁,平均(61.32±5.55)岁。体重53~76 kg,平均(61.51±3.41)kg;23例患者行远端胃切除术,12例行近端胃切除术,6例行全胃切除术;病理分期结果:3例为Ⅰ期,11例为Ⅱ期,22例为Ⅲ期,5例为Ⅳ期。两组患者的年龄、性别、手术方式等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法 两组术前1周分别口服添加谷氨酰胺颗粒(30 g/d)免疫增强型肠内营养液瑞能及普通肠内营液能全力,确保肠内营养热卡量在83.60 kJ/(kg·d)。观察组行肠内营养,术中随胃管将螺旋型鼻肠管(荷兰纽迪希亚公司生产)置入空肠上段,手术当天用平衡液维持患者营养。术后第1天起经螺旋型鼻肠管提供营养,对照组行肠外营养,术中通过颈部静脉穿刺将营养管置入,尖端位于上腔静脉。两组主要提供热卡及氮营养支持,对照组行标准全肠道外营养支持,能量为105 kJ/(kg·d),氮输入量为0.20 g/(kg·d),总输液量为50 mL/(kg·d)。观察组行肠内营养,经鼻肠管输注与肠外营养组等氮、等热卡,营养液量从500 mL逐渐稀释至1500 mL,鼻肠管输注50 mL,剩余经由静脉输入。两组营养支持时间均为1周。
1.3 观察指标 对比两组术前及术后第8天营养情况及免疫功能,其中营养情况用TFN(转铁蛋白)、preAlb(前白蛋白)、Alb(血清白蛋白)、体重进行评定,免疫功能用IgG、IgM、IgA及外周血T淋巴细胞群(CD4+、CD8+、CD4+/CD8+)进行评定。
1.4 统计学处理 使用SPSS 17.0统计学软件进行分析,计量资料采用(±s)表示,比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组营养状况的比较 两组术前TFN、preAlb、Alb、体重的比较差异均无统计学意义(P>0.05);术后第8天,两组各指标均有所下降,但观察组依然高于对照组,与术前各指标值更接近,两组比较差异有统计学意义(P<0.05),见表1。
2.2 两组免疫功能的比较 两组术前IgG、IgM、IgA、CD4+、CD8+、CD4+/CD8+的比较差异均无统计学意义(P>0.05);术后第8天,两组各指标均有所降低,但观察组各指标水平依然高于对照组,与术前各指标值更接近,两组比较差异有统计学意义(P<0.05),见表2。

表1 两组营养状况比较(x-±s)
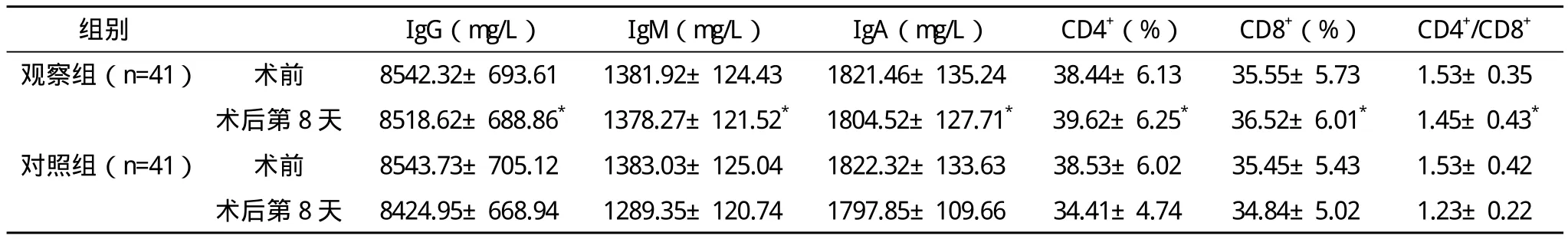
表2 两组免疫功能比较(x-±s)
3 讨论
胃癌患者胃肠功能受损,术后较长时间无法进食,营养不良情况往往较为严重,且免疫功能会明显减退,易发生器官功能紊乱而引发并发症。此外,手术所造成创伤本身也可能致患者细胞免疫功能受到抑制。而近年来,肠道细菌移位所引发肠源性感染问题严重,肠黏膜在损伤、感染、缺血及营养不良影响下均可能发生屏障功能障碍而导致肠源性感染。已有临床研究表明,免疫抑制与营养不良也是引起患者伤口延迟愈合的重要危险因素。如何缓解患者术后营养不良及细胞免疫受抑情况并防止肠源性感染,已经成为肿瘤外科医生重点研究课题[3-4]。传统观念认为,消化道手术创伤会导致患者肠道出现3 d左右的麻痹,对肠道中营养物质消化吸收造成较大影响。但近年来也有研究显示,消化道手术后6~12 h,小肠即具有一定蠕动、消化及吸收能力,肠道麻痹仅局限于结肠及胃部等,这一结论成为胃癌患者术后早期营养理论依据。淋巴细胞在机体免疫过程中发挥重要作用,其可以分为B淋巴细胞、T淋巴细胞及NK细胞。T淋巴细胞所参与免疫过程以细胞免疫为主,其可与某种特异性抗原物质或细胞相接触而发挥免疫功能。B淋巴细胞所参与免疫过程以体液免疫为主,且其在抗原刺激下可转化为浆细胞产生多种特异性抗体并释放到血液中,阻止机体受到细胞外液中抗原、异物伤害。NK细胞为重要先天性免疫系统组成部分,可对B淋巴细胞、T淋巴细胞等免疫过程进行调节,抗御感染并防止细胞恶性转化。人体消化道中含有大量淋巴组织,淋巴细胞数量占机体总淋巴细胞数量60%左右。肠道中淋巴组织受到抗原刺激后向肠系膜淋巴结发生转移,通过淋巴管流入患者胸导管中,从而参与血液循环与机体免疫过程,基于此,维护小肠功能状况非常重要。有研究证实,肠道黏膜30%营养来源为肠系膜动脉血液供应,另外70%则来自肠腔内营养物质,早期肠内营养重要性得到进一步凸显。
早期肠内营养除为机体提供充足营养物质外,还可促进代谢合成、维持肠黏膜功能与结构稳定,刺激机体产生免疫球蛋白与胃肠激素,避免高代谢及肠源性感染,让机体免疫功能获得增强。肠外营养均可能引发内毒素血症及肠道细菌移位,机体炎症因此放大。有国外研究专家证实,食管癌患者外周血内毒素浓度将会在术后24 h内达高峰,尽早给予肠内营养让机体内毒素浓度水平显著降低,原因在于术后内毒素血症的出现与肠道通透性及肠黏膜萎缩有密切联系。内毒素血症的出现会进一步加重肠黏膜屏障损害,使机体免疫功能受到抑制。而术后早期提供肠内营养可有效保护肠黏膜屏障并增强机体免疫能力,避免术后感染的出现。本组研究为探析有效营养支持方法,将肠内与肠外免疫营养对患者营养状况及免疫功能影响进行对比,结果显示术后肠内免疫营养可更好缓解患者营养状况,保持机体免疫力。在肠内营养支持下患者TFN、preAlb、Alb、体重等下降幅度更低,preAlb为转甲状腺素蛋白,主要由肝细胞合成,半衰期较短,其在血浆中浓度可有效反应蛋白质营养不良及肝功能不全情况,敏感性较高。有学者通过实验研究发现,preAlb可通过加快新陈代谢速度而达到组织修复作用。TFN为反映急性炎症反应重要指标,机体发生恶性病变时,preAlb与Alb均会随着营养状态变差而随之显著下降。本组研究中,观察组下降幅度明显比对照组小,说明该组营养状况优于对照组,因此患者体重更高。此外,肠内营养剂中富含ω-3脂肪酸及谷氨酰胺等营养物质,有助于机体免疫功能的提高。谷氨酰胺为机体创伤应激状态下必须氨基酸,机体在创伤状态下富含谷氨酰胺可减慢蛋白分解代谢速度,改善机体免疫功能。原因在于肠内给予谷氨酰胺可降低肠壁通透性,进而对肠道细菌易位及术后内毒素血症等进行预防,从而增强机体免疫力。另有研究表明,经肠内途径补充谷氨酰胺与肠外营养相比可更好维持并提高血液中维生素E水平,以强化抗氧化能力。Grimm等通过实验研究证实,ω-3多不饱及脂肪酸可阻碍炎性介质PGE2分泌、抑制TNF、IL-1、等细胞因子产生,抑制炎症反应发展,以细胞免疫为主强化机体抗感染与抗应激能力。此外,肠内营养可刺激肠道增加免疫球蛋白、肠道激素分泌,利于机体免疫功能提高。本研究结果还显示,术后观察组CD4+、CD8+、CD4+/CD8+水平较对照组均明显升高,差异有统计学意义(P<0.05),表明早期肠内营养在增强细胞免疫功能方面优于肠外营养方式。原因在于肠内营养可增强胃肠黏膜屏障功能,促进肠蠕动并加速血液循环,让营养因子直接进入肝脏,而肠外营养并不具备这些[5-6]。此外,肠内营养除直接经肠吸收并利用外,还具有费用低廉、给药方便、更符合生理等优点,更有利于患者营养状态改善[7-8]。机体免疫力是抵抗感染等问题的主要功能,肠内营养组患者IgG、IgM、IgA及外周血T淋巴细胞群(CD4+、CD8+、CD4+/CD8+)等指标变化情况与肠外营养组相比明显更小,提示该种免疫营养方式可更好维持患者免疫功能[9-10]。IgG、IgM、IgA及CD4+、CD8+、CD4+/CD8+为调节机体细胞免疫及体液免疫主要因子,在抗体生成、分泌及T细胞增值过程中发挥重要作用,因此经过术后1周肠内营养后相关免疫指标与术前差异越好,提示免疫功能恢复情况越好,效果越显著[11-14]。另外,有临床研究得出机体免疫功能胃癌术后复发率具有明显相关性的结论,提示重视术后免疫功能恢复具有重要意义[15-16]。
综上,与肠外营养相比,术后早期进行肠内营养可有效促进患者免疫功能恢复并改善营养状况,效果显著,应用前景广阔。
[1]尹勇,许军,卢麒丞,等.围手术期肠内免疫营养对胃癌病人术后免疫功能和预后的影响[J].肠外与肠内营养,2008,15(4):221-224.
[2]吴佳,张宇龙,张璐,等.胃癌术后肠内免疫营养对胃癌患者近期疗效的Meta分析[J].循证医学,2012,12(5):291-298.
[3]王娟,谭晓艳.肠内普通营养与肠内免疫营养对胃癌患者术后营养支持效果比较[J].护理学报,2011,18(2):48-50.
[4]胡晓,王春菊,朱佳立,等.肠内免疫营养对老年胃癌患者的疗效观察及护理[J].护理实践与研究,2011,8(2):36-37.
[5]周新华,蒋晓松,曾永红,等.肠内免疫营养剂应用于围手术期胃癌病人的临床观察[J].浙江临床医学,2010,12(1):18-21.
[6]陈帆,朱宏亮,钱洪军,等.肠内普通营养与肠内免疫营养对胃癌患者术后营养支持效果比较分析[J].现代预防医学,2013,40(5):825-827.
[7]孔烨,花亚伟,高阳,等.胃癌术后吻合口瘘患者处理方法的探讨[J].现代中西医结合杂志,2010,19(18):2270-2271.
[8]向连斌,陈振勇.免疫营养剂对胃癌癌前病变的调理作用[J].武汉大学学报(医学版),2011,32(1):97-100.
[9]孟捷.精氨酸强化的早期肠内营养对胃癌术后患者免疫营养的影响[D].太原:山西医科大学,2012.
[10]谢琦.全胃切除术后早期肠内免疫营养的临床研究[D].浙江:浙江大学,2010.
[11]吴伦清,陆光成,潘宇,等.肠内和肠外营养支持方式对胃癌术后营养状况的影响分析[J].中国医学创新,2013,10(19):135-137.
[12]丁佑铭,付海峰,周文波,等.肠内免疫微生态营养支持对肝癌肝切除术后病人肝损害的影响[J].肠外与肠内营养,2014,21(4):214-216.
[13]綦晓龙,陈川宁,徐亮,等.肠内免疫营养和生态营养对创伤后大鼠免疫功能的影响[J].肠外与肠内营养,2013,20(4):235-238.
[14]张艳杰,余震,潘景业,等.危重症病人两种营养管的耐受性、安全性及吸入性肺炎发生率的比较[J].肠外与肠内营养,2010,17(4):212-214.
[15]罗玉华,黄红燕,张亚男,等.食管癌术后早期两种肠内营养方法的对比研究[J].护理实践与研究,2009,6(16):10-12.
[16]康利民,潘明新,高毅,等.肠内免疫微生态营养对重症急性胰腺炎患者免疫功能及治疗效果的影响[J].实用医学杂志,2013,29(18):3014-3016.

