Hsa-miR-218靶向调控LASP1对宫颈癌HeLa细胞生长的影响*
邱 瑜,黄建平,周勤仙,王 欢,石回刚,何金花(吉安市妇幼保健院妇产科,江西吉安4000;广州市南吉生物技术有限公司,广东广州5060;广州市番禺区中心医院检验科,广东广州5400)
Hsa-miR-218靶向调控LASP1对宫颈癌HeLa细胞生长的影响*
邱瑜1,黄建平1,周勤仙1,王欢1,石回刚2,何金花3△
(1吉安市妇幼保健院妇产科,江西吉安343000;2广州市南吉生物技术有限公司,广东广州510630;3广州市番禺区中心医院检验科,广东广州511400)
[摘要]目的:探讨人微小RNA-218(Homo sapiens microRNA-218,hsa-miR-218)对宫颈癌HeLa细胞生长的影响及分子机制。方法:构建hsa-miR-218的重组慢病毒表达载体pmiR-218,并将pmiR-218感染至HeLa细胞,台盼蓝拒染法检测细胞数量的变化,WST-8法检测细胞活力,构建萤光素酶报告基因载体验证miR-218与LIM和SH3蛋白1(LASP1)的相互结合作用,real-time PCR检测LASP1的mRNA相对表达水平,Western blot检测LASP1蛋白的表达水平。结果:经DNA测序证实与设计完全一致,测序结果显示成功构建了重组慢病毒表达载体pmiR-218。pmiR-218转染HeLa细胞72 h后HeLa细胞存活数量为176±9,对HeLa细胞活力的抑制率具有时间效应关系,较空白对照组比较,差异显著(P<0.05) ;萤光素酶活性结果显示,克隆LASP1-3’UTR的质粒与miR-218 mimics共转染293T细胞,引起萤光素酶活性的减低; real-time PCR结果显示转染pmiR-218后,miR-218表达水平增加;过表达miR-128能下调LASP1 mRNA及蛋白的相对表达水平,与空白对照组及阴性对照组比较,差异显著(P<0.01)。结论: pmiR-218有效抑制HeLa细胞的生长,并具有时间-效应关系,其机制可能是miR-218通过靶向结合LASP1的3’UTR,从而下调其在HeLa细胞的表达有关。
[关键词]人微小RNA-218; LIM和SH3蛋白1;宫颈癌; HeLa细胞
[修回日期]2015-06-19
宫颈癌是常见的妇科恶性肿瘤,其发病率仅次于乳腺癌,其发生和发展依次经过宫颈不典型增生、宫颈原位癌、早期浸润癌和浸润癌过程,因此在疾病仍处于上皮内瘤变或原位癌的阶段时及时发现,对于提高治疗效果、改善疾病预后具有积极意义[1]。微小RNA(microRNA,miRNA)是一类内源性的非编码单链小分子RNA,能够与靶基因mRNA的3’UTR互补配对,导致靶mRNA的降解或翻译抑制,参与细胞的增殖、分化和凋亡。miRNA被明确证实为癌基因或抑癌基因[2],miR-218在宫颈癌组织中具有抑癌作用[3]。LIM和SH3蛋白1(LIM and SH3 protein 1,LASP1)是一种肌动蛋白支架蛋白,其阳性率在宫颈癌组织中呈高表达且与血管内皮细胞生长因子C (vascular endothelial growth factor-C,VEGF-C)在宫颈癌发病中起促进和协同作用[4]。运用生物学信息分析软件预测到MiR-218与LASP1具有结合位点。因此,本研究通过表达miR-218,研究其对宫颈癌HeLa细胞生长的抑制作用及可能的作用机制,为临床上宫颈癌的靶向基因治疗提供依据。
材料和方法
HeLa细胞与H293T细胞购自中科院上海细胞库; TRIzol试剂和LipofectamineTM2000购自Invitrogen;焦碳酸二乙酯(diethylpyrocarbonate,DEPC)、逆转录试剂盒、Taq DNA聚合酶及dNTP均购自Promega; dNTP、BamH I与EcroR I、T4 DNA连接酶、PCR产物纯化试剂盒及质粒抽提试剂盒购自TaKaRa; 1%双抗完全培养基DMEM、胎牛血清购自Invitrogen; SYBR Green PCR Master Mix购自TOYOBO;大肠埃希菌DH5α感受态细胞、人胚肾293T细胞(HEK 293T细胞,简称293T)、重组慢病毒质粒pLVX-shRNA2、包装质粒PLD2及包膜质粒PLD3均由广州南吉生物技术有限公司提供。引物设计合成由苏州金唯智公司合成,并经PAGE纯化。
2实验方法
2.1慢病毒表达载体的构建及病毒滴度测定miR-218慢病毒表达载体构建由广州市南吉生物技术有限公司完成,命名为pmiR-218。将重组慢病毒质粒、包装质粒PLD2及包膜质粒PLD3共转染293T细胞,转染次日早上更换10 mL新鲜完全培养基(含1%双抗)。收集48 h的含病毒培养上清,接种48孔细胞培养板(3×104cells/well)。10倍梯度连续稀释病毒液,将稀释好的病毒液各10 μL依次加入孔中。培养48 h后,置于倒置荧光显微镜下计数荧光细胞情况。用转导单位(transducing units,TU)定义病毒滴度,按下列公式计算病毒滴度(103TU/L)=绿色荧光细胞数/视野×视野数/孔数×病毒稀释倍数÷病毒体积。
2.2细胞培养和转染HeLa细胞用含10%小牛血清的DMEM/F12培养基在37℃、5% CO2培养箱在培养,每3 d传代1次.取对数生长期的HeLa细胞,严格按LipofectamineTM2000转染试剂盒说明书操作进行。实验分为空白对照(control)组(不加转染试剂)、pmiR-128组(含有慢病毒和LipofectamineTM2000)和阴性对照(negative control,NC)组(含LipofectamineTM2000和质粒空载体慢病毒)。
2.3细胞存活数目检测pmiR-218转染HeLa细胞72 h后用0.04%台盼蓝分别对3组HeLa细胞进行染色,光镜下计数活细胞数(其中着色细胞为死细胞),每个样品计数3次。
2.4WST-8法检测细胞活力将1.0×108/L HeLa细胞接种于96孔细胞培养板,使pmiR-128终浓度分别为10 μg/L,每组设3个复孔,非特异性对照组终浓度为10 μg/L。置37℃、5% CO2培养24 h、48 h和72 h,每孔加入10 μL CCK-8试剂,继续孵育1 h,酶标仪检测吸光度(A450/A655)并按下列公式计算各组细胞活力:细胞活力抑制率(%)=(1-ApmiR-128组/A空白对照组)×100%。
2.5构建萤光素酶报告基因载体运用生物学信息软件预测miR-218的靶基因为LASP1 (http://www.umm.uni-heidelberg.de/apps/zmf/mirwalk/mirnapredictedtarget.php)。提取HeLa细胞基因组的DNA作为PCR扩增模板,调取LASP1全长的3’UTR序列,扩展引物分别添加Xho I和Not I酶切位点。Xho I和Not I双酶切PCR扩增产物,随后将扩增片段连接到psiCHECK-2载体上。连接产物转化感受态DH5α大肠杆菌,酶切鉴定正确的阳性克隆送测序。将构建好psiCHECK-2-LASP1-3’UTR与psi-CHECK-2-LASP1-3’UTR-mut质粒按照以下分组进行转染: (1) contrtol组; (2) miR-218 mimics (50 nmol/L)组; (3) negative control (50 nmol/L)组; (4) inhibitor (100 nmol/L miRNA inhibitor)组; (5) negative control inhibitor (NCI)组(50 nmol/L,作为inhibitor组的阴性对照)。RNA-Lipofectamine 2000复合物的配制严格按LipofectamineTM2000转染试剂盒说明书操作进行共转染HEK293T,最后行双荧光检测(由广州市莱德尔生物技术限公司完成)。
1)风机风筒内气流流动类似于管道内气体流动,参考管道内气流速度分布特征,断面Ⅰ—Ⅰ平面内风流并非均用分布,机壳附近气流速度小而静压大,而风筒中心区域气流速度大而静压小,而断面Ⅰ—Ⅰ处静压测点布置在机壳上,因此测得断面Ⅰ—Ⅰ静压大于断面Ⅰ—Ⅰ实际平均静压,造成测得的风机风量大于真实风量。
2.6Real-time PCR检测LASP1 mRNA的表达水平细胞分组同2.2,用TRIzol法提取RNA,pmiR-218转染HeLa细胞,于转染后的48 h分别于荧光显微镜下观察细胞中GFP的表达。采取TRIzol试剂提取RNA,采用M-MLV逆转录酶逆转录为cDNA(RT引物为5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGAC ACATGGTT-3’),作为PCR反应的模版。LASP-1的上游引物为5’-ACACTCCAGCTGGGTTGTGCTTGATCTAA-3’,下游引物为5’-GTCGTATCCAGTGCAGGGT-3’;扩增片段大小72 bp; U6的上游引物为5’-CTCGCTTCGGCAGCACA-3’,下游引物为5’-AACGCTTCACGAATTTGCGT-3’,扩增片段的大小为86 bp; GAPDH的上游引物为5’-GGATTTGGTCGTATTGGG-3’,下游引物为5’-GGAAGATGGTGATGGGATT-3’,扩增片段的大小为94 bp。采用SYBR Green掺入法进行荧光定量PCR反应,94℃5 min; 94℃15 s,60℃15 s,72℃32 s,共35个循环,所有的样本检测均包含一个不加模板的阴性对照,以排除假阳性的结果。计算2-ΔΔCt值来比较对照组和实验组的目的基因mRNA相对表达量的差异。
2.7Western blot检测细胞LASP1蛋白的相对表达水平细胞分组同2.2,培养48 h,消化收集各组细胞。按细胞裂解液(RIPA)说明书提取细胞蛋白。用BCA蛋白定量试剂盒进行蛋白定量,根据定量结果对各蛋白质样本进行校正。加入样品溶解液和样品,置沸水中煮5 min。不连续的聚丙烯酰胺凝胶电泳(10%聚丙烯酰胺分离胶和5%聚丙烯酰胺浓缩胶),电压80 V,进入分离胶后改为120 V,40 min。将凝胶上的蛋白条带转到硝酸纤维膜上,半干式转膜15 V,18 min; TBST洗膜5 min,5%牛血清白蛋白封闭缓冲液室温封闭1 h,TBST洗膜3次,每次5 min。I抗4℃孵育过夜; TBST洗膜3次,每次5 min; II抗37℃孵育1 h; TBST洗膜3次,每次5 min。加入ECL试剂,显影。BI-2000型图像分析软件分析IL-10和GAPDH的积分光密度,以GAPDH作为内参照。
3统计学处理
用SPSS 13.0统计软件进行分析。计量资料以均数±标准差(mean±SD)表示,两个样本的均数比较采用t检验,多组均数比较采用单因素方差分析(one-way ANOVA),两两比较用Bonferroni法。以P<0.05为差异有统计学意义。
结果
1慢病毒滴度的测定及测序鉴定结果
将重组慢病毒质粒、包装质粒PLD2及包膜质粒PLD3共转染293T细胞,于72 h收集病毒上清液,运用10倍梯度连续法测得病毒滴度为1×1011TU/L,运用荧光显微镜观察到带GFP病毒的表达。重组质粒pmiR-218的测序结果与设计的引物序列完全相符,所含目的基因序列准确无误,表明成功构建了慢病毒表达载体,见图1。
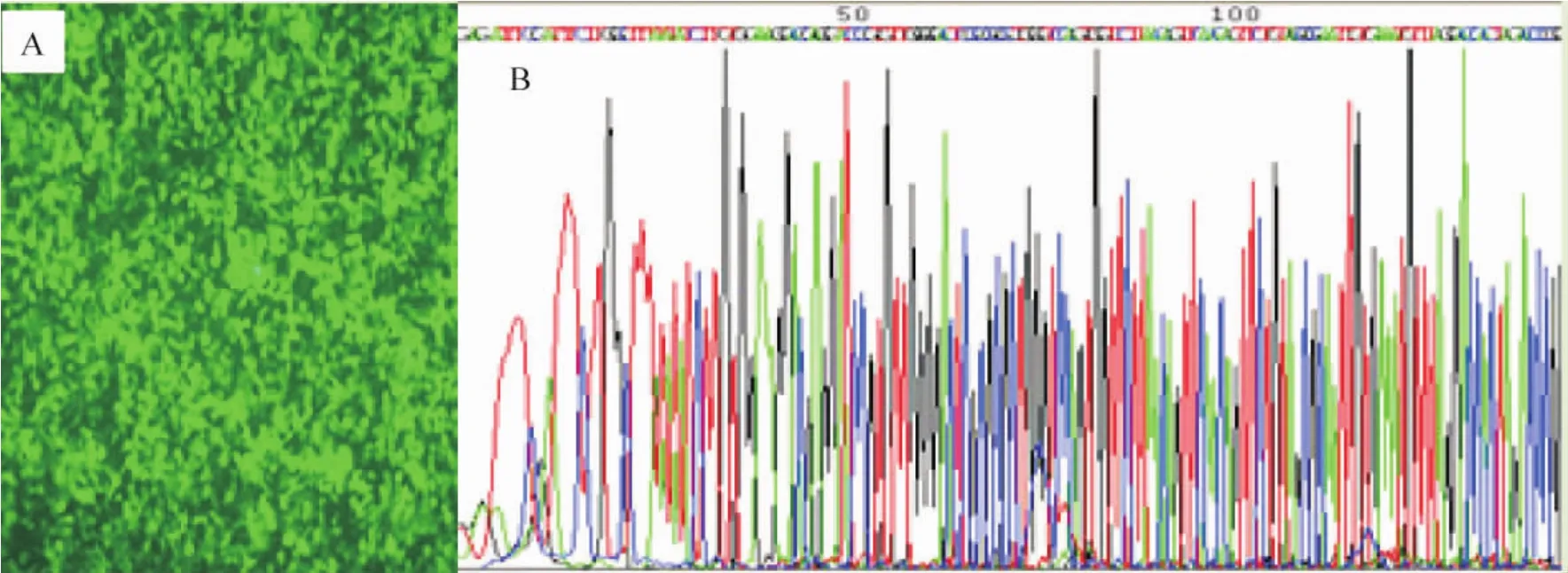
Figure 1.Determination of lentivirus titer (A) and identification of pmiR-218 by sequencing (B).图1慢病毒滴度的测定及pmiR-218测序鉴定
2 pmiR-218对HeLa细胞活力和生长的影响
将构建好的慢病毒表达载体pmiR-218运用脂质体2000转染HeLa细胞72 h之后,用0.04%台盼蓝对HeLa细胞进行染色后,计算细胞的存活数目。实验组(pmiR-218)的细胞存活数目明显减少,较空白对照组与阴性对照组比较差异有统计学意义(P< 0.05),见图2。
将构建好的慢病毒表达载体pmiR-218运用脂质体2000转染HeLa细胞,分别在24 h、48 h和72 h检测其细胞活力抑制率。结果显示pmiR-128组随着作用时间的延长,其抑制率也相应增加,NC组的抑制率增加不明显,pmiR-218组与NC组比较,差异具有统计学意义(P<0.05),见图3。结果表明成功构建了miR-218慢病毒表达载体,其在HeLa细胞中的过表达能有效抑制细胞活力。
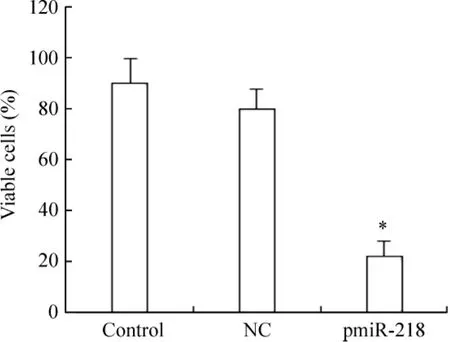
Figure 2.The number of viable HeLa cells was counted by the method of Trypan blue exclusion.Mean±SD.n=3.*P<0.05 vs NC group.图2台盼蓝拒染法检测活细胞数目
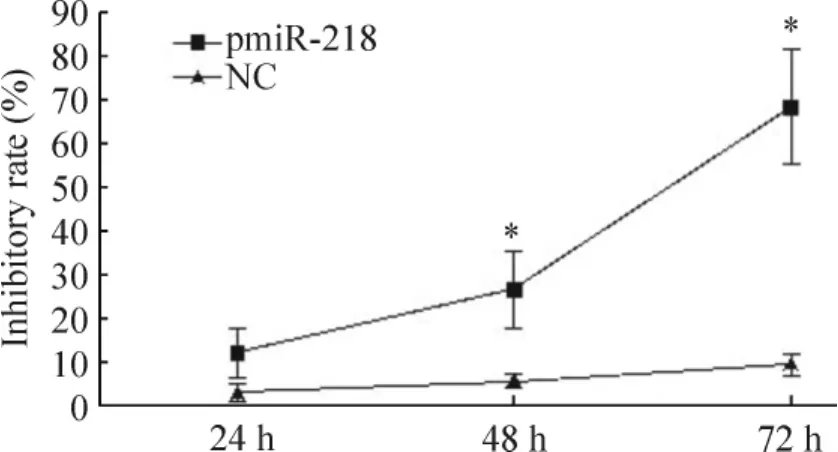
Figure 3.The inhibitory effects of pmiR-128 on the activity of HeLa cells.Mean±SD.n=3.*P<0.05 vs NC group.图3 pmiR-128对HeLa细胞活力的抑制作用
3 miR-128与LASP1存在相互调控作用
为了验证miR-128可能调控的靶基因,首先运用生物学软件(http://www.targetscan.org/cgi-bin/targetscan/vert_61/view_gene.cgi? taxid=9606&rs=NM _ 006148&members=miR-218/218a&showcnc=0&shownc=0)预测到LASP1与miR-128存在结合位点。将LASP1-3’UTR全长序列(2 992 bp)克隆到pisCHI-2载体上luciferase基因的下游,构建psi-CHECK-2-LASP1-3’UTR载体,同miR-218 mimics共转染细胞。进一步分别检测结合位点1(686 bp)、结合位点2(692 bp)和同时突变2个结合位点(686 bp和692 bp)确证miR-218与LASP1-3’UTR的直接结合作用。共转染miR-218 mimics和psiCHECK-2-LASP1-3’UTR可以显著减少luciferase的活性(P<0.05),而突变结合位点1、2或同时突变2个结合位点,luciferase的活性几乎不受影响,证明miR-218通过直接结合到LASP1-3’UTR上而发挥调控作用,见图4。
4 pmiR-218对LASP1 mRNA及miR-218在HeLa细胞中表达水平的影响
将构建好的慢病毒表达载体pmiR-218运用脂质体2000转染HeLa细胞48 h后,运用RT-PCR分别检测LASP1 mRNA及miR-218的相对表达水平。过表达miR-218后,miR-218的表达水平明显增加,与空白对照组及NC组比较差异具有统计学意义(P<0.05)。同时LASP1 mRNA显著下调,与空白对照组及NC组比较差异显著(P<0.05),见图5,说明过表达miR-218能下调LASP1的mRNA表达。
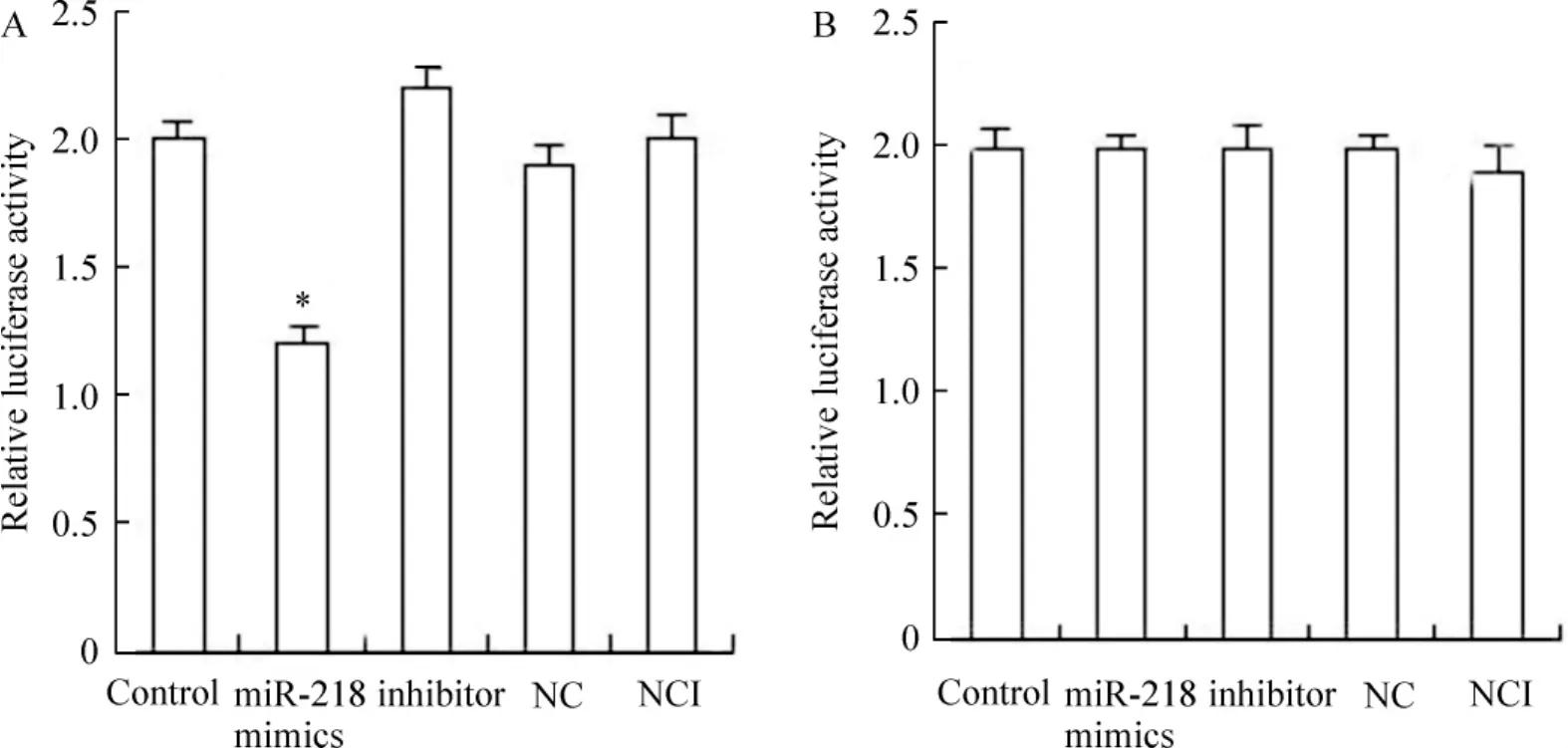
Figure 4.The luciferase activity in the HeLa cells after transfection.A: comparison of luciferase activity in the HeLa cells transfected with cloned LASP1-3’UTR; B: comparison of luciferase activity in the HeLa cells transfected with cloned mutant LASP1-3’UTR.Mean±SD.n=3.*P<0.05 vs control and NC group.图4萤光素酶活性的比较
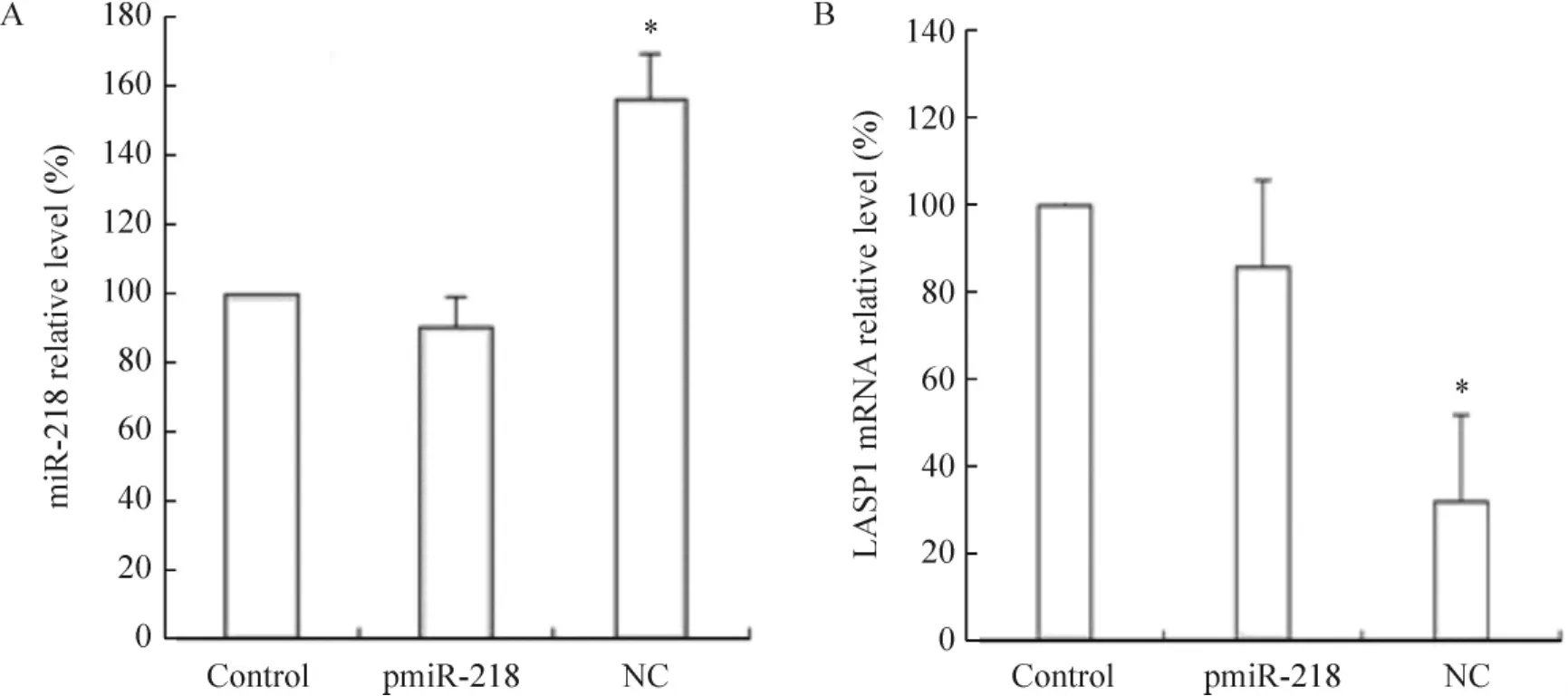
Figure 5.The effects of pmiR-218 on the relative expression levels of miR-218 (A) and LASP1 mRNA (B) in the HeLa cells.Mean ±SD.n=3.*P<0.05 vs control group and NC group.图5 pmiR-218对LASP1 mRNA及miR-218在HeLa细胞中表达水平的影响
5 pmiR-218对LASP1蛋白相对表达水平的影响
将构建好的慢病毒表达载体pmiR-218运用脂质体2000转染HeLa细胞48 h后,运用Westerrn blot检测LASP1蛋白的相对表达水平。过表达miR-218后,miR-218的蛋白表达水平明显减少,与空白对照组及NC组比较差异显著(P<0.05),见图6。结果说明过表达miR-218能下调LASP1蛋白的表达。
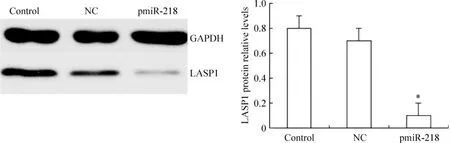
Figure 6.The effects of pmiR-218 on the protein relative expression levels of LASP1.Mean±SD.n=3.*P<0.05 vs control group and NC group.图6 pmiR-218对LASP1蛋白相对表达水平的影响
讨论
宫颈癌是妇科最常见的恶性肿瘤,鳞状细胞癌是其最主要的病理类型,其发病率近年来呈逐渐上升趋势。宫颈癌的病因复杂,与染色体突变、HPV感染、单核苷酸多态性变化等密切相关[5]。研究表明,miRNA可以通过与靶mRNA的3’UTR结合后碱基互补来影响靶RNA的稳定性、蛋白质降解与翻译偶联以及翻译过程中的各个重要环节,从而影响抑制蛋白质的表达[6]。恶性肿瘤的发生发展、转移和浸润都伴随着miRNA表达量的变化[7]。
研究表明hsa-miR-218在肿瘤的形成中具有抑癌的作用。miR-218抑制胃癌细胞的侵龚与转移通过靶向调控Robo1受体[8]。同时,Alajez等[9]报道miR-218通过下调survivin基因的表达抑制鼻咽癌细胞的侵袭。miR-218抑制HPV表达阳性与阴性的宫颈癌SCC细胞株增殖,其具有抑癌作用[10]。慢病毒(lentivirus)载体是以人类免疫缺陷1型病毒(human immunodeficiency virus type 1,HIV-1)为基础发展起来的基因治疗载体。与一般的逆转录病毒载体不同,它对分裂细胞和非分裂细胞均具有感染能力。该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达[11]。因此,本研究选取在宫颈癌中具有抑癌作用的hsa-miR-218,构建其慢病毒表达载体,运用质脂体2000转染至HeLa细胞,实现其在细胞中的过表达,充分发挥其抑癌作用。DNA测序证实与设计完全一致,显示成功构建了miR-218的慢病毒表达载体pmiR-218。pmiR-218能有效抑制HeLa细胞的生长,其细胞活力抑制率在24 h、48 h和72 h分别为13%、28%和65%,并具有时间效应关系。
LASP1是近年来发现的一种新的肌动蛋白结合蛋白和斑联蛋白支架蛋白,在肌动蛋白组装的多个关键部位如黏着斑、伪足、片足等集中。LASP1在高侵袭转移癌中的表达水平显著升高,LASP1可能是肿瘤细胞侵袭转移过程中的重要分子[12],在正常肝组织、癌旁组织以及肝癌中的阳性表达率呈明显的上升趋势。LASP1可能在肝硬化导致肝癌发生时期就出现升高,且有可能成为肝硬化进展为肝癌的早期诊断指标[13]。LASP1阳性率在宫颈癌组高于正常宫颈组,LASP1在宫颈癌组织中具有抑癌作用[4]。为了进一步探讨miR-218与LASP1相互调控关系,我们运用生物学信息软件TargetScan 6.2预测到miR-218的靶基因为LASP1,将克隆LASP1-3’UTR的质粒与miR-218 mimics共转染293T细胞,引起萤光素酶活性的减低。结果表明miR-218与LASP1存在相互调控关系。同时,miR-218通过直接结合到LASP1-3’UTR下调LASP1 mRNA和蛋白的表达。
综上所述,pmiR-218有效抑制HeLa细胞的生长,并具有时间-效应关系,其机制可能是miR-218通过靶向结合LASP1的3’UTR从而下调其在HeLa细胞的表达有关。但是本研究只运用了一株细胞株作为研究对象,存在一定的不足之处,今后将研究miR-218对动物实体瘤的生物学作用及对LASP1靶向调控机制,为更深层次揭示miR-218在宫颈癌组织中发挥的抑癌作用奠定基础。
[参考文献]
[1]Zeng K,Zhang W,Hu X.Progress of research in miR-218 and cervical cancer[J].Chinese-German J Clin Oncol,2013,12(8) : 399-402.
[2]靳有鹏,庞婷婷,王伟,等.人肺动脉平滑肌细胞中微小RNA-210通过MKP-1负性调节低氧下细胞的增殖[J].中国病理生理杂志,2014,30(11) : 2021-2026.
[3]盖红霞.miR-218下调与宫颈癌发生相关性的初步研究[J].中国现代医生,2012,50(27) : 28-29.
[4]Grunewald TG,Kammerer U,Winkler C,et al.Overexpression of LASP-1 mediates migration and proliferation of human ovarian cancer cells and influences zyxin localisation[J].Br J Cancer,2007,96(2) : 296-305.
[5]陈军莹,姚德生,贺婵娟,等.宫颈鳞癌microRNA差异表达的研究[J].实用医学杂志,2014,30(1) : 83-87.
[6]Bartel DP.MicroRNAs: Target recognition and regulatory functions[J].Cell,2009,136(2) : 215-233.
[7]朱耀魁,程妮,胡颖,等.微RNA在宫颈癌发生发展中作用及其与HPV相互关系[J].生理科学进展,2012,43(4) : 251-256.
[8]Tie J,Pan Y,Zhao L,et al.miR-218 inhibits invasion and metastasis of gastric cancer by targeting the Robo1 receptor[J].PLoS Genetics,2010,6(3) : e1000879.
[9]Alajez NM,Lenarduzzi M,Ito E,et al.miR-218 suppresses nasopharyngeal cancer progression through downregulation of survivin and the SLIT2-ROBO1 pathway[J].Cancer Res,2011,71(6) : 2381-2391.
[10]Yamamoto N,Kinoshita T,Nohata N,et al.Tumor suppressive microRNA-218 inhibits cancer cell migration and invasion by targeting focal adhesion pathways in cervical squamous cell carcinoma[J].Int J Oncol,2013,42(5) : 1523-1532.
[11]贾雪梅,王平秦,娣卢春.重组慢病毒表达载体介导HIV-1 Vpr蛋白调控KSHV潜伏感染的初探[J].中华微生物学和免疫学杂志,2010,30(12) : 1097-1103.
[12]祁军安,梁容瑞,李宗芳,等.Lasp-1蛋白在肝癌组织中表达及临床意义[J].西部医学,2013,25(1) : 1097-1104.
[13]Grunewald TG,Kammerer U,Kapp M,et al.Nuclear localization and cytosolic overexpression of LASP-1 correlates with tumor size and nodal-positivity of human breast carcinoma[J].BMC Cancer,2007,7: 198.
(责任编辑:陈妙玲,罗森)
Hsa-miR-218 inhibits growth of cervical cancer HeLa cells by targeting to LASP1
QIU Yu1,HUANG Jian-ping1,ZHOU Qin-xian1,WANG Huan1,SHI Hui-gang2,HE Jinhua3
(1Department of Obstetrics&Gynaecology,Ji’an Maternal and Child Health-Care Hospital,Ji’an 343000,China;2Nangji Biochemistry Technical Limited Company of Guangzhou,Guangzhou 510360,China;3Department of Laboratory Medicine,Central Hospital of Panyu District,Guangzhou 511400,China.E-mail: 332518579@qq.com)
[ABSTRACT]AIM: To study the effect of hsa-miR-218 on cervical cancer HeLa cell growth and the underlying molecular mechanism.METHODS: The lentivirus expression vector pmiR-218 targeting to hsa-miR-218 was constructed.pmiR-218 was transfected into HeLa cells.The number of viable HeLa cells was counted by the method of Trypan blue exclusion.The inhibitory rate of cell activity was detected by WST-8 assay.The expression of LIM and SH3 protein 1 (LASP1) at mRNA and protein levels was determined by real-time PCR and Western blot.The interaction between miR-218 and LASP1 was examined using a luciferase reporter assay.RESULTS: The lentivirus expression vector pmiR-218 targeting to hsa-miR-218 was constructed successfully and confirmed by DNA sequencing.Over-expression of miR-218 inhibited the activity of HeLa cells with the inhibitory rates of 15%,26% and 65% at 24 h,48 h and 72 h,respectively.The difference between transfection group and blank control/negative control group was statistically significant.The luciferase activity was reduced when co-transfection with miR-218 mimics and LASP1-3’UTR plasmid.The relative expression of miR-218 was increased after transfection with pmiR-218.Over-expression of miR-218 down-regulated the LASP1 expression at mRNA and protein levels by 25% and 75% respectively.Compared with blank control group and negative control group,the difference was statistically significant (P<0.05).CONCLUSION: pmiR-218 effectively inhibits the growth of HeLa cells in a time-dependent manner.miR-218 targets to the 3’UTR of LASP1,thus down-regulating the expression of LASP1 in HeLa cells.
[KEY WORDS]Hsa-miR-218; LIM and SH3 protein 1; Cervical cancer; HeLa cells
通讯作者△Tel: 020-34858850; E-mail: 332518579@qq.com
*[基金项目]广州市番禺区科技局珠江科技新星项目(No.2013-专-15-6.09)
[收稿日期]2015-01-07
[文章编号]1000-4718(2015)09-1572-06
[中图分类号]R730.23
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.09.007

