均相催化O2氧化醇的研究进展(下)
王连月,高 爽
(中国科学院 大连化学物理研究所 洁净能源国家实验室,辽宁 大连 116023)
1.3 Co催化体系
Tovrog等[52]报道了Co催化体系,该体系采用pyCo(saloph)NO2或pyCo(TPP)NO2(TPP为磷酸三苯酯)配合物为催化剂,在路易斯酸的存在下,能有效地将伯仲醇氧化为相应的醛或酮。Iwahama等[53-54]对N-羟基邻苯二甲酰亚胺(NHPI)/Co配合物体系进行了研究,其中,NHPI结合少量Co(acac)3的催化体系在温和条件下可有效地将一元醇和二元醇氧化为相应的羰基化合物(见式(28)),但反应时间较长;用Co(OAc)2替代Co(acac)3,并添加少量对氯苯甲酸(MCBA)可有效加快反应速率,该改进体系以乙酸乙酯为溶剂,在室温下可将脂肪、烯丙基和苄基仲醇氧化为相应的酮,将伯醇氧化为相应的羧酸(见式(29)),将非端位的邻二醇氧化为相应的二酮,将末端二醇氧化成相应的酸。NHPI体系的反应机理见图7。从图7可看出,Co(Ⅱ)与O2作用生成Co(Ⅲ)过氧自由基;该自由基与NHPI作用,生成N-氧代邻苯二甲酰亚胺(PINO)自由基;PINO夺取底物上的βH形成自由基物种7A及NHPI;物种7A与O2加合,再与NHPI作用生成物种7B;物种7B继续与Co(Ⅲ)反应形成产物。
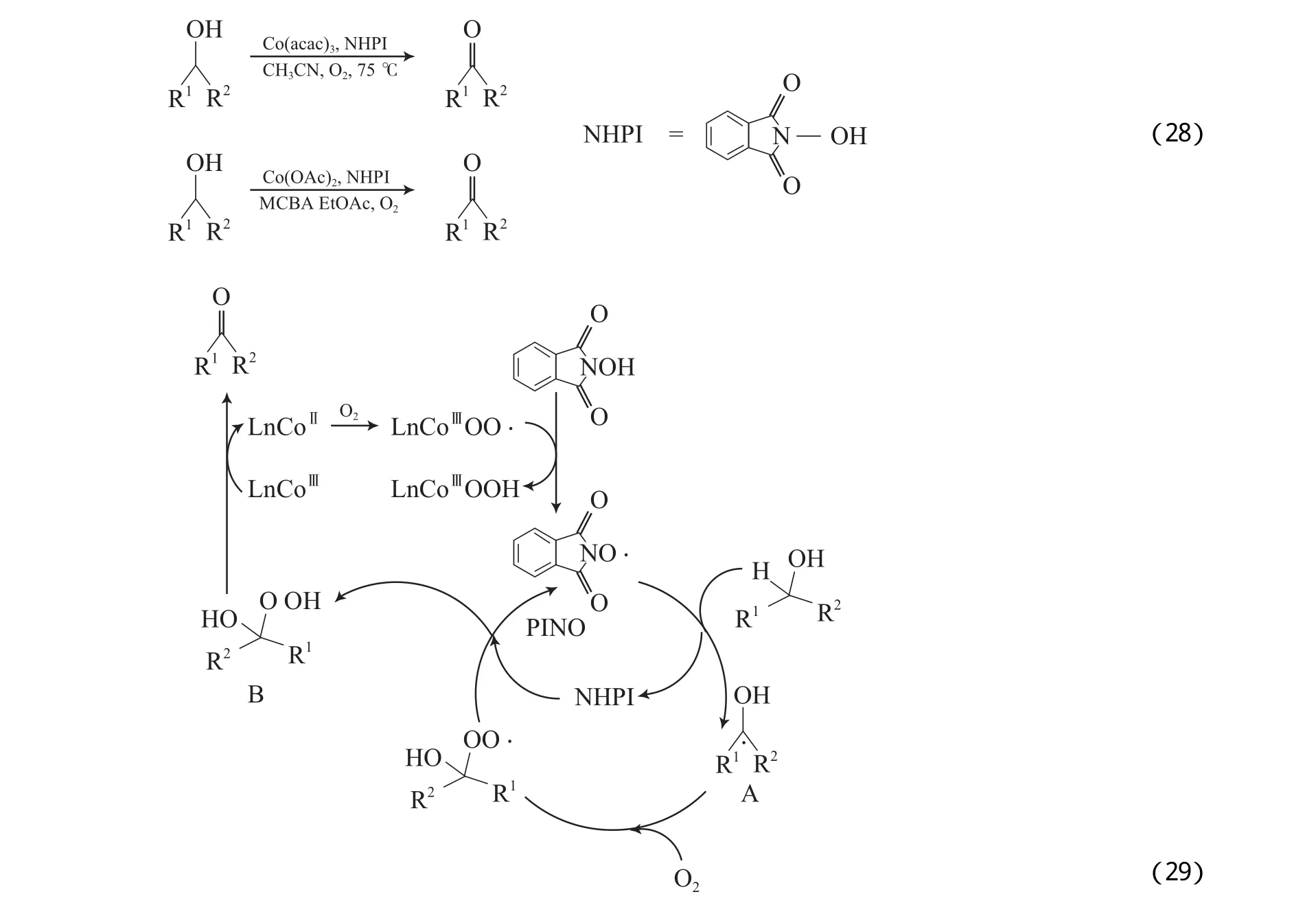
图7 NHPI体系的反应机理Fig.7 Proposed reaction mechanism for the NHPI system.
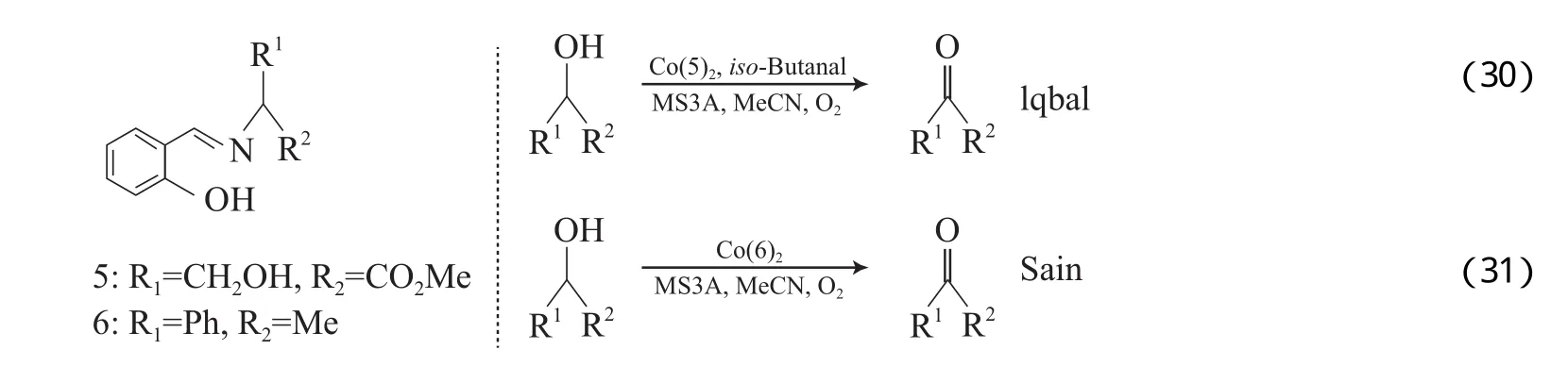
Kalra等[55-58]报道了类似Co(Ⅱ)的希夫碱体系,该体系能有效氧化α-羟基酮(见式(30))。如在体系中添加异丁醛,则能将苯甲醇氧化为苯甲醛,也能有效地氧化含不饱和键的醇(见式(31))。Kalra等提出的反应机理见图8。从图8可看出,Co配合物(8A)与异丁醛反应得到物种8B;8B被O2氧化形成物种8C;8C将醛氧化为相应的酸,同时形成Co(Ⅳ)氧合物种(8D);8D作为活性物种将醇氧化为相应的羰基化合物,同时自身还原成8A。
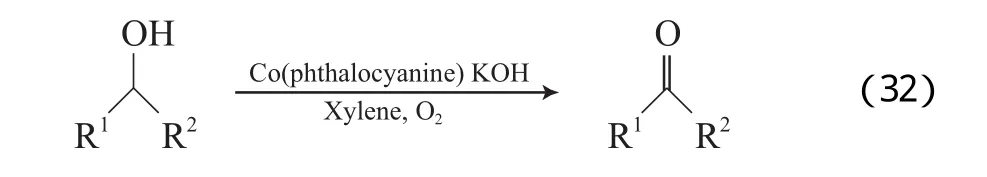
Jain等[59-60]研究发现,钴酞菁配合物在以二甲苯为溶剂、O2存在的条件下能有效氧化苄基、脂肪和炔丙基仲醇为相应的酮(见式(32))。该催化体系还能有效地氧化α-羟基酮。
1.4 V催化体系
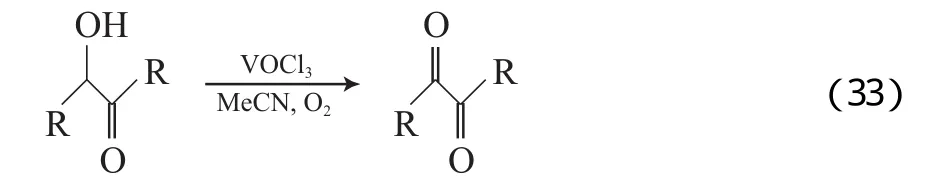
Kirihara等[61]报道了以VOCl3为催化剂的V催化体系,该体系以乙腈为溶剂,在室温下可有效氧化α-羟基酮为相应的双羰基化合物(见式(33))。
Maeda等[62]采用VO(acac)2催化剂,加入 3 A分子筛(MS3A),以乙腈为溶剂,在0.1 MP a O2和80 ℃下,可有效地将炔丙基醇R1CH(OH)C CR2氧化为相应的酮(见式(34))。R1为芳基、烯基和炔基醇时的反应活性比R1为烷基醇时高。如以VO·(hfac)2为催化剂,加入六氟乙酰丙酮添加剂,可提高乙炔醇的收率,但对苄基、烯丙基和脂肪醇的氧化效果中等。ESR表征结果显示,在反应过程中当底物醇和O2共同存在时,V4+转化成为V5+。基于上述研究,他们假设了V催化氧化炔丙基醇的反应机理(见图9)。从图9可看出,V4+物种(9A)首先与炔丙基醇和O2反应形成V5+物种(9B),9B进一步和醇反应形成钒醇盐物种(9C),9C通过βH消除得到产物和二羟基V物种(9D),9D被O2氧化再产生9B,从而完成一个催化循环。
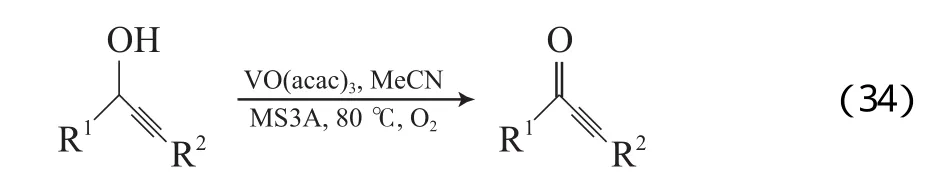
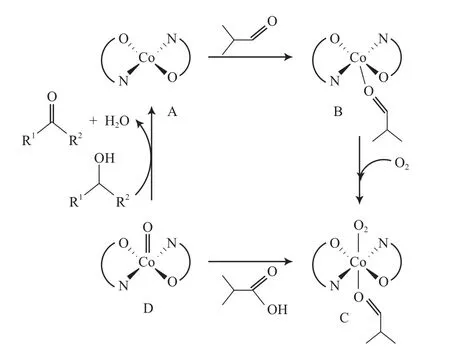
图8 Kalra等提出的Co(Ⅱ)希夫碱体系的反应机理Fig.8 Mechanism for the Co-salen catalyzed aerobic alcohol oxidation proposed by Kalra.
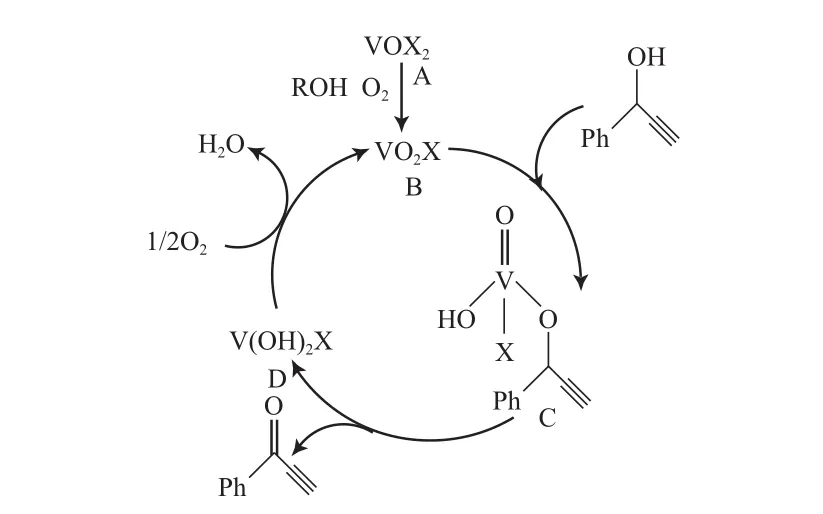
图9 V催化炔丙基醇氧化的机理Fig.9 Proposed reaction mechanism for the V-catalyzed aerobic oxidation of propargylic alcohols.
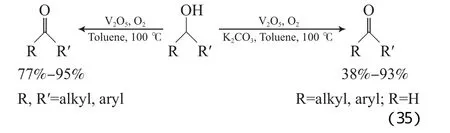
Velusamy等[63]报道了V2O5催化体系,该体系不加K2CO3时能有效地将仲醇氧化为相应的酮,将伯醇氧化为相应的酯;加入50%(x)K2CO3时,能有效地将伯醇氧化为相应的醛(见式(35))。当脂肪伯仲醇同时存在时,该体系能高选择性氧化仲醇。他们认为,不加K2CO3时体系的pH=6,在此条件下,生成的醛和醇互相反应生成半缩醛,半缩醛进一步可氧化为酯。
Jiang等[64]报道了VO(acac)2/三乙烯二胺(DABCO)体系,该体系以离子液体1-丁基-3-甲基六氟磷酸盐([bmim]PF6)为溶剂,在0.1 MPa O2和95 ℃的条件下,可有效氧化活泼苄基及烯丙基醇为相应的醛。如加入少量铜盐,并以离子液体1-己基-3-甲基咪唑三氟甲烷磺酸盐([hmim]OTf)为溶剂时,可将活泼苄基和烯丙基醇氧化为相应的酸(见式(36))。上述催化体系循环使用3次后,反应活性无明显降低。

Du等[65]报道了VOSO4/NaNO2催化体系,该体系以乙腈为溶剂,在0.5 MPa O2、80 ℃、痕量水存在的条件下,能有效氧化苄基伯醇为相应的醛(见式(37)),但对非活泼的仲醇氧化效果差。他们认为,水的存在有利于亚硝酸的形成,进而释放出氮氧化合物作为O2和V作用的桥梁,活性物种不是VOSO4,而是V5+(V的氧化循环见图10)。
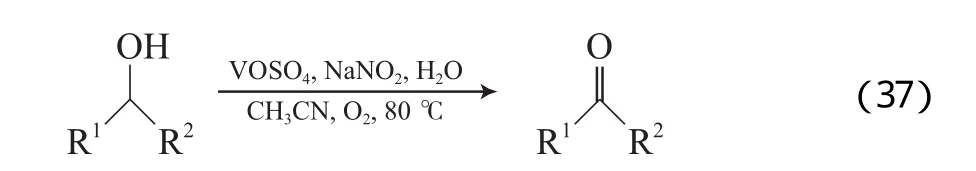
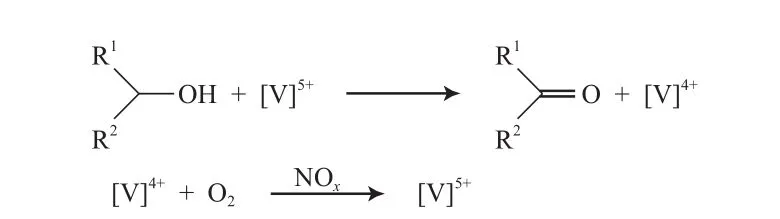
图10 V的氧化循环Fig.10 Vanadium redox cycle.
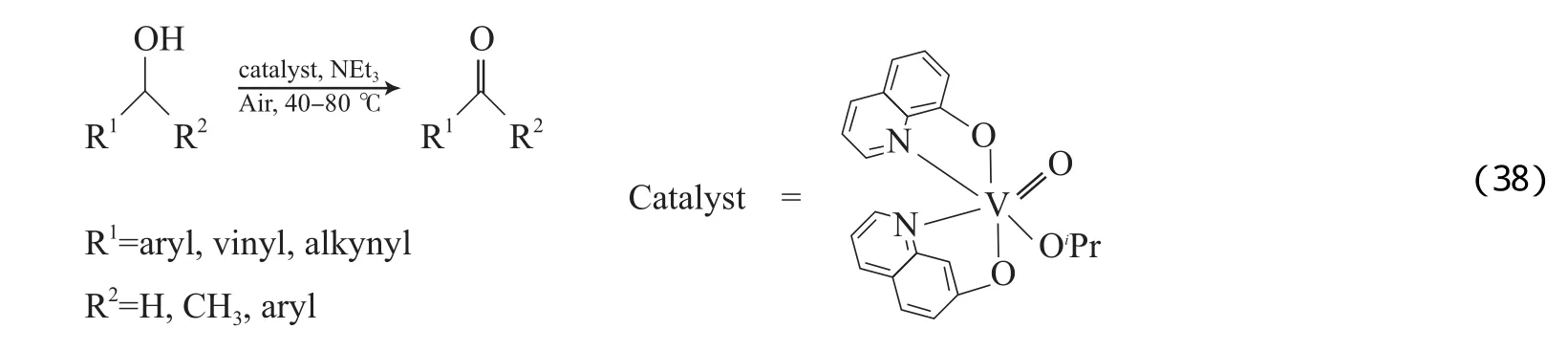
上述V催化体系均以O2为氧源,如采用空气代替纯O2可降低有机溶剂与高压纯O2加热时的危险。Hanson等[66]报道了(HQ)2VⅤ(O)(OiPr)/NEt3(HQ为8-羟基喹啉铜)催化体系,该体系以1,2-二氯乙烷为溶剂,在空气为氧源的温和条件下可有效氧化苄基醇、烯丙基醇和炔丙基醇为相应的醛和酮(见 式(38))。
1.5 Ru催化体系
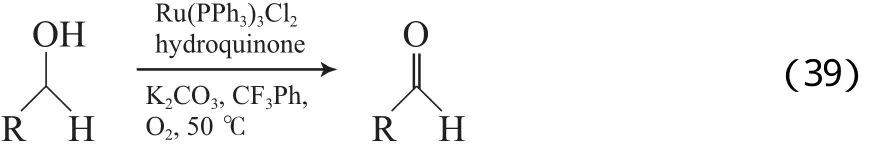
Hanyu等[67]报道了Ru(PPh3)3Cl2/羟基喹啉/K2CO3催化体系,该体系以三氟甲苯为溶剂,在0.1 MPa O2和50 ℃的条件下,能有效氧化脂肪伯醇为相应的醛(见式(39))。该体系的选择性高,在脂肪伯仲醇同时存在时,能选择性氧化脂肪伯醇。该体系对苄基和烯丙基伯醇也具有很好的氧化效果。
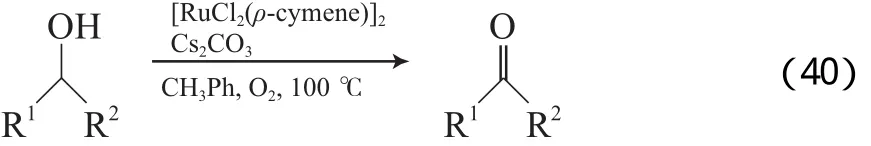
Lee等[68]报道了[RuCl2(ρ-cymene)]2/Cs2CO3体系,该体系以甲苯为溶剂,在O2氛围和100 ℃的条件下,能高效氧化苄基、烯丙基醇为相应的醛或酮(见式(40)),但对脂肪醇的氧化效果差。
Dijksman等[69]报道了Ru(PPh3)3Cl2/2,2,6,6-四甲基哌啶氮氧自由基(TEMPO)体系,该体系以氯苯为溶剂,在1 MPa 空气和100 ℃的条件下,能有效氧化脂肪伯仲醇、苄基伯仲醇和烯丙基醇为相应的醛或酮(见式(41)),产物选择性均高于99%,伯仲醇均存在时,能选择性氧化伯醇。Hammett方程和动力学同位素方法的分析结果表明,反应不是以Ru O和TEMPO+的机理进行的,而是以金属氢化物机理进行(见图11)。从图11可看出,RuH2(PPh3)3与两分子的TEMPO反应形成配合物11A及一分子的TEMPOH。醇通过质子转移和配合物11A发生配体交换形成配合物11B和另一分子的TEMPOH。TEMPOH再被O2氧化为TEMPO,在无氧条件下,TEMPOH歧化为TEMPH和TEMPO。配合物11B通过βH消除得到产物及活性物种RuH2(PPh3)3。
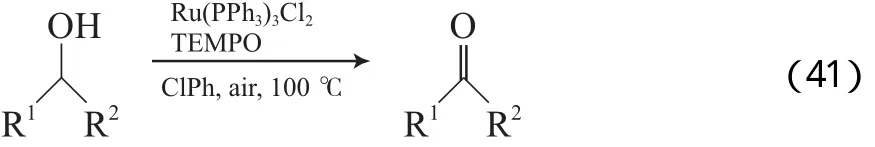
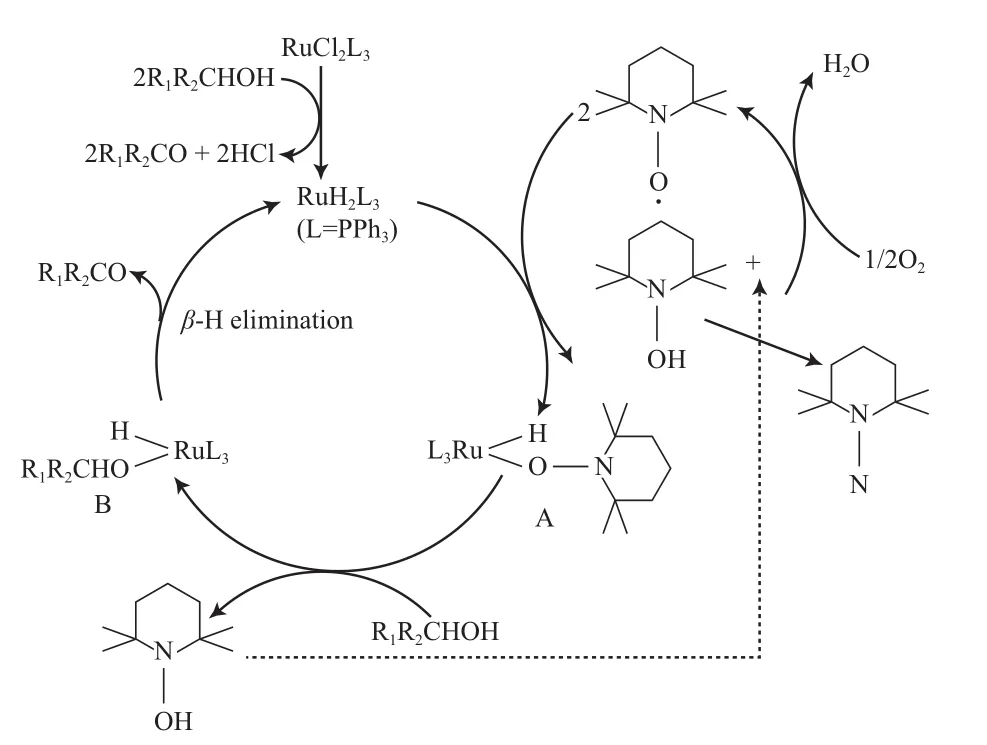
图11 Ru/TEMPO催化醇氧化的可能机理Fig.11 Proposed mechanism for the Ru/TEMPO-catalyzed aerobic oxidation of alcohols.
Csjernyik等[70]报道了Ru-醌催化体系的反应机理(见图12)。
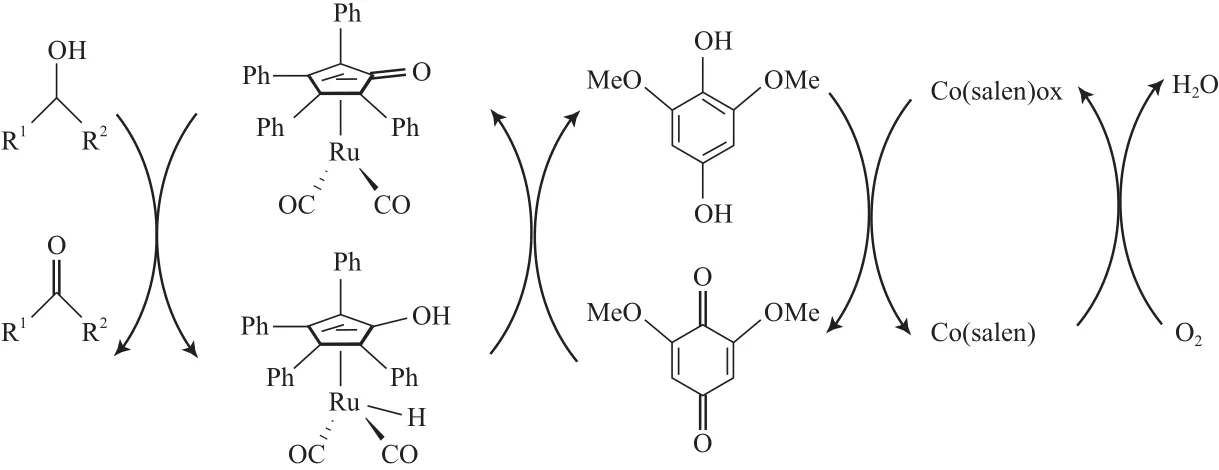
图12 Ru/醌催化体系的反应机理Fig.12 Mechanism of aerobic alcohol oxidation catalyzed by Ru/hydroquinone system.
从图12可 看出,Ru催化剂脱去醇上的质子, 然后将质子转移到富电子的醌上形成氢醌,氢醌再被Co(salen)活化的O2氧化为醌。该体系在以甲苯为溶剂、空气为氧源、100 ℃的条件下反应1~2 h,能有效氧化各种仲醇为相应的酮,与已报道的Ru催化体系相比,该体系具有高的转化效率(TOF),TOF=100~200 h-1。
Tashiro等[71]将Ru-salen催化剂(见图13)用于醇的氧化(见式(42)~(43))。催化剂13a以乙酸乙酯为溶剂,在可见光照射、室温和空气氛围条件下能有效氧化邻羟基苄基醇为相应醛。催化剂13b[53]在伯仲醇同时存在、可见光照射的条件下能选择性氧化伯醇。
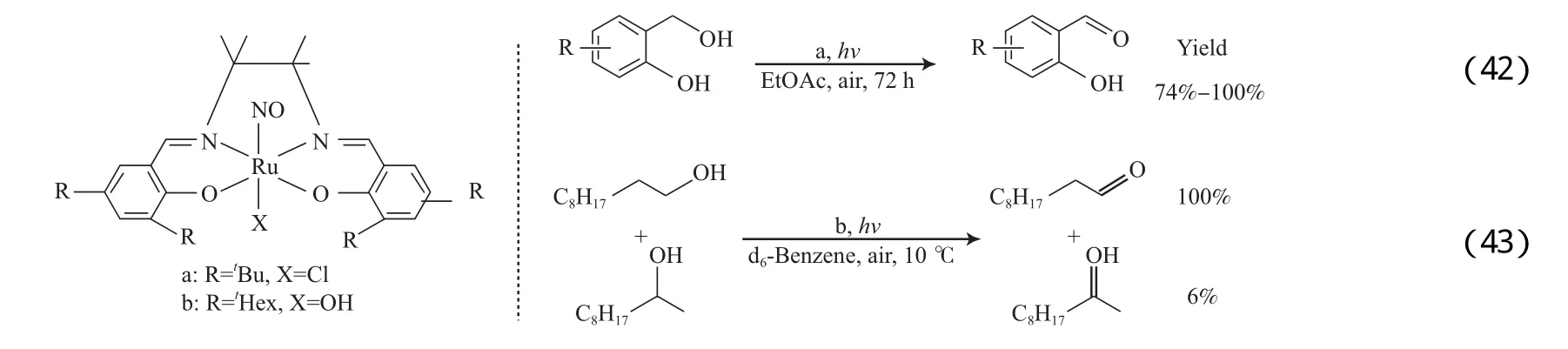
图13 Ru-salen催化剂Fig.13 Catalysts of Ru-salen.
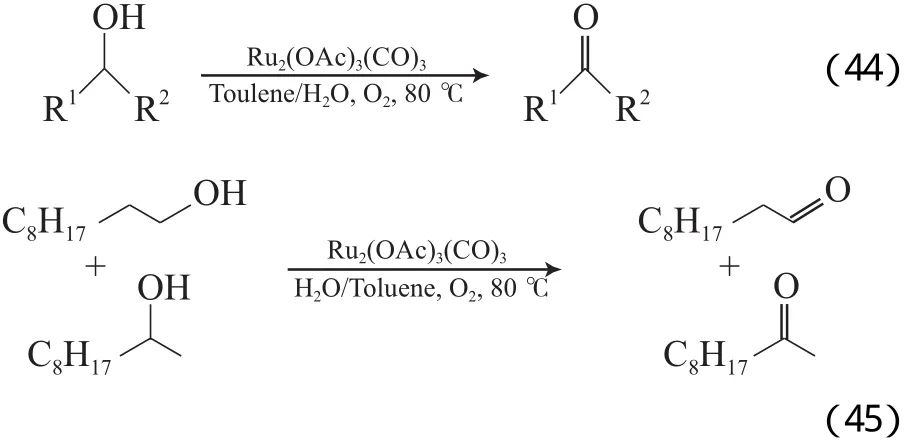
Komiya等[72]采用水溶性Ru2(μ-OAc)3(μ-CO3)催化剂,以甲苯和水为溶剂,在0.1 MPa O2和80 ℃的条件下,可有效氧化活泼苄基、烯丙基和α-酮醇(见式(44)~(45)),且对脂肪伯醇具有很高的选择性,催化剂循环使用3次后反应活性无明显降低。
Lloyd等[73]报道了RuCl3/Et3N催化体系,该体系在无溶剂条件下能有效实现伯仲醇的氧化。在最优条件下,催化苯甲醇的TOF=332 h-1。他们认为Et3N在反应中可能起两个作用:一是作为配体调节Ru(Ⅲ)的氧化还原性质;二是协助催化循环中醇盐物种的形成。添加少量水能大幅提高催化效率,这可能是因为,水能加快氯阴离子的解离,有利于Ru(Ⅲ)与配体和底物结合。
1.6 Pd催化体系
O2为末端氧化剂的Pd催化氧化反应可分为两个步骤:一是底物氧化;二是催化剂再生。Pd催化体系的设计目的是加快催化剂再生或减慢催化剂的聚集。1828年Berzelius首次报道了Pd氧化醇的反应。约140年之后,O2作为末端氧化剂,在Cu盐助催化剂的存在下,实现了Pd氧化醇的反应[74]。
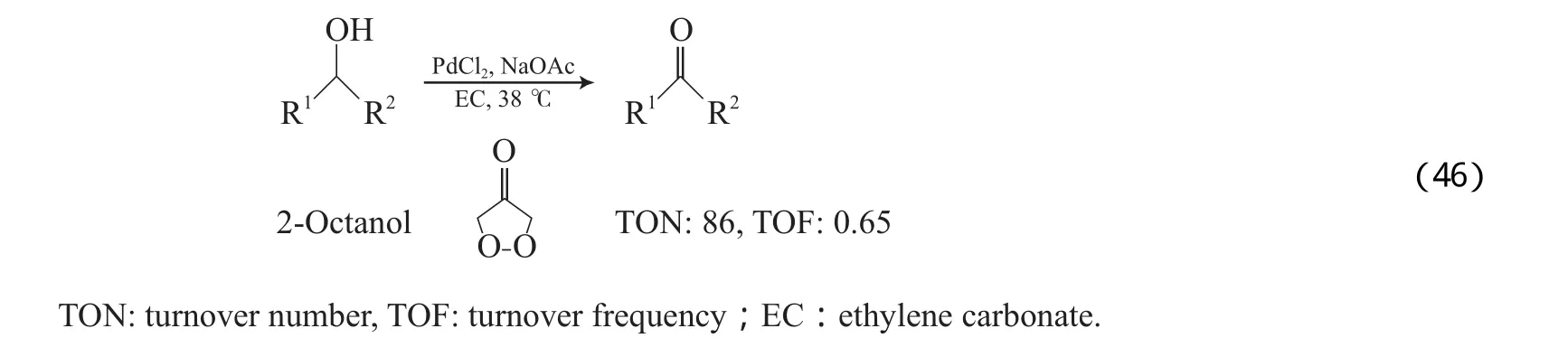
1977年Blackburn等[75]报道了无助催化剂、以O2为末端氧化剂的Pd催化体系,该体系以PdCl2为催化剂,醋酸钠为碱,碳酸乙烯酯为溶剂,在38℃和0.1 MPa O2的条件下,能氧化仲醇,但反应速率慢,如2-辛醇的TOF仅为0.65(见式(46))。
Peterson等[76]采用Pd(OAc)2催化剂,在以二甲基亚砜(DMSO)为溶剂、0.1 MPa O2和80 ℃的条件下,可将苄基和烯丙基醇氧化为相应的醛或酮(见式(47))。但该体系的反应速率慢(TOF<1),羰基化合物收率为42%~95%。当底物为仲醇时,加入NaHCO3或K2CO3可显著加快反应速率。其他钯源(如PdCl2,Pd(OCOCF3)2,Pd(dba)2)的反应效果较差,醋酸盐的反应效果没有碳酸盐好。
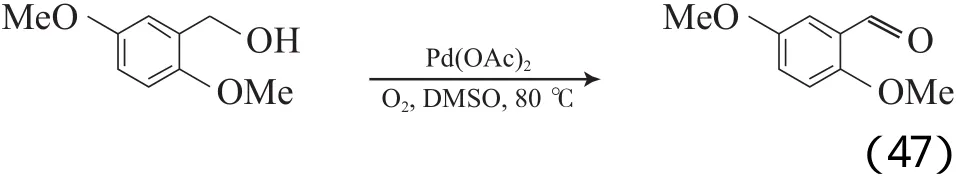
Steinhoff等[77]对Pd(OAc)2/DMSO体系催化醇氧化的机理进行了研究(见图14)。研究结果表明,DMSO作为溶剂并未参与氧化反应,其N和O原子能与Pd配位,对Pd有一定的稳定作用,从而有利于Pd(0)与Pd(Ⅱ)氧化还原的循环。
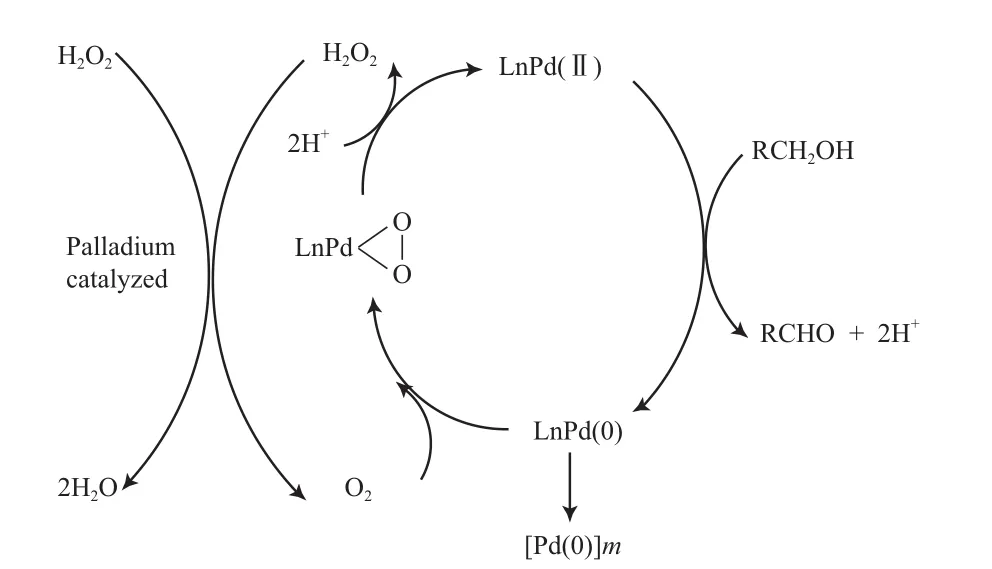
图14 Pd(OAc)2/DMSO体系催化醇氧化的机理Fig.14 Catalytic mechanism of Pd(OAc)2/DMSO catalyst system.DMSO:dimethylsulfoxide.
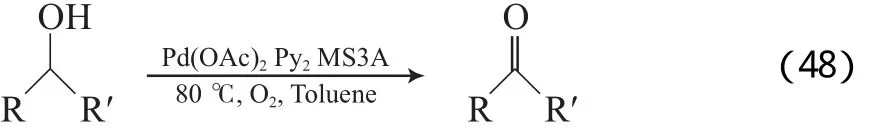
Nishimura等[78-79]报道了一种高效Pd(OAc)2/吡啶/MS3A催化体系,该体系以甲苯为溶剂,在0.1 MPa O2和80 ℃的条件下能有效氧化各种醇为相应的醛或酮(见式(48)),产物收率为80%~100%。其他Pd源(如PdCl2,Pd(OCOCF3)2,Pd(dba)2,Pd(PPh3)4,[(CH3CN)2PdCl2])无催化效果。吡啶衍生物中吡啶的效果最好,联吡啶反而会抑制反应的进行。研究结果表明,MS3A可加速H2O2的分解。该体系的反应机理见图15。
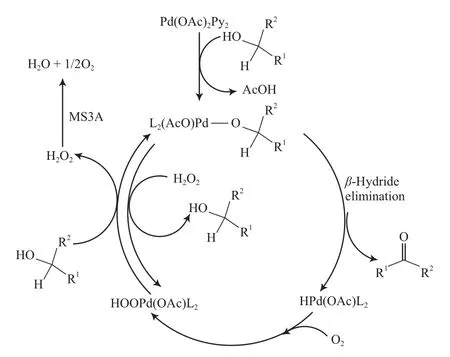
图15 Pd(OAc)2/吡啶/MS3A体系催化醇氧化的机理Fig.15 Mechanism for the Pd(OAc)2/pyridine/MS3A system catalyzed aerobic alcohol oxidation.
从图15可看出,Pd2+作为活性物种存在于整个反应过程。反应过程中形成的Pd氢物种并未分解为Pd0,而是与O2作用形成Pd氢过氧物种,然后进一步与醇作用形成Pd醇盐,完成催化循环过程。吡啶与Pd配位形成稳定的Pd氢物种,可抑制其还原消除HX生成Pd0。
ten Brink等[80]以4,7-二苯基-1,10-二氮杂菲磺酸钠盐配位的PhenS-Pd(OAc)2催化剂,在100 ℃、3 MPa空气、水溶液中有少量醋酸钠存在的条件下,将伯仲脂肪醇、苄基醇和烯丙基醇氧化为相应的醛或酮,产物收率为79%~93%(见式49)。反应机理见图16。从图16可看出,在反应体系中存在羟基桥连的二聚Pd物种;NaOAc夺取醇羟基上的质子,有利于Pd醇盐的形成;通过βH消除生成产物、水和Pd0物种;Pd0物种与O2作用形成一种Pd过氧化物;Pd过氧化物与Pd0物种生成原来的二聚Pd的物种,完成催化循环。NaOAc作为碱可夺取羟基上的质子,又可加快反应速率,有利于Pd0的再氧化,避免了Pd黑的形成。
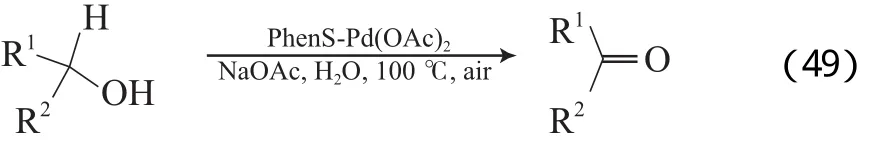
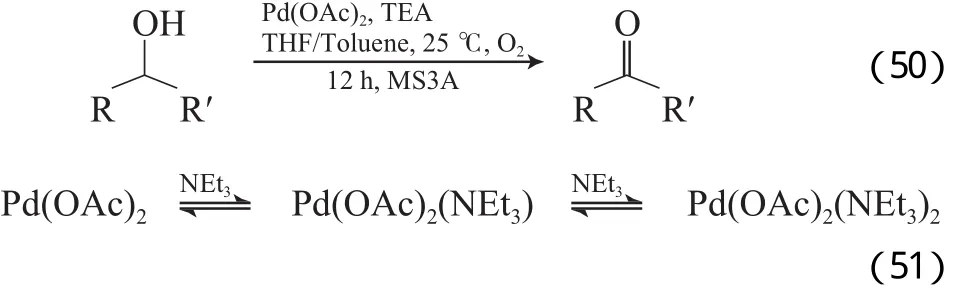
Schultz等[81]报道了Pd(OAc)2/三乙基铝(TEA)催化体系,该体系在室温及O2条件下,能有效地氧化苄基醇和脂肪醇,但对烯丙基醇的催化活性低(见式50)。NMR表征结果显示,反应体系中存在3个平衡的Pd物种,分别为Pd(OAc)2,Pd(OAc)2(NEt3),Pd(OAc)2(NEt3)2(见式(51)),随TEA含量的增大,反应平衡向右移动,这解释了过量的TEA能抑制反应的进行,Pd(OAc)2(NEt3)应为反应的活性物种。
Jensen等[82]采用Pd(OAc)2-N-杂环卡宾(NHC)催化剂,以甲苯为溶剂,在O2或空气氛围中氧化了各种醇为相应的醛或酮,转化数(TON)高达1 000(见式(52)~(53))。研究结果表明,配体NHC能有效稳定Pd0,O2将Pd0氧化为活性Pd2+。当存在少量醋酸(2%(x))时,催化剂表现出更高的反应活性,当醋酸含量增至5%(x)、用空气取代纯O2时,稍微延长反应时间也可得到很好的反应结果。从催化剂晶体结构看,H2O中的H与醋酸根上的O形成氢键,在反应过程中,醋酸盐作为催化剂上的碱有利于Pd醇盐中间体的形成。分析结果表明,在未加入醋酸时,醇氧化的速率比活性催化剂再生的速率快,从而导致催化剂分解速率快并聚集成无活性的Pd黑。Pd(OAc)2-NHC/HOAc体系催化醇氧化的机理见图17。从图17可看出,加入醋酸减慢了整个反应过程,使得醇盐再质子化,但也使醇氧化速率和Pd催化剂的再生速率维持了一个平衡,从而避免了催化剂的分解聚集。
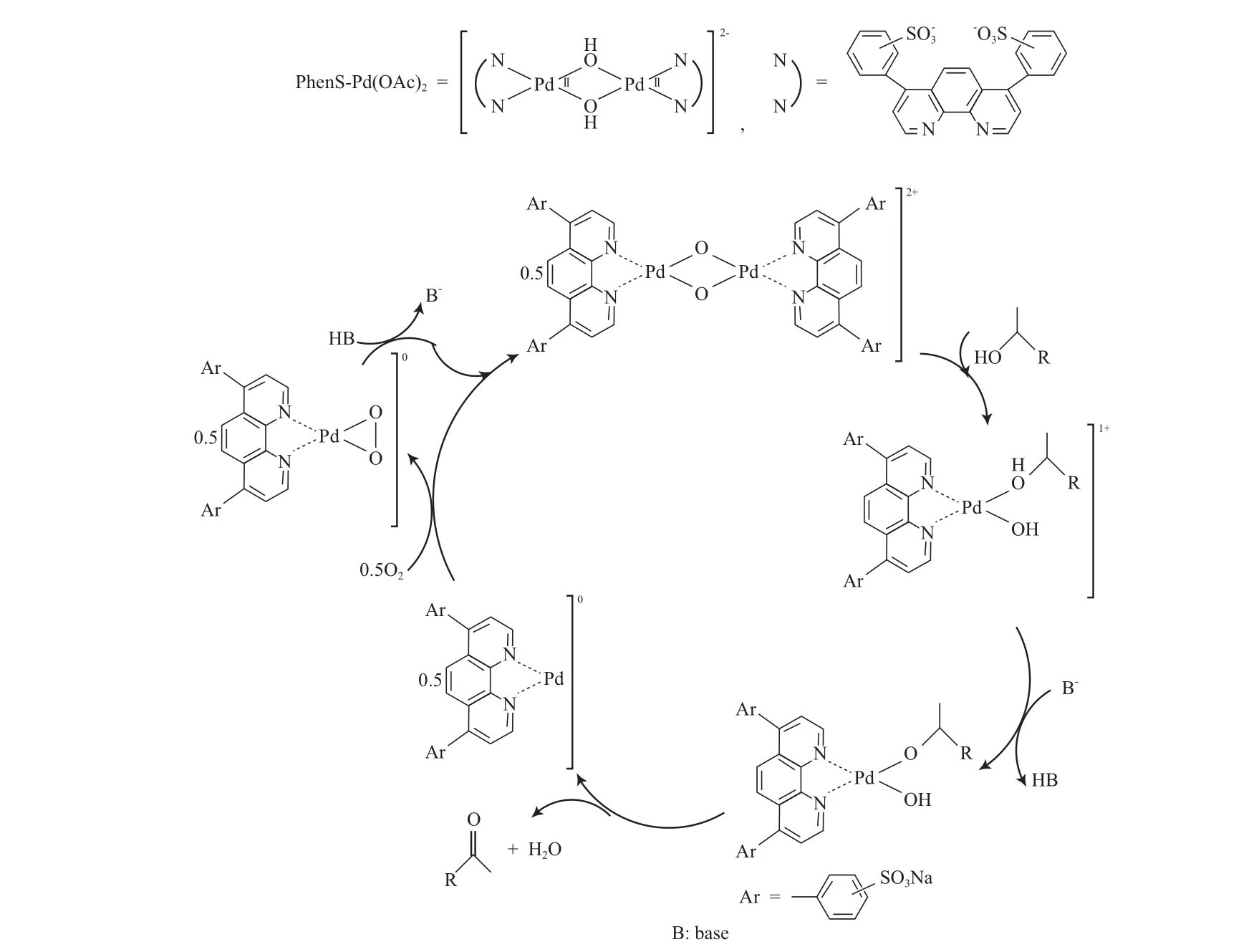
图16 PhenS*Pd(Ⅱ)体系催化醇氧化机理Fig.16 Mechanism proposed for alcohol oxidation with the aqueous-soluble PhenS*Pd(Ⅱ) catalyst.
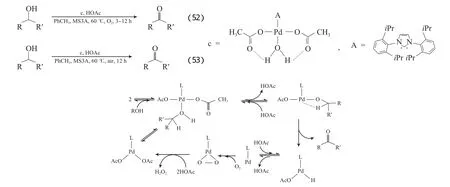
图17 Pd(OAc)2-NHC/HOAc体系催化醇氧化的机理Fig.17 Mechanism for Pd(OAc)2-NHC/HOAc catalyzed aerobic alcohol oxidation.
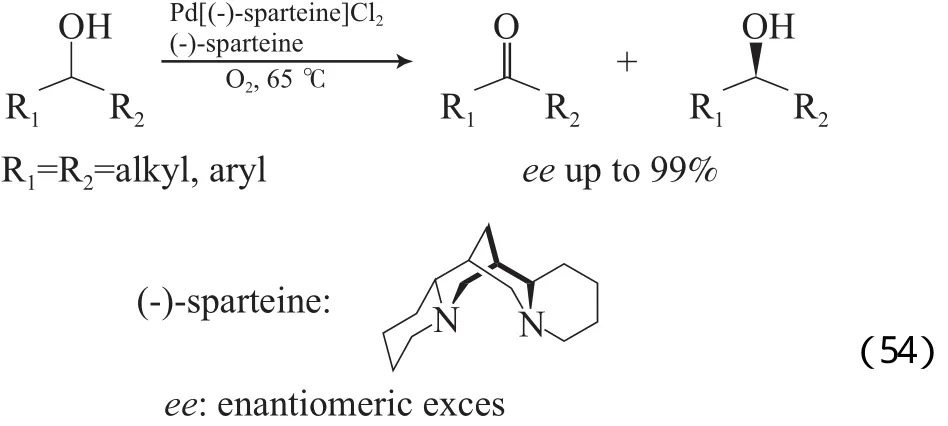
Jensen等[83-84]还报道了用手性Pd(Ⅱ)/(-)-sparteine为催化剂用于醇的动力学拆分(见式(54)),该体系对芳香醇和脂肪醇也适用。机理研究结果表明,过量(-)-sparteine配体的存在,使反应能够获得高的对映体过量(ee)值,其作用是脱H和作手性配体。Ferreira等[85-86]也报道了用(-)-sparteine配体取代Pd(OAc)2/吡啶/MS3A体系中的吡啶,得到了与Pd(OAc)2/TEA体系类似的催化效果(见式(55))。该催化体系适用于环醇和烯丙醇的氧化拆分,添加Cs2CO3和t-BuOH能加快反应速率。
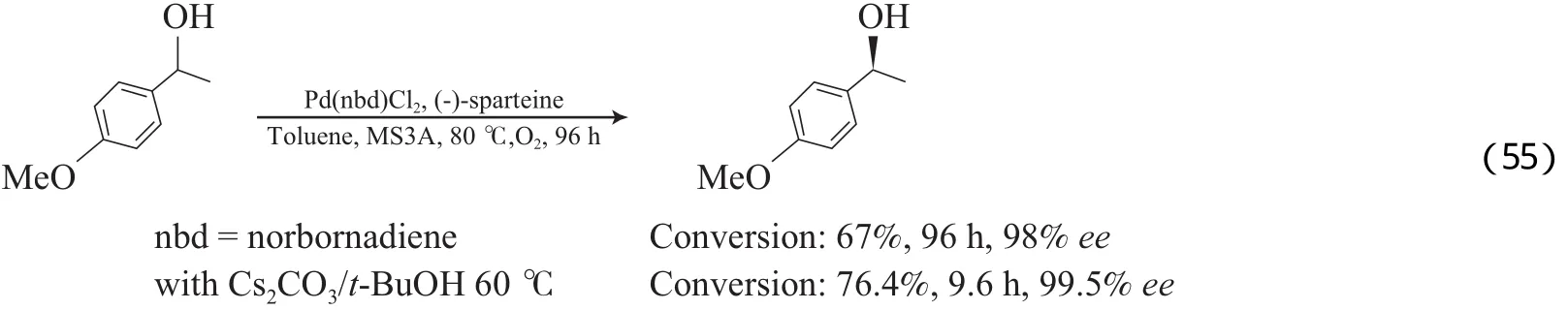
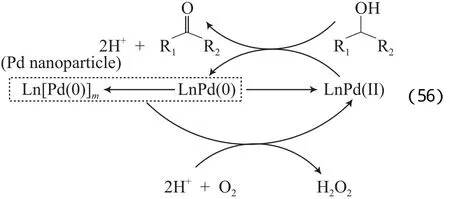
2011年,本课题组[87]研究发现,采用N,N-二甲基乙酰胺(DMA)为溶剂时,PdCl2/NaOAc能有效地催化O2将醇选择性氧化为相应的醛或酮。对该体系做进一步研究发现(见式(55)),在反应过程中原位产生了Pd纳米粒子,DMA能稳定该Pd纳米粒子,该稳定作用有利于Pd0的再氧化,反应中的实际活性物种为Pd2+。
1.7 Au催化体系
Au是有机合成中非常重要的催化剂,但有关均相Au催化的醇氧化体系的报道很少。Guan等[88]报道了AuCl/β-二亚胺-2,6-二异丙基苯催化体系,该体系以甲苯为溶剂,O2为氧化 剂,9 0 ℃下能氧化苄基和烯丙基醇为相应的 醛或酮(见式(57)),也能将非活泼的脂肪仲醇氧化为相应的酮。但氧化脂肪伯醇时,转化率和收率一般,并有少量α,β不饱和醛生成。
2 非金属催化体系
Liu等[89]报道了O2为末端氧化剂的TEMPO/Br2/NaNO2催化体系。该体系以二氯甲烷为溶剂,在80 ℃、0.4~0.9 MPa空气的条件下,能高选择性氧化伯仲醇及含杂原子的醇为相应的醛或酮(见式(58))。反应机理见图18。从图18可看出,TEMPO被氧化为氮氧正离子,该氮氧正离子作为醇氧化的活性氧化剂,最初的TEMPO被氧化形成氮氧正离子为醇氧化的活性氧化剂,氧化醇为相应的醛或酮后,形成TEMPOH;TEMPOH被Br2再氧化为氮氧正离子,Br2被还原为HBr;在酸性条件下,NaNO2分解为NO和NO2;HBr能被NO2再氧化为Br2,本身还原为NO;NO能迅速被O2氧化为NO2,从而完成整个催化循环。
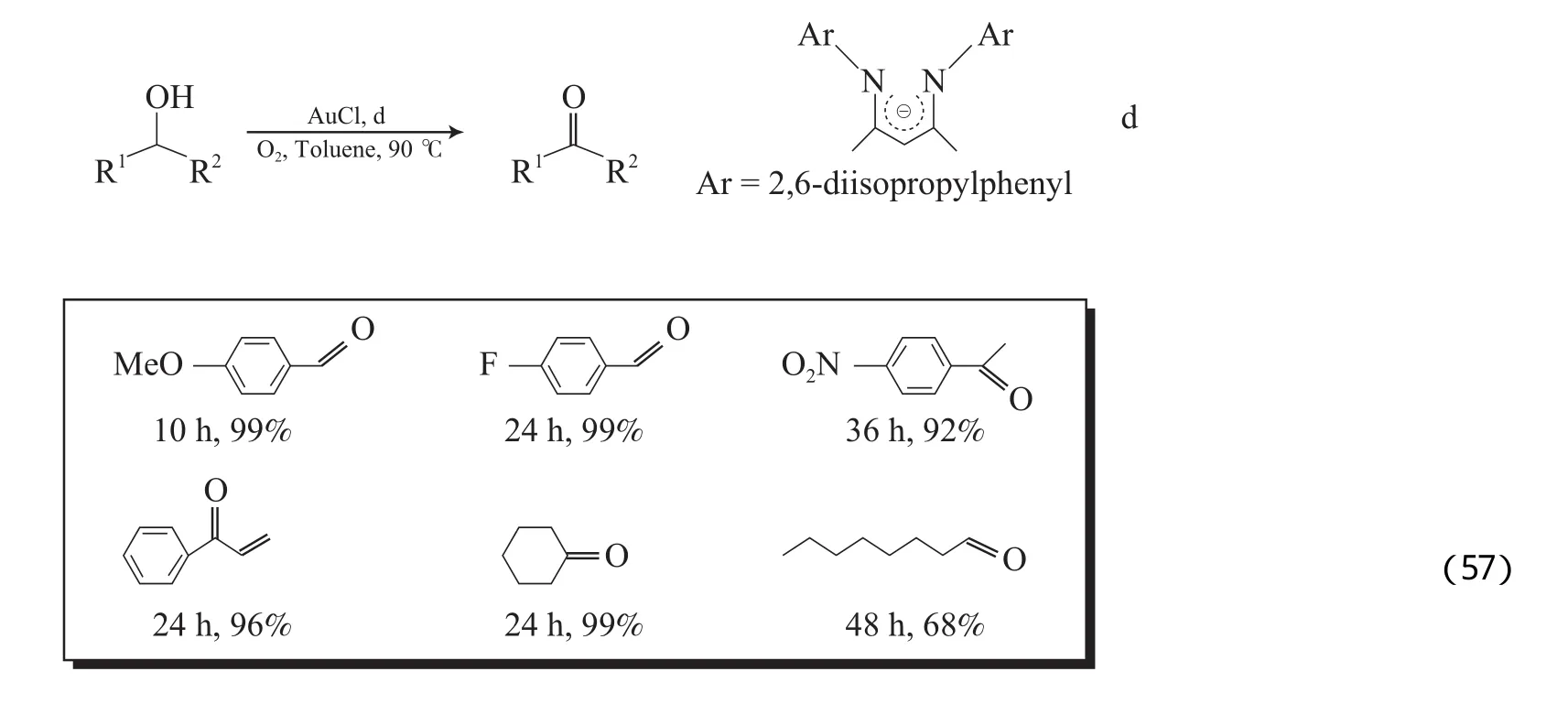
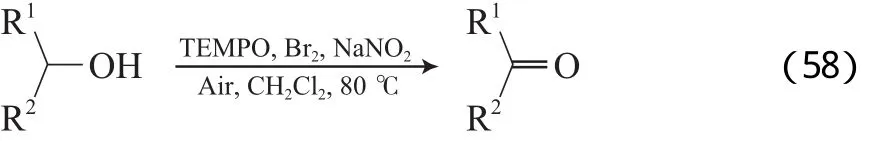
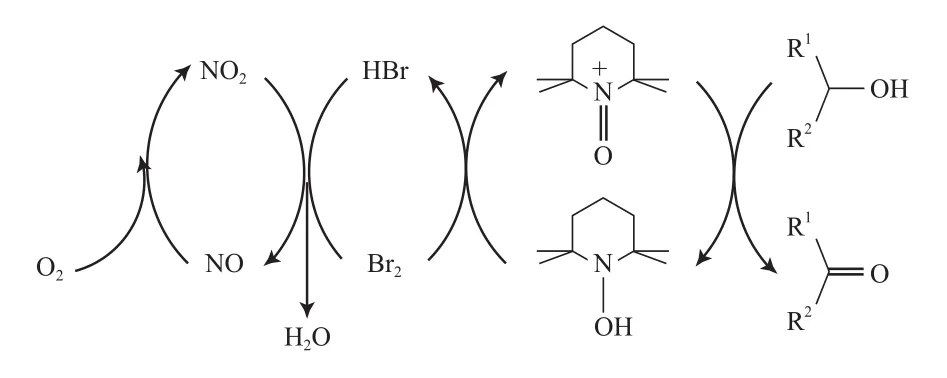
图18 TEMPO/NaNO2/Br2催化醇氧化的机理Fig.18 Proposed mechanism for TEMPO/NaNO2/Br2 catalyzed aerobic alcohol oxidation.
随后Liu[90]对TEMPO/Br2/NaNO2催化体系进行了改进,用1,3-二溴-5,5-二甲基乙内酰脲(DNDMH)代替Br2,以水为溶剂,活性基本未变。用亚硝酸叔丁酯(TBN)作NO来源,用HBr代替Br2得到TEMPO/HBr/TBN催化体系[91],该体系在优选的条件下能氧化各种醇为相应的醛或酮,且TON高达16 000。如用HCl代替毒性大的HBr[92],在室温和空气氛围条件下,能将各种醇(包括含双键、N、S的醇)氧化为相应的醛或酮。He等[93]研究发现,在以1,2-二氯乙烷为溶剂,不添加其他助催化剂时,TEMPO/TBN催化体系在0.2 MPa O2和80 ℃的条件下,能氧化苄基醇和脂肪伯仲醇为相应的醛或酮。但该体系对烯丙基醇的反应效果较差,对于肉桂醇只能得到13.6%的肉桂醛收率。
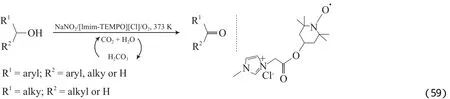
Miao等[94]采用TEMPO功能化的咪唑盐为可循环的催化剂,在原位酸性体系中氧化了脂肪、烯丙基、杂环和苄基醇为相应的醛和酮(见式(59))。该体系使用超临界CO2溶剂,反应环境安全、友好且产物和催化剂易分离。
Wertz等[95]采用羟胺原位产生的氮氧化合物参与TEMPO的醇选择性氧化反应,以1,2-二氯乙烷为溶剂,在0.3 MPa O2和80 ℃的条件下,将苄基醇和脂肪伯醇氧化为了相应的醛和酮(见式(60)),但对环己醇的氧化效果较差,优化条件下环己酮收率只有21%。
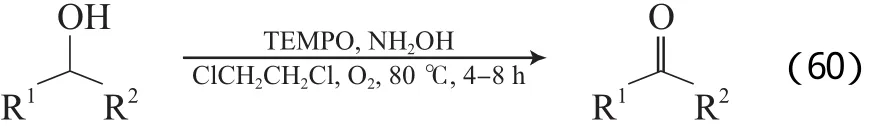
Shibuya等[96]对氮氧自由基(如TEMPO)催化醇氧化体系做了重要改进(见式(61))。通过合成了一系列氮氧自由基物种后发现,5-F-2-氮杂金刚烷-N-氧自由基和5-F-2-氮杂金刚烷-N-氧硝酸盐是高活性的氧化醇催化剂,氟基团在远离自由基基团的位置能显著增加活性,加快氮氧化合物和氮氧自由基间的直接电子转移。该体系能够氧化各种醇为相应的醛和酮,包括含羟基的糖类、核酸和氨基醇类。

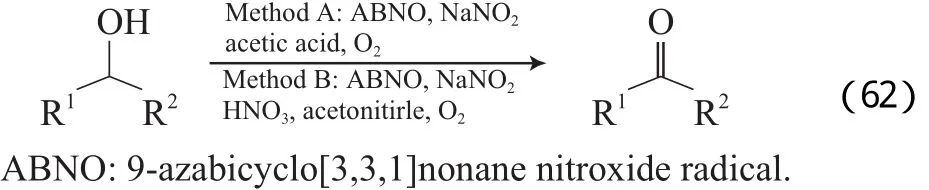
Lauber等[97]选择易合成的氮氧自由基9-氮杂双环[3.3.1]壬烷N-氧自由基(ABNO)或3-氧-9-氮杂双环[3.3.1]壬烷N-氧自由基(k etoABNO))结合NOx催化醇氧化(见式(62))。3种催化体系均能对各种醇进行氧化,由于ABNO类自由基的空间位阻小,对环己醇的氧化效果比TEMPO高,但对底物的选择有一些局限性,如氧化苯胺衍生醇时有偶氮化合物形成。
3 其他催化体系
2,3-二氯-5,6-二氰对苯醌(DDQ)作为一种高效的氧化剂,已被广泛应用于各种有机反应中。尽管DDQ在醇氧化中有很好的选择氧化效果,但早期报道中,多采用当量或过量的DDQ作为氧化剂,属于化学计量反应[98-99],DDQ接受H2后形成DDQH2,不再循环到原来的氧化态。由于DDQ价格较贵,因此开发催化量的DDQ氧化体系具有很高的应用价值。Cosner等[100]报道了以Mn(OAc)3为助氧化剂、DDQ为催化剂的醇氧化体系。该体系能选择性氧化富电子苄基醇和烯丙基醇为相应的醛和酮。尽管使用了大量的无机氧化剂在一定程度上降低了反应成本,但反应后大量的无机副产物也给后处理带来困难,且这些无机副产物也对环境有一定的污染。O2作为末端氧化剂时,其反应产物为水,符合绿色化学的要求。
2011年Shen等[101]报道了DDQ/TBN催化体系,该体系以1,2-二氯乙烷为溶剂,在0.2 MPa O2和80 ℃的条件下实现了对醇的氧化。
2012年本课题组[102]开发了一个温和、简单、实用的DDQ/NaNO2非金属催化体系,在O2或空气下选择性氧化,产物收率最高达97%。该体系在室温下能顺利的氧化炔醇为相应醛和酮,还能有效氧化木质素模型化合物。该体系选择性很高,在烯醇、炔醇和苄基醇共同存在时,优先氧化烯醇和炔醇;在烯醇和炔醇共同存在时,优先氧化烯醇;即使肉桂醇用量只有50 mmol,肉桂醛收率也能达到92%。该体系的应用价值很高。
4 结语
将醇选择性氧化为相应的醛或酮的研究已取得了很大的进展。尤其是在温和的反应条件下,Cu-TEMPO催化体系高选择性氧化非活泼伯醇为相应的醛,解决了非活泼脂肪伯醇难以在O2为氧源时氧化为醛的问题。另外,对于非金属TEMPONOx催化体系,开发其他氮氧自由基(如AZADO或ABNO)结合NOx可在温和条件下实现各种醇的氧化,扩大了底物范围,但这些体系均比较复杂,催化剂用量较大,尤其是TEMPO的价格昂贵。AZADO或ABNO这类氮氧自由基的合成较困难,难以扩大反应规模和进一步推广应用,故降低催化剂用量或实现氮氧自由基多相化是研究的一个重要方向。对均相贵金属催化体系的研究比较少,贵金属主要集中在多相催化体系中。DDQ催化剂用于醇的氧化表现出高的化学选择性,尤其是近年来开发的反应条件温和、低催化 量的DDQ催化体系,势必在有机合成中得到广泛应用。另外,基于半乳糖氧化酶实现伯醇选择性氧化为醛,不发生过度氧化,仿生催化也是实现非活泼伯醇氧化为相应醛的有效途径。
[52]Tovrog B S,Diamond S E,Mares F,et al.Activation of Cobalt-Nitro Complexes by Lewis Acids:Catalytic Oxidation of Alcohols by Molecular Oxygen[J].J Am Chem Soc,1981,103(12):3522-3526.
[53]Iwahama T,Sakaguchi S,Nishiyama Y,et al.Aerobic Oxidation of Alcohols to Carbonyl Compounds Catalyzed by N-Hydroxyphthalimide(NHPI)Combined with Co(acac)3[J].Tetrahedron Lett,1995,36(38):6923-6926.
[54]Iwahama T,Yoshino Y,Keitoku T,et al.Ef fi cient Oxidation of Alcohols to Carbonyl Compounds with Molecular Oxygen Catalyzed by N-Hydroxyphthalimide Combined with a Co Species[J].J Org Chem,2000,65(20):6502-6507.
[55]Kalra S J S,Punniyamurthy T,Iqbal J.Cobalt Catalyzed Oxidation of Secondary Alcohols with Dioxygen in the Presence of 2-Methylpropanal [J].Tetrahedron Lett,1994,35(27):4847-4850.
[56]Khanna V,Tamilselvan P,Kalra S J S,et al.Cobalt(Ⅱ)-Porphyrin Catalyzed Selective Functionalization of Alkanes with Sulfuryl Chloride:A Remarkable Substituent Effect[J].Tetrahedron Lett,19 94,35(32):5935-5938.
[57]Mandal A K,Iqbal J.A Versatile Aerobic Oxidation of Organic Compounds Catalyzed by Cobalt(Ⅱ)Porphyrins[J].Tetrahedron,1997,53(22):7641-7648.
[58]Sharma V B,Jain S L,Sain B.Cobalt(Ⅱ)Schiff Base Catalyzed Aerobic Oxidation of Secondary Alcohols to Ketones[J].J Mol Catal A:Chem,2004,212(1/2):55-59.
[59]Jain S L,Sain B.Cobalt Phthalocyaninetetrasulfonamide Catalyzed Aerobic Oxidation of α-Hydroxy Ketones:An Ef fi-cient and Simple Synthesis of α-Diketones[J].J Mol Catal A:Chem,2001,176(1/2):101-104.
[60]Sharma V B,Jain S L,Sain B.Cobalt Phthalocyanine Catalyzed Aerobic Oxidation of Secondary Alcohols:An Ef fi cient and Simple Synthesis of Ketones[J].Tetrahedron Lett,2003,44(2):383-386.
[61]Kirihara M,Ochiai Y,Takizawa S,et al.Aerobic Oxidation of α-Hydroxy Carbonyls Catalysed by Trichlorooxyvanadium:Efficient Synthesis of α-Dicarbonyl Compounds[J].Chem Commun,1999(15):1387-1388.
[62]Maeda Y,Kakiuchi N,Matsumura S,et al.Oxovanadium Complex-Catalyzed Aerobic Oxidation of Propargylic Alcohols[J].J Org Chem,2002,67(19):6718-6724.
[63]Velusamy S,Punniyamurthy T.Novel Vanadium-Catalyzed Oxidation of Alcohols to Aldehydes and Ketones Under Atmospheric Oxygen[J].Org Lett,2004,6(2):217-219.
[64]Jiang Nan,Ragauskas A J.Selective Aerobic Oxidation of Activated Alcohols into Acids or Aldehydes in Ionic Liquids[J].J Org Chem,2007,72(18):7030-7033.
[65]Du Zhongtian,Miao Hong,Ma Hong,et al.Trace Water-Promoted Oxidation of Benzylic Alcohols with Molecular Oxygen Catalyzed by Vanadyl Sulfate and Sodium Nitrite Under Mild Conditions[J].Adv Synth Catal,2009,351(4):558-562.
[66]Hanson S K,Wu Ruilian,Silks L A.Mild and Selective Vanadium-Catalyzed Oxidation of Benzylic,Allylic,and Propargylic Alcohols Using Air[J].Org Lett,2011,13(8):1908-1911.
[67]Hanyu A,Takezawa E,Sakaguchi S,et al.Selective Aerobic Oxidation of Primary Alcohols Catalyzed by a Ru(PPh3)3C12/Hydroquinone System[J].Tetrahedron Lett,1998,39(31):5557-5560.
[68]Lee M,Chang S.Highly Ef fi cient Aerobic Oxidation of Benzylic and Allylic Alcohols by a Simple Catalyst System of[RuCl2(p-Cymene)]2/Cs2CO3[J].Tetrahedron Lett,2000,41(39):7507-7510.
[69]Dijksman A,Marino-Gonzalez A,Mairata I Payeras A,et al.Ef fi cient and Selective Aerobic Oxidation of Alcohols into Aldehydes and Ketones Using Ruthenium/TEMPO as the Catalytic System[J].J Am Chem Soc,2001,123(28):6826-6833.
[70]Csjernyik G,Ell A H,Fadini L,et al.Efficient Ruthenium-Catalyzed Aerobic Oxidation of Alcohols Using a Biomimetic Coupled Catalytic System[J].J Org Chem,2002,67(5):1657-1662.
[71]Tashiro A,Mitsuishi A,Irie R,et al.(NO)Ru(Salen)-Catalyzed Aerobic Oxidation of o-Hydroxybenzyl Alcohol Derivatives[J].Synlett,2003(12):1868-1870.
[72]Komiya N,Nakae T,Sato H,et al.Water-Soluble Diruthenium Complexes Bearing Acetate and Carbonate Bridges:Highly Ef fi cient Catalysts for Aerobic Oxidation of Alcohols in Water[J].Chem Commun,2006(46):4829-4831.
[73]Lloyd W G.Homogeneous Oxidations of Alcohols with Palladium(Ⅱ)Salts[J].J Org Chem,1967,32(9):2816-2819.
[74]Guo Huajun,Liu Weidong,Yin Guochuan.Aerobic Oxidation of Alcohols to Aldehydes and Ketones Using Ruthenium(Ⅲ)/Et3N Catalyst[J].Appl Organometal Chem,2011,25(11):836-842.
[75]Blackburn T F,Schwartx J.Homogeneous Catalytic Oxidation of Secondary Alcohols to Ketones by Molecular Oxygen Under Mild Conditions[J].J Chem Soc,Chem Commun,1977(5):157-158.
[76]Peterson K P,Larock R C.Palladium-Catalyzed Oxidation of Primary and Secondary Allylic and Benzylic Alcohols[J].J Org Chem,1998,63(10):3185-3189.
[77]Steinhoff B A,Fix S R,Stahl S S.Mechanistic Study of Alcohol Oxidation by the Pd(OAc)2/O2/DMSO Catalyst System and Implications for the Development of Improved Aerobic Oxidation Catalysts[J].J Am Chem Soc,2002,124(5):766-767.
[78]Nishimura T,Onoue T,Ohe K,et al.Pd(OAc)2-Catalyzed Oxidation of Alcohols to Aldehydes and Ketones by Molecular Oxygen[J].Tetrahedron Lett,1998,39(33):6011-6014.
[79]Nishimura T,Onoue T,Ohe K,et al.Palladium(Ⅱ)-Catalyzed Oxidation of Alcohols to Aldehydes and Ketones by Molecular Oxygen[J].J Org Chem,1999,64(18):6750-6755.
[80]ten Brink G J,Arends I W C E,Sheldon R A.Green,Catalytic Oxidation of Alcohols in Water[J].Science,2000,287(5458):1636-1639.
[81]Schultz M J,Park C C,Sigman M S.A Convenient Palladium-Catalyzed Aerobic Oxidation of Alcohols at Room Temperature[J].Chem Commun,2002(24):3034-3035.
[82]Jensen D R,Schultz M J,Mueller J A,et al.A Well-De fi ned Complex for Palladium-Catalyzed Aerobic Oxidation of Alcohols:Design,Synthesis,and Mechanistic Considerations[J].Angew Chem,Int Ed,2003,42(32):3810-3813.
[83]Jensen D R,Pugsley J S,Sigman M S.Palladium-Catalyzed Enantioselective Oxidations of Alcohols Using Molecular Oxygen[J].J Am Chem Soc,2001,123(30):7475-7476.
[84]Mueller J A,Jensen D R,Sigman M S.Dual Role of(-)-Sparteine in the Palladium-Catalyzed Aerobic Oxidative Kinetic Resolution of Secondary Alcohols[J].J Am Chem Soc,2002,124(28):8202-8203.
[85]Ferreira E M Stoltz B M.The Palladium-Catalyzed Oxidative Kinetic Resolution of Secondary Alcohols with Molecular Oxygen[J].J Am Chem Soc,2001,123(31):7725-7726.
[86]Bagdanoff J T,Ferreira E M,Stoltz B M.Palladium-Catalyzed Enantioselective Oxidation of Alcohols:a Dramatic Rate Acceleration by Cs2CO3/t-BuOH[J].Org Lett,2003,5(6):835-837.
[87]Wang Lianyue,Li Jun,Lü Ying,et al.Aerobic Alcohol Oxidation Using a PdCl2/N,N-Dimethylacetamide Catalyst System Under Mild Conditions[J].J Organomet Chem,2011,696(20):3257-3263.
[88]Guan Bingtao,Xing Dong,Cai Guixing,et al.Highly Selective Aerobic Oxidation of Alcohol Catalyzed by a Gold(Ⅰ)Complex with an Anionic Ligand[J].J Am Chem Soc,2005,127(51):18004-18005.
[89]Liu Renhua,Liang Xinmiao,Dong Chunyan,et al.Transition-Metal-Free:A Highly Ef fi cient Catalytic Aerobic Alcohol Oxidation Process[J].J Am Chem Soc,2004,126(13):4112-4113.
[90]Liu Renhua,Dong Chunyan,Liang Xinmiao,et al.Highly Ef fi cient Catalytic Aerobic Oxidation of Benzylic Alcohols in Water[J].J Org Chem,2005,70(2):729-731.
[91]Xie Yi,Mo Weimin,Xu Dong,et al.Ef fi cient NO Equivalent for Activation of Molecular Oxygen and Its Applications in Transition-Metal-Free Catalytic Aerobic Alcohol Oxidation[J].J Org Chem,2007,72(11):4288-4291.
[92]Wang Xinliang,Liu Renhua,Jin Yu,et al.TEMPO/HCl/NaNO2Catalyst:A Transition-Metal-Free Approach to Efficient Aerobic Oxidation of Alcohols to Aldehydes and Ketones Under Mild Conditions[J].Chem Eur J,2008,14(9):2679-2685.
[93]He Xijun,Shen Zhenlu,Mo Weimin,et al.TEMPO-tert-Butyl Nitrite:An Ef fi cient Catalytic System for Aerobic Oxidation Of Alcohols[J].Adv Synth Catal,2009,351(1/2):89-92.
[94]Miao Chenxia,He Liangnian,Wang Jinglun,et al.Self-Neutralizing in situ Acidic CO2/H2O System for Aerobic Oxidation of Alcohols Catalyzed by TEMPO Functionalized Imidazolium Salt/NaNO2[J].J Org Chem,2010,75(1):257-260.
[95]Wertz S,Studer A.Hydroxylamine as a Source for Nitric Oxide in Metal-Free 2,2,6,6-Tetramethylpiperidine N-Oxyl Radical(TEMPO)Catalyzed Aerobic Oxidation of Alcohols[J].Adv Syn Catal,2011,353(1):69-72.
[96]Shibuya M,Osada Y,Sasano Y,et al.Highly Efficient,Organocatalytic Aerobic Alcohol Oxidation[J].J Am Chem Soc,2011,133(17):6497-6500.
[97]Lauber,M B,Stahl,S S.Efficient Aerobic Oxidation of Secondary Alcohols at Ambient Temperature with an ABNO/NOxCatalyst System[J].ACS Catal,2013,3(11):2612-2616
[98]Wang Wuyi,Li Tiechao,Attardo G.Synthetic Study of Selective Benzylic Oxidation[J].J Org Chem,1997,62(19):6598-6602.
[99]Becker H D,Bjöerk A,Adler E.Quinone Dehydrogenation.Oxidation of Benzylic Alcohols with 2,3-Dichloro-5,6-Dicyanobenzoquinone[J].J Org Chem,1980,45(9):1596-1600.
[100]Cosner C C,Cabrera P J,Byrd K M,et al.Selective Oxidation of Benzylic and Allylic Alcohols Using Mn(Oac)3/Catalytic 2,3-Dichloro-5,6-Dicyano-1,4-Benzoquinone[J].Org Lett,2011,13(8):2071-2073.
[101]Shen Zhenlu,Dai Jialiang,Xiong Jie,et al.2,3-Dichloro-5,6-Dicyano-1,4-Benzoquinone(DDQ)/tert-Butyl Nitrite/Oxygen:A Versatile Catalytic Oxidation System[J].Adv Syn Catal,2011,353(16):3031-3038.
[102]Wang Lianyue,Li Jun,Yang hua,et al.Selective Oxidation Of Unsaturated Alcohols Catalyzed by Sodium Nitrite and 2,3-Dichloro-5,6-Dicyano-1,4-Benzoquinone with Molecular Oxygen Under Mild Conditions[J].J Org Chem,2012,77(1):790-794.

