ALA和GNT对苹果果皮中多酚、酶活及相关基因的影响
白 鸽,郭玉蓉,陈 磊
(陕西师范大学食品工程与营养科学学院,陕西西安 710119)
ALA和GNT对苹果果皮中多酚、酶活及相关基因的影响
白 鸽,郭玉蓉*,陈 磊
(陕西师范大学食品工程与营养科学学院,陕西西安 710119)
目的:探究5-氨基乙酰丙酸(5-Aminolevulinic acid,ALA)和金雀异黄素(Genistein,GNT)对苹果果皮总酚含量、花青苷、相关酶活性以及基因表达量的影响。方法:在“秦阳”苹果摘袋时,分别用质量浓度为300mg·L-1的ALA、21.62μg·L-1的GNT、ALA+GNT(300mg·L-1的ALA和21.62μg·L-1的GNT 1∶1混合溶液)进行田间实验;并用全波长酶标仪测定处理后苹果皮总多酚、花青苷含量和相关酶活性,用荧光定量法测定各基因表达量。结果:苹果果皮颜色越红,花青苷含量越高,花青苷合成相关基因表达量越高;使用ALA处理过的苹果,果皮中总多酚含量最高,同时其多酚氧化酶(polyphenol oxidase,PPO)酶活性最低;对于苯丙氨酸解氨酶(phenylalanin ammonia-lyase,PAL)酶活性,用GNT和ALA处理过的苹果差异不显著且均高于其它处理。结论:ALA和GNT有利于花青苷的积累,可用于人工控制早、中熟苹果着色,以提高其市场竞争力。
5-氨基乙酰丙酸,金雀异黄素,多酚,酶活性,基因表达量
苹果因栽培品种和种植环境条件的不同,成熟苹果的大小、形状、颜色、酸甜度及其他品质特性差异很大[1]。果实外观品质,特别是红色果实着色程度既是一个品种的典型特征,也是果实品质与成熟度的重要指标,还是消费者选购时的重要依据[2],苹果的市场认可度主要由苹果表皮颜色决定:颜色越好的苹果,消费者越喜爱[3-5]。早、中熟苹果品种成熟时果皮颜色较差,严重影响了其市场竞争力[6]。而在果实色泽的形成过程,花青苷发挥着重要作用,其种类和分布状况与果实色泽密切相关[7]。当然,对于不同颜色的苹果,有关酶的活性及基因表达量也不相同。通过前人的研究,我们发现喷施外源5-氨基乙酰丙酸(5-Aminolevulinic acid,ALA)溶液和金雀异黄素(Genistein,GNT)溶液,可以极大的提高苹果的着色效果[8-9]。本实验为阐明不同颜色苹果外观品质与内在形成提供了理论研究,同时也为人工控制早、中熟苹果颜色形成,提高市场竞争力,扩大市场提供可行的理论依据。
1 材料与方法
1.1 材料与仪器
苹果 实验选择西北农林科技大学白水实验站的10年生“秦阳”苹果树。在苹果摘袋前,挑选5株10年生、树势接近的果树作为实验树。摘袋时分别用质量浓度为300mg·L-1ALA、21.62μg·L-1GNT、ALA+GNT喷施3株实验树阳面的大小一致、无病虫害及机械损伤的苹果,剩余的2株实验树,1株给予正常光照(Light)作为对照树,另1株作完全套袋黑暗(Dark)处理。每5d喷施一次,共4次,第20d时采收,用冰盒带回实验室,进行相关实验测定。PCR引物 生工生物工程(上海)股份有限公司合成;其它试剂 国产分析纯或化学纯。
PIKO REAL 96RT-PCR仪 美国Thermo公司;反转录cDNA试剂盒和荧光染料 生工生物工程(上海)股份有限公司;Multiskan Go全波长酶标仪 美国Thermo;TGL-16G高速低温离心机 上海安亭科学仪器厂;Dionex UPLC液相分析系统 美国Dionex公司和Dikma HPLC柱(250mm×4.6mm,5μm)。
1.2 花青苷含量和组分的测定
1.2.1 总花青苷含量测定 参照王延玲[10]的方法,稍加改动。取0.5g果皮,液氮充分研磨后加入2mL 1% HCl/甲醇溶液在4℃冰箱黑暗提取12h。用分光光度计测定提取液在553nm 和 600nm处吸光值。以每克果皮鲜重的提取液的光密度变化值D553 nm-D600 nm=0.01作为一个花青苷单位,用U表示。
1.2.2 花青苷组分测定 果皮用液氮研磨成粉末,按照料液比1∶4(g∶mL)加入1% HCl/甲醇溶液,4℃暗置浸提2h。将提取液在4℃、12000r/min 离心10min,上清液经0.22μm 的滤膜过滤后,取400μL转移至进样瓶中等待进样。Dionex UPLC液相分析系统(Dionex,美国)和Dikma HPLC柱(250mm×4.6mm,5μm);溶液A(乙腈)和溶液B(1‰三氟乙酸)。洗脱条件参照王延玲[10]的方法,稍加改动。利用溶液B进行梯度洗脱:0min,88% B;1min,88% B;15min,70% B;20min,70% B;25min,88% B;30% min,88% B。柱温 30℃流动相速度:1.0mL·min-1,进样量20μL,在500nm波长进行花青苷组成的检测,记录出峰时间,和标品进行比对鉴定花青苷的成分。
1.3 总酚含量测定
总酚测定标准曲线的绘制:用5mL 70%乙醇溶解0.2500g没食子酸,定容至50mL,分别移取0.5、1.0、1.5、2.5、5.0mL至容量瓶中,用水定容50mL,制备浓度分别为50、100、150、250、500mg·L-1的没食子酸溶液。从上述不同浓度的标准溶液中分别移取0.5mL加入到50mL容量瓶中后分别加入30mL去离子水,混匀,加入2.5mL Folin-Ciocalteu试剂,混匀后,加入7.5mL 20%碳酸钠溶液,混合,定容。将上述标准溶液在20℃下黑暗静置2h后,在765nm波长下测定吸光值,从而得到标准曲线[11-12]。
参照任文霞[13]的方法,稍加改动。每次用蒸馏水洗净实验果,滤纸吸干表面水分,粉碎,取1.0g果皮,加入20mL 70%乙醇,55℃超声辅助提取4次,定容至100mL。取1.0mL提取液,依次加入12mL饱和Na2CO3溶液和1.0mL福林酚溶液,定容至25mL。避光反应1h后,于765nm处检测OD值,通过标准曲线的换算,总多酚含量用没食子酸的当量值表示。
1.4 苯丙氨酸解氨酶(PAL)酶活性测
参照林植芳[14]的方法,略作修改。每次用蒸馏水洗净实验果,用滤纸吸干表面水分,粉碎后取0.5g果肉,加入5mL 0.05mol·L-1pH8.8的硼酸缓冲液(内含0.005mol·L-1β-巯基乙醇),然后加入0.1g 聚乙烯吡咯烷酮(PVP)和少许石英砂,冰浴下研磨成匀浆,4℃下12000r·min-1离心20min,上清液为酶液,用来测定酶活性。
酶活性测定反应体系:0.02mol·L-1L-苯丙氨酸(用0.1mol·L-1、pH8.8的硼酸缓冲液配制)1.0mL,0.05mol·L-1硼酸缓冲液2.0mL,1.0mL酶液,30℃水浴30min,在290nm处测定OD值。每克鲜重每分钟所引起吸光度变化 0.001为一个酶活力单位。
1.5 多酚氧化酶(PPO)酶活性测定
酶液的制备[15-16]:取3.0g果肉样品,加2mL 100mmol/L pH为5.5的醋酸缓冲溶液,冰浴研磨匀浆,在4℃条件下14000r/min离心30min,取上清液作为酶液,测定PPO酶活性。
PPO活性检测:反应体系为2mL 50mmol/L pH为5.5的醋酸缓冲溶液,0.6mL 1mol/L邻苯二酚溶液,0.2mL 酶液;从加入酶液1min开始,记录每分钟反应体系在420nm 波长的吸光度值,连续测定2min。以每分钟ΔOD420为一个酶活单位U。
1.6 实时定量RT-PCR
1.6.1 cDNA模版的制备 取-80℃冻存的苹果皮,采用改良的CTAB-LiCl法提取苹果皮总RNA[17],用快速RNA检测仪对RNA的浓度及纯度进行检测,选择OD260/OD280值在1.8~2.0之间的RNA,利用TaKaRa公司提供的cDNA试剂盒将苹果皮总RNA反转录成单链cDNA,并将cDNA浓度统一稀释至100ng·μL-1,-20℃保存备用,用cDNA模版进行实时定量RT-PCR。

表1 荧光定量引物序列Table 1 Quantitative primers
1.6.2 qRT-PCR扩增 根据候选基因的序列,用primer 5.0 软件设计引物,以苹果管家基因β-actin为内参,引物序列见表1,委托上海生工生物技术有限公司合成。荧光定量PCR以SYBR为荧光染料,采用10μL体系,包括:5.0μL SYBR premix Ex TaqTM(2*)反应液,0.2μL RcxDag(2*),上下游引物各0.4μL,cDNA模版2μL,加ddH2O补至10μL。混匀,离心,放入PCR仪扩增。反应程序为:95℃预变性30s;进行40个循环,循环条件为95℃,5s;n℃(n为摸索的各个基因退火温度),30s;60℃延伸30s;溶解温度从n℃到95℃每升高0.2℃保持1s。反应中设置空白对照,使用双蒸水为模版,每个样品重复三次。反应结束后记录Ct值,采用2-ΔΔCt法[18]进行数据分析。
1.7 数据统计分析
所有实验数据均重复3次以上,使用SPSS18.0数理统计分析软件进行显著性分析(Duncan分析),并用Excel进行作图。
2 结果与讨论
2.1 花青苷含量和组分的变化
总花青苷含量的检测结果如图1a所示。对于分别用A+G、GNT、ALA、Light、Dark 5种方法处理得到的不同颜色的苹果皮,(A+G)处理组颜色最红,GNT次之,ALA低于GNT,其果皮颜色越红,花青苷含量越高。A+G处理过的苹果,果皮中花青苷的含量显著(p<0.05)高于其它四种实验样果,是Light的3倍;Dark处理的样果花青苷含量则显著低于其它四种处理的样果,仅是Light组的0.05。另外,GNT和ALA处理过的苹果皮中花青苷的含量总和小于用A+G处理过的。由此可初步推断GNT与ALA均可促进花青苷积累,且二者具有协同作用。这与王中华[8]在苹果上和朱云娜[19]在葡萄上得到的实验结果是一致的。
通过高效液相色谱法,可以确定苹果皮中花青苷的主要组分为矢车菊素-3-半乳糖苷(Cyanidin-3-galactoside,Cy-3-gal),其相对含量如图1b所示。Dark处理的样果中未检出Cy-3-gal,这是因为Dark处理的果皮中花青苷含量本身极低,因此其中所含Cy-3-gal量过低,低于液相的检测下限浓度,导致未被检出。同时,完全套袋处理实验组的加入,证明了光照能显著增强花青苷的合成,这与俞明亮[20]的研究结果是相符合的。

图1 不同苹果果皮颜色对花青苷含量的影响Fig.1 Different color of apple peel impact on anthocyanin content and component注:不同小写字母表示不同处理得到的不同颜色苹果果皮中花青苷含量的差异显著(p<0.05),图2~图6同。
2.2 总酚含量的变化
总酚含量的标准曲线为:y=9.9680x+0.0030,R2=0.9989,其检测结果如图2所示。对于分别用5种方法处理得到的不同颜色的苹果皮,用ALA处理过的苹果果皮中多酚含量达到最高,为16.46mg没食子酸/g干物质,完全套袋处理的含量最低,为12.14mg没食子酸/g干物质,其余3种处理含量无显著性差异(p>0.05)。同时,也可以从图中看出,果皮颜色并未与总多酚含量呈正相关,果皮颜色越红,总酚含量不一定越高。这是因为苹果多酚的主要成分绿原酸、表儿茶素等与花青苷的主要成分Cy-3-gal之间存在一定的拮抗作用,结合图1a和图2:花青苷含量升高时多酚含量会有所下降;而多酚含量较高时,相对应的花青苷含量则较低,这与Jamil Harb等[21]的研究结果是一致的。
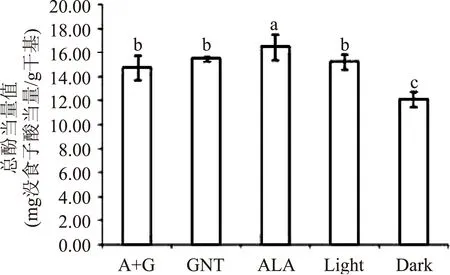
图2 不同苹果果皮颜色对总酚含量的影响Fig.2 Different color of apple peel impact on total phenol content
2.3 PAL酶活性测定
PAL酶活性的测定结果如图3所示,由图可以看出,随着苹果颜色逐渐变浅,PAL酶的活性呈现出先升高后降低的趋势,用GNT处理过的苹果其酶活性最强,而完全套袋处理的苹果PAL酶活性明显弱于其它处理样果,由此可以说明避光处理会极大的抑制PAL酶的活性。另外,由图可以看出用A+G、GNT、ALA处理过的苹果果皮中PAL酶活性均显著高于对照组,说明果皮颜色与酶活性显著相关。
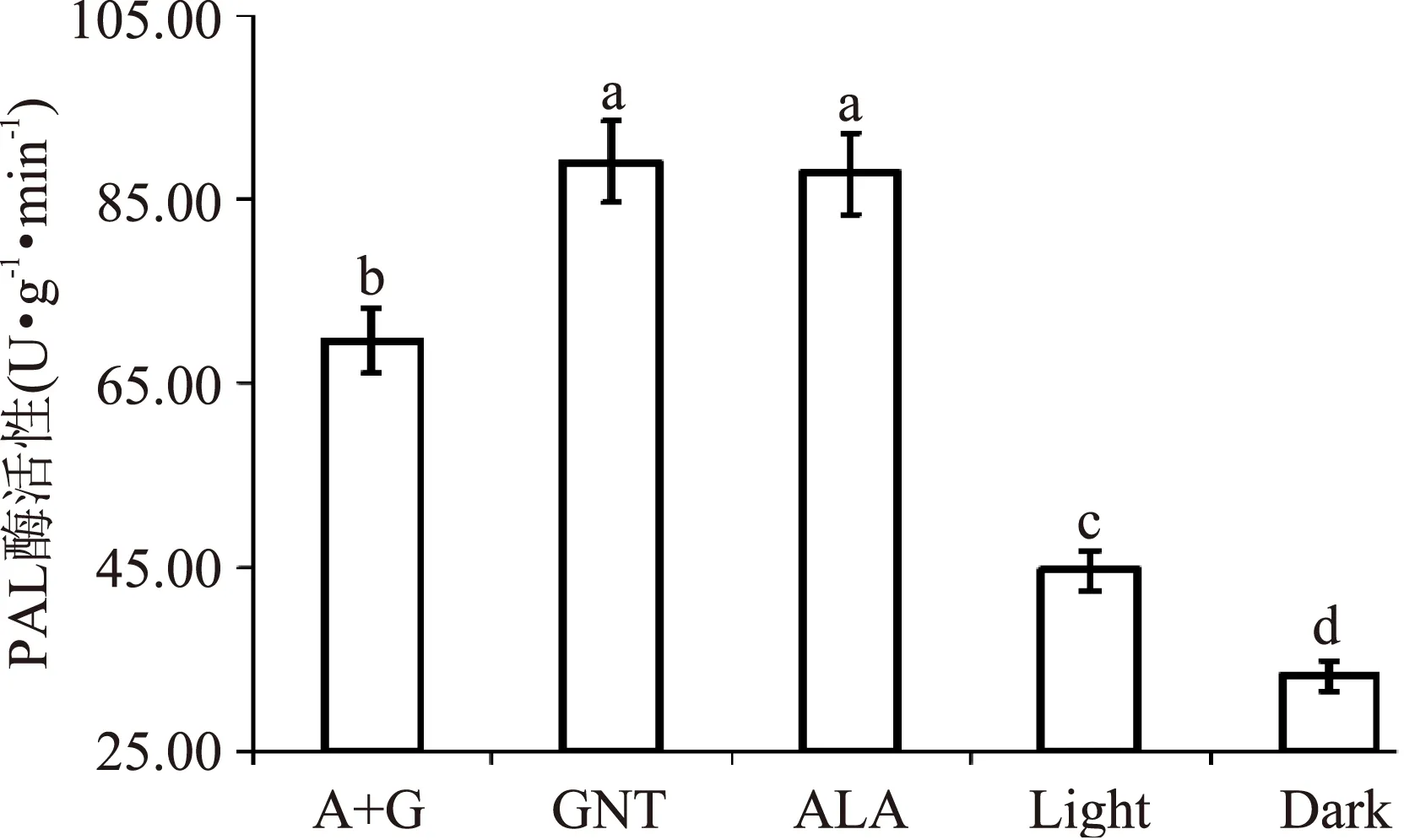
图3 不同苹果果皮颜色对PAL酶活性的影响Fig.3 Different color of apple peel impact on PAL enzyme activity
2.4 PPO酶活性测定
PPO酶活性的测定结果如图4所示,不同处理间的酶活性差异极为显著,其中酶活性最弱的是用ALA处理的苹果,酶活性最强的是Dark处理的苹果,其PPO酶活性为ALA处理果的1.5倍。当PPO酶活性较强时,苹果皮中的总多酚因分解较多而导致其含量将少于酶活性较弱时的总多酚含量,因此,图4所示的变化趋势与图2中总多酚含量的变化趋势是相符合的,即酶活性越强,苹果皮中总多酚含量越少,反之越多。由于ALA能诱导细胞抗氧化反应[22],喷施了ALA的苹果果皮中PPO活性受到了抑制,所以ALA处理果的PPO活性低于GNT处理果。至于为什么A+G处理果的PPO活性高于单独的ALA或GNT的处理果,还需要进一步进行实验加以研究。

图4 不同苹果果皮颜色对PPO酶活性的影响Fig.4 Different color of apple peel impact on PPO enzyme activity
2.5 相关基因测定结果
2.5.1 PAL基因 PAL基因相对表达量的测定结果如图5所示,随着苹果果皮颜色逐渐变浅,其基因相对表达量减小。其中完全套袋处理的苹果基因表达量最小,说明避光处理严重抑制了PAL基因的表达。另外,由图可以看出用A+G、GNT、ALA处理过的苹果果皮中PAL基因表达量均显著高于对照组,这一变化趋势与以上图3中PAL酶活性的变化结果相一致,符合基因与酶的生物变化关系。
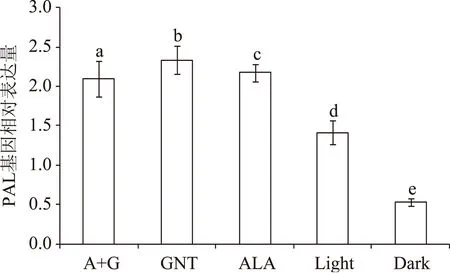
图5 不同苹果果皮颜色对PAL基因相对表达含量的影响Fig.5 Different color of apple peel impact on relative expression of PAL
2.5.2 CHS、CHI、ANR、FLS及MYB10基因 CHS、CHI、ANR、FLS及MYB10基因的相对表达量的测定结果如图6所示,同样地,随着苹果果皮颜色的逐渐变浅,其基因相对表达量呈现出减小趋势,均为A+G处理过的苹果果皮的基因相对表达量最高,完全套袋处理的苹果果皮的基因相对表达量最低。这一结果与图1苹果皮中花青苷含量的变化趋势是相一致的。
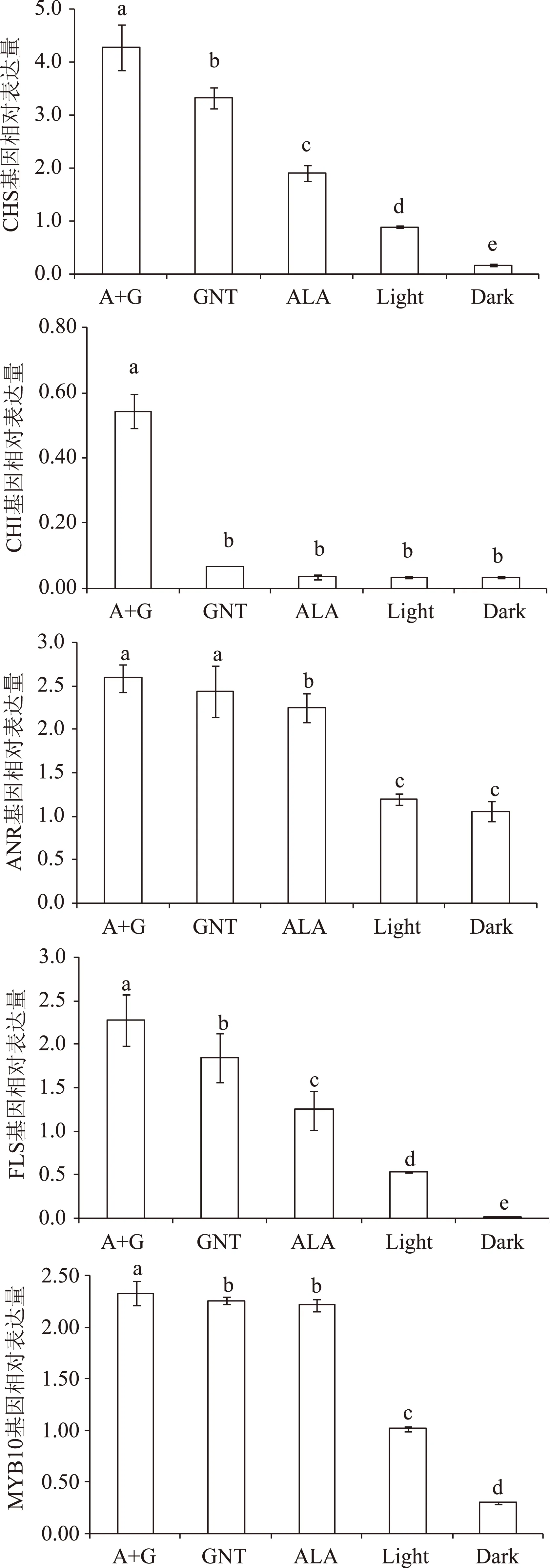
图6 不同苹果果皮颜色对五种基因相对表达含量的影响Fig.6 Different color of apple peel impact on relative expression of genes
以上结果中,果皮多酚的变化规律、PAL酶活性变化规律和PAL基因表达变化规律三者相吻合,果皮花青苷的变化规律和相关基因表达变化规律相吻合,这与前人的研究规律相同[18,23-24],并再次验证了“基因控制酶的合成,酶控制产物的合成”这一生物学规律。
3 结论
ALA和GNT混合使用,具有协同作用,以寻求苹果着色最高效的方法,从实验结果也可以看出,就苹果着色而言,在苹果摘袋后ALA和GNT混合作用,对苹果进行连续喷施处理有利于果皮中花青苷的积累,使苹果在采收时具有良好的色泽,极大地提高了苹果果实外观品质,因此可用于人工控制早、中熟苹果着色,改善早、中熟苹果着色效果,从而提高其市场竞争力,这对实际生产有极大的实用意义。
[1]白沙沙,毕金峰,方芳,等.苹果品质评价技术研究现状及展望[J].食品科学,2011,32(3):286-290.
[2]谢荔.ALA诱导葡萄和苹果果皮花青素积累机理的研究[D].南京:南京农业大学,2012.
[3]Sauce M C.External control of anthocyanin formation in apple[J].Sci Hort,1990,42:181-218.
[4]Cliff M,Sandford K,Wismer W,et al.Use of digital images for evaluation of factors responsible for visual preference of apples by consumers[J].Hort Sci,2002,37:1127-1131.
[5]Boyer J,Liu R H.Apple phytochemicals and their health benefits[J].Nutr J,2004,3:5.
[6]刘金.早熟苹果泰山早霞果实着色机理的初步研究[D].泰安:山东农业大学,2012.
[7]刘玉莲.不同色泽类型苹果着色期糖酸变化及花青苷合成特性研究[D].杨凌:西北农林科技大学,2013.
[8]王中华,汤国辉,李志强,等.5-氨基乙酰丙酸和金雀异黄素促进苹果果皮花青素形成的效应[J].园艺学报,2006,33(5):1055-1058.
[9]汪良驹,王中华,李志强,等.5-氨基乙酰丙酸促进苹果果实着色的效应[J].果树学报,2004,21(6):512-515.
[10]王延玲,张艳敏,冯守千,等.新疆红肉苹果果皮果肉呈色差异机理[J].中国农业科学,2012,45(13):2773.
[11]李涛.苹果渣中多酚的提取分离技术研究[D].杨凌:西北农业科技大学,2007.
[12]王丽媛,苗利利,仇农学.苹果渣中高纯度多酚物质的制备及体外抗氧化活性评价[J].农产品加工·学刊,2009(3):29-33.
[13]任文霞,李建科,仇农学,等.超声波辅助提取苹果渣多酚工艺[J].食品与生物技术学报,2012,27(4):23.
[14]林植芳,李双顺,张东林,等.采摘后荔枝果皮色素、总酚及有关酶活性的变化[J].植物学报,1988,30(1):40-45.
[15]汤凤霞,魏好程,曹禹.芒果多酚氧化酶的特性及抑制研究[J].食品科学,2007,27(12):156-160.
[16]柳素洁.香蕉多酚氧化酶性质及在果酒发酵中褐变控制的研究[D].泰安:山东农业大学,2012.
[17]GasicK,HernandezA,Korban SS.RNA extraction from different apple tissues rich in polyphenols and polysaccharides for cDNA library consruction[J].Plant Molecular Biology Report,2004,22:437-438.
[18]Livak K J,Schmittgen T D.Analysis of relative gene expression datausing real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25:402-408.
[19]朱云娜,王中华,张治平,等.金雀异黄素和环鸟苷酸调控离体葡萄果实花青苷积累[J].园艺学报,2010,37(4):517-524.
[20]俞明亮.苹果花色苷色素的形成[J].北方果树,1992(4):34-36.
[21]Jamil Harb,Dominikus Kittemann,Daniel Alexandre Neuwald,et al.Correlation between Changes in Polyphenol Composition of Peels and Incidence of C02 Skin Burning of ‘Cameo’ Apples As Influenced by Controlled Atmosphere Storage[J].Journal of Agriculture and Food Chemistry,2013,61:3624-3630.
[22]汪良驹,姜卫兵,章镇,等.5-氨基乙酰丙酸生物合成、生理活性及其在农业生产中的潜在应用[J].植物生理学通讯,2003,39(3):185-192.
[23]LijunSun,YurongGuo,Chengcheng Fu,et al.Simultaneous separation and purification of totalpolyphenols,chlorogenic acid and phlorizin from thinned young apples[J].Food Chemistry,2013,136:1022-1029.
[24]Von Wettstein,D.Gough S,Kananagara CG.Chlorophyllbiosynthesis[J].Plant Cell,1995,7:1039-1057.
Effect of 5-Aminolevulinic acid and Genistein on thepolyphenols,enzyme activity and gene expression in apple skin
BAI Ge,GUO Yu-rong*,CHEN Lei
(College of Food Engineering and Nutrition Science,Shaanxi Normal University,Xi’an 710119,China)
Objective:To explore the changes of total polyphenol,anthocyanin,enzymes activity and gene expression in apple skin when the apples were spraied by 5-Aminolevulinic acid(ALA)and Genistein(GNT).Methods:During the field experiments,300mg·L-1ALA,21.62μg·L-1GNT,and ALA+GNT were used to spray the ‘Qinyang’ apple when debagged,and determined the total polyphenol,anthocyanin,enzymes activity and gene expression in apple skin.Results:The red of apple skin deepen as the increase of anthocyanin content and relative gene expression quantity. The total polyphenol content reached the highest and polyphenol oxidase(PPO)activity was lowest in which apple skin was spraied by ALA. The phenylalanin ammonia-lyase(PAL)activity was not significant in the apples treated with GNT and ALA,but higher than the other three kinds of apples.Conclusion:ALA and GNT were conductive to the anthocyanin accumulation,so they can be used for promoting the coloration of early apples to improve market competitiveness.
5-Aminolevulinic acid;Genistein;polyphenol;enzyme activity;gene expression
2014-08-25
白鸽(1992-),女,硕士研究生,研究方向:食品功能成分开发及利用。
*通讯作者:郭玉蓉(1962-),女,博士,教授,研究方向:食品化学。
现代农业产业技术体系建设专项资金资助(GK661001);中央高校基本科研业务费专项资金项目(GK261001330)。
TS201.3
A
1002-0306(2015)13-0194-05
10.13386/j.issn1002-0306.2015.13.032

