化学基本概念和理论考点测试
马亚楼

1.下列电解质溶液的有关叙述正确的是()。
A.同浓度、同体积的强酸与强碱溶液混合后,溶夜的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固本,c(Ba2+)增大
C.含1molKOH的溶液与1molCO2完全反立后,溶液中C(K一)=c(HCO)
D.在 CH3COONa 溶液中加入适量-H。COOH,可使c(Nal )=c(CH3COO-)
2.已知:2Zn(s)+O3(g)=2ZnO(s) △H=-701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s)
△H=-181.6kJ·mol-l
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为()。
A. +519.4 kJ·mol-l
B. +259.7 kJ·mol-l
C.-259.7 kJ·mol-1
D.-519.4 kJ·mol-1
3.根据碘与氢气反应的热化学方程式
(i)I2(g)+H2(g)——2HI(g)+9.48kJ
(ii)I2(s)+H2(g)——2HI(g)-26.48kJ
下列判断正确的是()。
A. 254g I2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
4.在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是()。
A. pH=3的硝酸和pH-ll的氢氧化钠溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3的硫酸和pH=ll的氢氧化钠溶液
D.pH=3的醋酸和pH=ll的氢氧化钠溶液
5.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
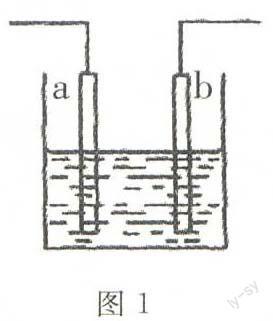
SO2(g)+2CO(g)催化剂2CO2(g)+s(1)△H 若反应在恒容的密闭容器中进行,下列有关说法正确的是()。 A.平衡前,随着反应的进行,容器内压强始终不变 B.平衡时,其他条件不变,分离出硫,正反应速率加快 C.其他条件不变,使用不同催化剂,该反应平衡常数不变 D.平衡时,其他条件不变,升高温度可提高SO2的转化率 6.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是()。 A.①③②④ B.①③④② C.③④②① D.③①②④ 7.图1所示装置中发生反应的离子方程式为2n+2H-—2n2+H2↑,下列说法错误的是()。 A.a,b不可能是同种材料的电极 B.该装置可能是电解池,电解质溶液为稀盐酸 C.该装置可能是原电池,电解质溶液为稀盐酸 D.该装置可看作是铜一锌原电池,电解质溶液是稀硫酸 8.合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为: CO(g)+H2O(g)催化剂CO2(g)十H2(g) △H 反应达到平衡后,为提高CO的转化率,下列措施中正确的是()。 A.增加压强 B.降低温度 C.增大CO的浓度 D.更换催化剂 9.已知2SO2(g)+O2(g)—2SO3(g) △H=-197kJ·mol-1,向同温、同体积的三个密闭容器中分别充人气体:(甲)2molSO2和1molO2;(乙)1mol SO2和0.5molO2;(丙)2molSO3。恒温、恒容下反应达平衡时,下列关系一定正确的是()。 A.容器内压强p:P甲=p丙>2p乙 B.SO3的质量m:m甲=m丙>2m乙 C.c(SO2)与C(O2)之比k:k甲=K丙>K乙 D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Qz, 10.在容积可变的密闭容器中,2molN2和8mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于()。 A. 5% B.10% C.15% D. 20% II.已知A(g)+B(g)—一C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=______,△H=
()(填“<”“>”或“=”)。
(2) 830℃时,向一个5L的密闭容器中充入0.20mol的人和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-l·s-l,则6s时c(A)=____mol·L-l,C的物质的量为
mol;符反应经一段时间后,达到平衡时A的转化率为_________,如果这时向该密闭容器中再充人1mol氩气,平衡时A的转化率为_______。
(3)判断该反应是否达到平衡的依据为_________(填正确选项前的字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)120℃时反应C(g)+D(g)——A(g)+B(g)的平衡常数的值为_______。
12.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下密闭容器中用H2还原WO3可得到金属钨,其总反应方程式为wO3(s)+3H2(g)高温w(s)+3H2o(g)。
请回答下列问题:
(1)上述反应的化学平衡常数表达式为
。
(2)某温度下反应达到平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_______;随着温度的升高,H2与水蒸气的体积比减小,则该反应为_________反应(填“吸热”或“放热”)。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为______;580℃时,固体物质的主要成分为______;假设WO3完令转化为W,则三个阶段消耗H2物质的量之比为_______。
(4)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)—W(s)十2H2O(g)△H=+66.0 kJ·mol-l
WO2(g)+2H2(g)——W(s)+2H2O(g)△H=-137.9kJ·mol-l
则WO2(s)——WO2(g)的△H=_______。
(5)钨丝灯管中的W在使用过程巾缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为W(s)+2I2(g)。下列说法正确的有_______。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W义沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢

