Forskolin激活cAMP信号通路调控小鼠心肌成纤维细胞结缔组织生长因子的表达*
刘 波,黄晓帆,李冬寒,王生伟,杜心灵
华中科技大学同济医学院附属协和医院心血管外科,武汉 430022
论著
Forskolin激活cAMP信号通路调控小鼠心肌成纤维细胞结缔组织生长因子的表达*
刘 波,黄晓帆,李冬寒,王生伟,杜心灵△
华中科技大学同济医学院附属协和医院心血管外科,武汉 430022
目的 研究胞内环磷酸腺苷(cAMP)水平提高对小鼠心肌成纤维细胞(MCFs)表达结缔组织生长因子(CTGF)的影响及其信号通路。方法 采用出生1周内C57BL乳鼠心脏分离培养原代MCFs,第3代MCFs使用腺苷酸环化酶激活剂Forskolin干预培养后检测细胞CTGF、蛋白激酶A(PKA)、p44/42丝裂素活化蛋白激酶(MAPK)及磷酸化p44/42MAPK表达情况。分别给予磷酸化p44/42MAPK抑制剂PD98509及PKA抑制剂Rp-cAMPS阻断相关信号节点,检测细胞内PKA、p44/42MAPK、磷酸化p44/42MAPK以及CTGF表达变化。结果 Forskolin干预培养MCFs细胞后,胞内cAMP水平提高,细胞活力下降,PKA表达上升,p44/42MAPK总蛋白无明显改变,p44/42MAPK磷酸化水平下降,CTGF mRNA及蛋白表达下降;给予PD98509抑制p44/42MAPK磷酸化后,PKA表达上升,CTGF mRNA及蛋白表达下调;Rp-cAMPS抑制PKA活化后,p44/42MAPK磷酸化水平升高,CTGF mRNA及蛋白表达上调。结论Forskolin可以通过提高MCFs胞内cAMP水平抑制CTGF的表达,其作用信号通路为高水平cAMP上调PKA表达,降低下游p44/42MAPK磷酸化水平,抑制CTGF的表达。
Forskolin; 环磷酸腺苷; 结缔组织生长因子; 心肌成纤维细胞; 心肌纤维化
心肌梗死(MI)后的过度纤维化,特别是发生于非梗死区的继发性纤维化对于MI后的心功能保护极为不利,极大增加心功能衰竭的发生概率[1]。结缔组织生长因子(CTGF)是一种在机体中具有重要生物学作用的分泌型蛋白,其最为显著的功能是促进胶原合成和纤维化进程[2]。CTGF的高表达与纤维化直接相关,在MI疾病动物模型中,梗死区及非梗死区心肌组织均可以检测到CTGF的大量表达[3]。因此抑制CTGF的表达能有效地抑制MI后的纤维化进程。
环磷酸腺苷(cAMP)作为细胞内重要的第二信使,对调控细胞的多种功能和增殖具有重要作用。研究发现升高靶细胞中cAMP水平能选择性抑制CTGF基因表达,提高胞内cAMP浓度亦能抑制肺成纤维细胞、肾成纤维细胞的增殖和胶原合成[47]。心肌成纤维细胞(MCFs)的活化与MI后心肌纤维化密切相关,cAMP是否对MCFs同样具有抑制作用,目前文献鲜有报道。本研究通过腺苷酸环化酶激动剂Forskolin提高细胞内cAMP浓度定向干预MCFs,以观察cAMP对MCFs增殖活性的影响以及对CTGF表达的调节作用,并探讨其信号通路。
1 材料与方法
1.1 主要药品与试剂
DMEM高糖培养液(HyClone公司);特级胎牛血清、0.25%胰蛋白酶(Gibco公司);Forskolin、PD98509、p44/42丝裂素活化蛋白激酶(MAPK)抗体、磷酸化p44/42MAPK抗体(江苏碧云天生物技术研究所);重组人转化生长因子-β1(TGF-β1,PeproTech公司);小鼠cAMP ELISA试剂盒(上海远慕生物科技有限公司);cAMP依赖性蛋白激酶抑制剂(Rp-cAMPS,Santa Cruz公司);兔抗CTGF多克隆抗体(Proteintech Group);Ⅱ型胶原酶、四甲基偶氮唑蓝(MTT)(Sigma公司);兔抗蛋白激酶A(PKA)多克隆抗体、波形蛋白(Vimentin)单克隆抗体、α-平滑肌肌动蛋白(α-SMA)单克隆抗体均购于武汉博士德生物工程有限公司。
1.2 MCFs原代分离和培养
出生1周内C57BL乳鼠10只(购自华中科技大学同济医学院实验动物学部),75%乙醇消毒1 min后转移至超净台,快速开胸取出心脏,置于4℃预冷磷酸盐缓冲液(PBS)中洗尽残血,剔除心房及心脏结缔组织,保留左心室。将心室组织剪碎,转入50mL无菌离心管,首次加入0.25%胰蛋白酶37℃软化组织5min,弃上清。加入等体积0.125%胰蛋白酶及0.1%Ⅱ型胶原酶混合消化液37℃分次振荡消化,每次10min,静置1min后留取上清液。重复分次消化,直到组织块完全消失。将所有上清液经200目细胞筛过滤,去除大块未消化组织,1 500 r/min离心10min,去除上清液,加入完全培养液重悬细胞,转入细胞培养瓶培养90min,去除未贴壁细胞,获取MCFs,加入含10%胎牛血清完全培养液继续正常培养,取第3代MCFs用于后续实验。
1.3 MCFs免疫荧光鉴定
0.25 %胰蛋白酶消化第2代细胞,以3×105个/mL细胞数量接种于多聚赖氨酸包被的圆形载玻片上,置于12孔板中培养,待细胞生长至70%~80%融合时,终止细胞培养,取出爬片,4%多聚甲醛固定20min,PBS漂洗3次。Triton室温封闭1h,PBS漂洗3次;1%牛血清白蛋白(BSA)封闭30 min。分别滴加1%BSA稀释的一抗(Vimentin单克隆抗体及α-SMA),4℃过夜,PBS漂洗3次。滴加1%BSA稀释的二抗,37℃避光孵育1h后PBS漂洗3次。5μg/mL DAPI染色2min,封片后荧光显微镜下观察。
1.4 MCFs活力MTT测定
MCFs以2×104个/mL细胞数量接种于96孔板上,当细胞生长至80%~90%融合时吸弃培养液中止培养,各孔加入20μL MTT溶液,置于细胞培养箱37℃孵育4h后吸弃MTT溶液。各孔加入150μL二甲基亚砜(DMSO)室温振荡10min后置于酶联免疫监测仪490nm波长读取吸光度(A)值。
1.5 MCFs胞内cAMP浓度ELISA检测
0.25 %胰蛋白酶消化细胞,1 500r/min离心10 min,收获细胞后超声裂解,获取上清液,所获样品严格按照小鼠cAMP ELISA试剂盒操作说明使用酶联免疫监测仪于450nm波长读取各样本吸光度值。以标准物浓度为横坐标,吸光度值为纵坐标,绘制标准曲线,计算各样本cAMP实际浓度。
1.6 目的蛋白Western blot检测
0.25 %胰蛋白酶消化细胞,1 500r/min离心10 min后收获细胞,提取总蛋白。取50μg总蛋白12%SDS-聚丙烯酰胺凝胶电泳(恒压115V、135 min),电转膜至PVDF膜(恒流200mA、转膜时间90min),使用含5%脱脂奶粉的TBST浸泡PVDF膜,室温摇床封闭2h。分别加入目的蛋白一抗和GAPDH抗体4℃摇床孵育过夜。TBST洗涤4次,每次5min。目的蛋白再加入相应二抗,GAPDH再加入兔抗GAPDH多克隆IgG抗体,室温摇床孵育2h,TBST充分洗涤PVDF膜4次,每次5min,ECL发光试剂显影,结果使用凝胶成像分析系统测定,各条带与GAPDH的灰度值之比为目的蛋白表达相对含量。
1.7 CTGF mRNA RT-PCR检测
0.25 %胰蛋白酶消化细胞,1 500r/min离心10 min后收获细胞,使用Trizol试剂盒提取RNA,分光光度计测定A260/280,计算RNA浓度。RT-PCR引物设计:CTGF正义链5′-GGCATCTCCACCCGAGTTAC-3′,反义链5′-TTGGCGATTTTAGGTGTCCG-3′,146bp;β-actin正义链5′-CACGATGGAGGGGCCGGACTCATC-3′,反义链5′-TAAAGACCTCTATGCCAACACAGT-3′,240bp。各样品取等量RNA逆转录cDNA,反应条件42℃60 min,95℃5min。将反转录产物cDNA行RT-PCR扩增,反应条件:94℃、预变性4min,94℃、变性30 s,54℃、退火30s,72℃、延伸25s,30个循环,72℃终延伸10min,取出反应体系,4℃放置4min。扩增完成后,各组取等量扩增产物行琼脂糖凝胶电泳,所得图像进行灰度扫描,读取各条带吸光度值,以CTGF/β-actin吸光度值之比行半定量分析。
1.8 统计学分析
所有数据均以均数±标准差(¯x±s)表示,使用SPSS 16.0统计学软件进行分析,组间均数比较采用成组资料t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学观察及生长特性
混合酶消化心室组织后,可以得到较多混合细胞,倒置显微镜下观察呈现大小不等的圆形。差速贴壁90min后,大部分MCFs已呈贴壁生长,去除杂质细胞后,可获得纯度较高的MCFs(图1)。继续培养2d后,细胞形态逐渐由圆形变成梭形,无自发搏动现象。经过2d潜伏期后,细胞第3天开始进入对数生长期,细胞数量成倍增加;第5天细胞增殖速率下降,活力降低;第6天细胞数量开始减少(图2、3)。
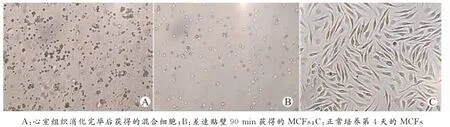
图1 混合酶消化后原代MCFs分离和培养(×100)Fig.1 Isolating by mixed enzymes and culturing of primary mice cardiac fibroblasts(×100)

图2 MCFs细胞生长数量曲线Fig.2 The growth curve of MCFs

图3 MCFs细胞生长活力曲线Fig.3 The vitality curve of MCFs
2.2 MCFs免疫荧光鉴定
MCFs是心脏组织中含量较多的细胞,原代分离后的混合细胞中除MCFs以外,尚有大量心肌细胞存在,因两者贴壁时间不同,差速贴壁90min后可去除绝大部分心肌细胞。MCFs与心肌细胞在光镜下外形差异不明显,两者最大的区别在于心肌细胞有规律的自发搏动,而MCFs无搏动。在特异性标记物上,心肌成纤维细胞表达Vimentin,不表达α-SMA(图4)。
2.3 TGF-β1刺激MCFs高表达CTGF
CTGF在正常细胞中表达较少,使用TGF-β1刺激MCFs可快速高表达CTGF。采用第3代细胞,接种于6孔板中,分为正常培养组(A)及TGF-β1刺激组(B)。待细胞生长至80%~90%融合时,刺激组中加入TGF-β1(10ng/mL)置于细胞培养箱中培养24h后收获细胞,行CTGF Western blot检测及CTGF mRNA RT-PCR检测,每组设3个复孔,实验经过3次验证。结果提示MCFs在TGF-β1刺激24h后,CTGF蛋白及mRNA表达较正常培养组明显升高(P<0.05)(图5)。
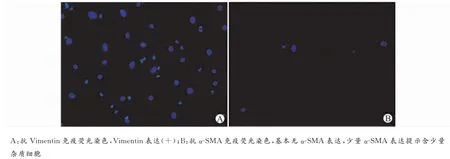
图4 MCFs免疫荧光鉴定(×400)Fig.4 Identification of MCFs by immunofluorescence(×400)

图5 TGF-β1刺激MCFs后CTGF蛋白及mRNA表达变化Fig.5 The changes of CTGF protein and mRNA in MCFs stimulated by TGF-β1
2.4 Forskolin提高MCFs胞内cAMP浓度水平抑制MCFs表达CTGF
腺苷酸环化酶激动剂Forskolin干预培养MCFs细胞,设立正常培养组(A)、TGF-β1刺激组(B)及TGF-β1+Forskolin组(C)。MCFs使用Forskolin(12μmol/L)培养30min后,加入TGF-β1(10ng/mL)继续培养24h,分别检测各组细胞胞内cAMP水平、细胞活力、CTGF蛋白及CTGF mRNA表达变化以及PKA、p44/42MAPK、磷酸化p44/42MAPK表达变化,每组设3个复孔,实验经过3次验证。结果提示TGF-β1+Forskolin组细胞胞内cAMP浓度较正常培养组及TGF-β1刺激组明显上升(均P<0.05)(图6);细胞活力MTT检测提示TGF-β1+Forskolin组细胞活力下降(P<0.05)(图7);CTGF蛋白表达及mRNA表达TGF-β1+Forskolin组较TGF-β1刺激组均出现下调(均P<0.05)(图8),PKA蛋白表达较TGF-β1刺激组上调(P<0.05),p44/42MAPK磷酸化水平较TGF-β1刺激组降低(P<0.05),p44/42MAPK总蛋白无明显改变(P>0.05)(图9)。
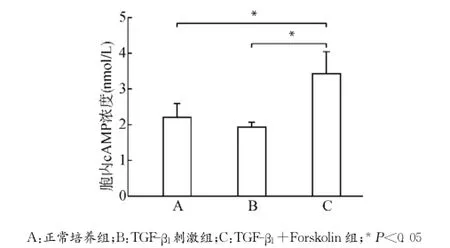
图6 各组MCFs胞内cAMP浓度变化Fig.6 The changes of intracellular cAMP levels in MCFs in each group
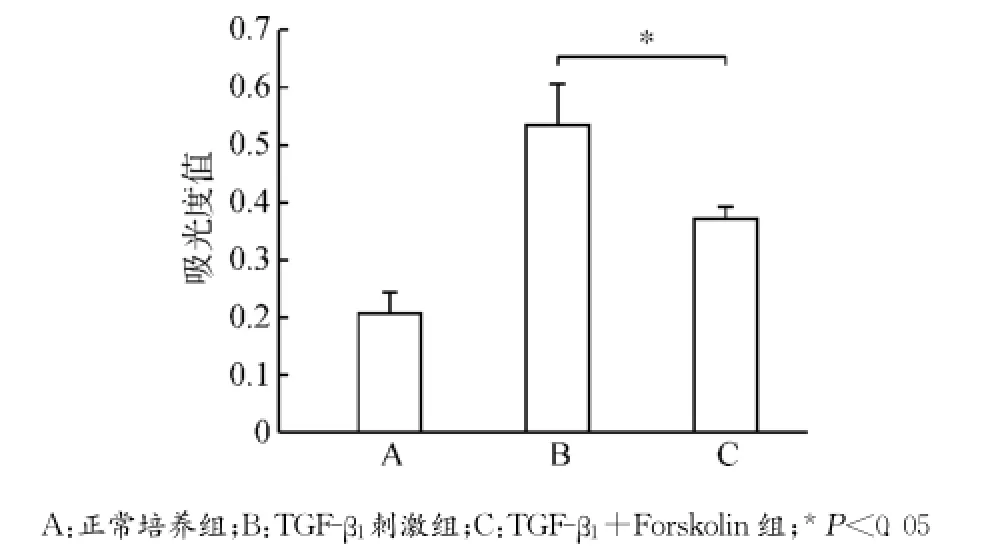
图7 各组MCFs细胞活力变化Fig.7 The changes of the viability of MCFs in each group

图8 Forskolin干预MCFs后CTGF蛋白及mRNA表达变化Fig.8 The changes of CTGF protein and mRNA in MCFs treated with Forskolin

图9 Forskolin干预MCFs后PKA、p44/42MAPK及磷酸化p44/42MAPK表达变化Fig.9 The changes of PKA,p44/42MAPK and phospho-p44/42MAPK in MCFs after intervention with Forskolin
2.5 PD98509抑制p44/42 MAPK磷酸化水平后相关信号分子表达变化及CTGF表达变化
设立正常培养组(A)、TGF-β1+Forskolin组(B)及TGF-β1+Forskolin+PD98509组(C)。MCFs加入PD98509(5μmol/L)培养1h后,加入Forskolin(12μmol/L)培养30min,继续TGF-β1(10ng/mL)培养24h,每组设3个复孔,实验经过3次验证。结果显示PD98509培养组细胞CTGF蛋白及mRNA较TGF-β1+Forskolin组下调(P<0.05)(图10),p44/42MAPK磷酸化水平受到抑制(P<0.05),p44/42MAPK总蛋白无明显改变(P>0.05),PKA表达上调(P<0.05)(图11)。

图10 PD98509干预MCFs后CTGF蛋白及mRNA表达变化Fig.10 The changes of CTGF protein and mRNA in MCFs treated with PD98509

图11 PD98509干预MCFs后PKA、p44/42MAPK及磷酸化p44/42MAPK表达变化Fig.11 The changes of PKA,p44/42MAPK and phospho-p44/42MAPK in MCFs after intervention with PD98509
2.6 Rp-cAMPS抑制PKA后相关信号分子表达变化及CTGF表达变化
设立正常培养组(A)、TGF-β1+Forskolin组(B)及TGF-β1+Forskolin+Rp-cAMPS组(C)。MCFs加入Rp-cAMPS(10-5mol/L)培养1h后,加入Forskolin(12μmol/L)培养30min,继续加入TGF-β1(10ng/mL)培养24h,每组设3个复孔,实验经过3次验证。结果显示Rp-cAMPS培养组细胞CTGF蛋白及mRNA表达明显增加(P<0.05)(图12);PKA表达下调(P<0.05),p44/42MAPK磷酸化水平上调(P<0.05),p44/42MAPK总蛋白无明显改变(P>0.05)(图13)。

图12 Rp-cAMPS培养MCFs后CTGF蛋白及mRNA表达变化Fig.12 The changes of CTGF protein and mRNA in MCFs treated with Rp-cAMPS

图13 Rp-cAMPS干预MCFs后PKA、p44/42MAPK及磷酸化p44/42MAPK表达变化Fig.13 The changes of PKA,p44/42MAPK and phospho-p44/42MAPK in MCFs after intervention with Rp-cAMPS
3 讨论
MI后心脏修复过程中出现的影响心脏功能的不利心室重塑仍然是一个值得关注的重要问题。研究提示,MI后梗死区与非梗死区纤维化的进展和调控并不相同并且都存在失调的可能,而导致过度纤维化,特别是发生在非梗死区域心肌的继发性间质纤维化因心室僵硬度增加、心室顺应性降低,对于MI后的心功能保护极为不利,极大增加了心功能衰竭的发生概率[1]。因此,抑制心肌纤维化,特别是非梗死区心肌组织的纤维化对于抑制MI后不利心室重塑、保护心脏功能具有积极意义。
CTGF是一种在机体中具有重要生物学作用的分泌型蛋白,属于即刻早期基因CTGF/cyr-61/nov家族(CCN家族),广泛表达于心、脑、肺、肾、肝、胎盘以及皮肤等多种组织器官,在多种生理、病理过程中起着重要作用[8]。CTGF具有多种生物学活性,包括参与正常胚胎发育和分化、促进血管生成、介导细胞凋亡、调控细胞增殖及细胞外基质合成等过程,但CTGF最为显著的功能是促进胶原合成和纤维化进程[9]。作为直接参与纤维化进程的重要促纤维化因子,CTGF的高表达在多种病理过程中如肝纤维化、肾纤维化、动脉粥样硬化、气道重塑等均可检测发现[1012]。在MI疾病动物模型中,也可检测到CTGF高表达,并且表达量随时间逐渐递增[13]。
MI后CTGF高表达是心肌细胞坏死后梗死区纤维化重塑的正常保护性反应,对于保持MI后心脏结构完整,维持心脏泵血功能,具有不可替代的重要意义。然而研究提示,CTGF的表达在梗死区瘢痕形成后仍存在持续高表达现象,并波及到非梗死区组织,导致非缺血区心肌细胞收缩功能受限,引起心室顺应性降低[1]。因此抑制MI后CTGF的表达,降低心肌组织的过度纤维化,对于保护心脏功能具有积极意义。
MCFs作为构成心脏结构的主要细胞之一,其活化而合成的大量细胞外基质以及降解紊乱与MI后心肌纤维化密切相关,抑制MCFs的活化可以抑制CTGF的表达,从而抑制纤维化进程。cAMP作为细胞内重要的第二信使,对调控细胞的多种功能和增殖有重要作用,研究表明提升靶细胞中cAMP水平能选择性抑制CTGF基因表达[45],我们在前期动物预实验中亦发现,MI后1周小鼠通过腹腔注射环磷酸腺苷干预4周后,通过Western blot及RT-PCR检测均提示梗死区及非梗死区CTGF表达下调。同时其他研究发现高浓度cAMP能抑制肺成纤维细胞的增殖[6],因此我们推测cAMP对MCFs的增殖活性亦有同样的抑制作用。
Forskolin可透过细胞,通过激活腺苷酸环化酶而提高细胞内cAMP含量水平。因CTGF在正常细胞中表达较少,本研究中我们使用TGF-β1快速上调CTGF表达,再通过Forskolin干预MCFs,以观察cAMP浓度提高对MCFs增殖活性及CTGF表达的影响。结果发现,通过Forskolin干预的细胞,其增殖活性较正常培养组细胞降低,同时Western blot及RT-PCR检测均提示CTGF表达较正常培养组下调。因此我们认为cAMP含量水平提高对MCFs表达CTGF具有负性调控作用。
CTGF表达调节机制在不同的细胞类型中并不一致,各种调节因子对CTGF的表达调节都是通过自己独特的信号通路实现,任何一个调节因子都可以在不同的细胞中在不同的水平对CTGF的基因表达产生调节作用。在人肺成纤维细胞中,CTGF的表达主要是通过JNK信号通路介导[14];在平滑肌细胞中,CTGF的表达主要通过p38信号通路介导[15];而在人类晶状体上皮细胞中,CTGF的表达主要是通过JAK2/STAT3信号通路实现[16]。研究表明,在TGF-β1诱导的CTGF大量表达所致的纤维化过程中,p44/42MAPK信号通路起着重要作用[17]。在Forskolin干预MCFs后,我们通过Western blot检测了细胞中p44/42MAPK总蛋白以及磷酸化p44/42MAPK的表达水平,结果提示p44/42MAPK总蛋白在各组中均无明显改变,而磷酸化p44/42MAPK的表达水平在Forskolin干预组呈现下调,因此提示在Forskolin提升细胞内cAMP水平抑制MCFs表达CTGF过程中,p44/42 MAPK的磷酸化水平发挥着重要作用。目前研究已证实,PKA作为cAMP的下游信号分子,由cAMP所介导的各种效应主要通过激活PKA来实现,因此我们也同时检测了PKA的表达变化,结果提示PKA表达水平在Forskolin干预MCFs后上升。因此我们认为PKA、磷酸化p44/42MAPK参与了cAMP对MCFs表达CTGF的调控过程。
为了确定p44/42MAPK磷酸化水平在调控CTGF表达中的作用,我们采用PD98509抑制p44/42MAPK磷酸化水平后观察CTGF表达变化,结果提示p44/42MAPK磷酸化水平被抑制以后,CTGF mRNA及蛋白表达均下调;同时检测PKA的表达提示PKA表达水平呈现一定程度的上调。为了进一步明确PKA与p44/42MAPK磷酸化水平之间的关系,我们采用Rp-cAMPS抑制PKA的表达,以观察p44/42MAPK磷酸化水平的变化,结果提示PKA表达水平被抑制后,p44/42 MAPK磷酸化水平呈现上调,同时CTGF mRNA及蛋白的表达水平均上调。以上结果提示PKA与p44/42MAPK磷酸化水平之间存在负反馈调节方式,而CTGF的基因表达和蛋白合成则受p44/42 MAPK磷酸化水平的正性调控。
本研究结果表明,MCFs胞内cAMP水平的提高可以抑制MCFs细胞的活化,降低CTGF的表达水平,其发挥作用的信号通路为高水平cAMP激活PKA的表达从而抑制下游p44/42MAPK磷酸化水平,降低CTGF mRNA表达水平,抑制CTGF蛋白的合成。
[1] Jugdutt B I,Dhalla N S.Cardiac remodeling:Molecular mechanisms[M].New York:Springer,2013:525-545.
[2] Ihn H.Pathogenesis of fibrosis:role of TGF-βand CTGF[J].Curr Opin Rheumatol,2002,14(6):681-685.
[3] Dean R G,Balding L C,Candido R,et al.Connective tissue growth factor and cardiac fibrosis after myocardial infarction[J].J Histochem Cytochem,2005,53(10):1245-1256.
[4] Duncan M R,Frazier K S,Abramson S,et al.Connective tissue growth factor mediates transforming growth factorβ-induced collagen synthesis:down-regulation by cAMP[J].FASEB J,1999,13(13):1774-1786.
[5] Yu J,Prado G N,Schreiber B,et al.Role of prostaglandin E2 EP receptors and cAMP in the expression of connective tissue growth factor[J].Arch Biochem Biophys,2002,404(2):302-308.
[6] Liu X,Ostrom R S,Insel P A.cAMP-elevating agents and adenylyl cyclase overexpression promote an antifibrotic phenotype in pulmonary fibroblasts[J].Am J Physiol Cell Physiol,2004,286(5):C1089-C1099.
[7] Heusinger-Ribeiro J,Eberlein M,Wahab N A,et al.Expression of connective tissue growth factor in human renal fibroblasts:regulatory roles of RhoA and cAMP[J].J Am Soc Nephrol,2001,12(9):1853-1861.
[8] Desnoyers L.Structural basis and therapeutic implication of the interaction of CCN proteins with glycoconjugates[J].Curr Pharm Des,2004,10(31):3913-3928.
[9] Gao R,Brigstock D R.Low density lipoprotein receptor-related protein(LRP)is a heparin-dependent adhesion receptor for connective tissue growth factor(CTGF)in rat activated hepatic stellate cells[J].Hepatol Res,2003,27(3):214-220.
[10] Lam S,van der Geest R N,Verhagen N A,et al.Connective tissue growth factor and IGF-I are produced by human renal fibroblasts and cooperate in the induction of collagen production by high glucose[J].Diabetes,2003,52(12):2975-2983.
[11] Burgess J K.Connective tissue growth factor:a role in airway remodelling in asthma?[J].Clin Exp Pharmacol Physiol,2005,32(11):988-994.
[12] Ohnishi H,Oka T,Kusachi S,et al.Increased expression of connective tissue growth factor in the infarct zone of experimentally induced myocardial infarction in rats[J].J Mol Cell Cardiol,1998,30(11):2411-2422.
[13] Utsugi M,Dobashi K,Ishizuka T,et al.C-Jun-NH2-terminal kinase mediates expression of connective tissue growth factor induced by transforming growth factor-β1in human lung fibroblasts[J].Am J Respir Cell Mol Biol,2003,28(6):754-761.
[14] Chowdhury I,Chaqour B.Regulation of connective tissue growth factor(CTGF/CCN2)gene transcription and mRNA stability in smooth muscle cells[J].Eur J Biochem,2004,271(22):4436-4450.
[15] Park S K,Kim J,Seomun Y,et al.Hydrogen peroxide is a novel inducer of connective tissue growth factor[J].Biochem Biophys Res Commun,2001,284(4):966-971.
[16] Hayashida T,Poncelet A C,Hubchak S C,et al.TGF-β1activates MAP kinase in human mesangial cells:A possible role in collagen expression[J].Kidney Int,1999,56(5):1710-1720.
[17] Suzuki H,Uchida K,Nitta K,et al.Role of mitogen-activated protein kinase in the regulation of transforming growth factor-β-induced fibronectin accumulation in cultured renal interstitial fibroblasts[J].Clin Exp Nephrol,2004,8(3):188-195.
(2014-10-08 收稿)
Forskolin Regulates the Expression of CTGF in Mouse Cardiac Fibroblasts by Activating the cAMP Signaling Pathway
Liu Bo,Huang Xiaofan,Li Donghan et al
Department of Cardiovascular Surgery,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China
Objective To examine the effects of the increased levels of cyclic adenosine monophosphate(cAMP)on the expression of connective tissue growth factor(CTGF)in mouse cardiac fibroblasts(MCFs)and the related signal transduction pathway.Methods MCFs from the hearts of 1-week-old C57BL mice were isolated and primarily cultured.The expression levels of CTGF,protein kinase A(PKA),p44/42mitogen activated protein kinase(MAPK)and phospho-p44/42MAPK were detected in 3-generation MCFs treated with Forskolin(an activating agent of cAMP),PD98509(an inhibitor of phospho-p44/42MAPK)or Rp-cAMPS(an inhibitor of PKA).Results The levels of cAMP were increased,the cell viability decreased,the expression levels of PKA and CTGF increased and the expression levels of phospho-p44/42MAPK declined in MCFs treated with Forskolin.The PKA expression levels were increased while the expression levels of CTGF decreased in MCFs treated with PD98509.RpcAMPS could inhibit the expression of PKA,and upregulate the expressions of phospho-p44/42MAPK and CTGF.Conclusion Forskolin can inhibit the CTGF expression levels by increasing the intracellular level of cAMP.The involved mechanism is that high levels of cAMP upregulate the PKA expression level,reduce the phosphorylation level of the downstream target p44/42 MAPK and inhibit the CTGF expression.
Forskolin; cyclic adenosine monophosphate; connective tissue growth factor; cardiac fibroblasts; myocardial fibrosis
R542.2
10.3870/j.issn.1672-0741.2015.01.001
*教育部高等学校博士学科点专项科研基金资助项目(No.2011014 2110009)
刘 波,男,1986年生,博士研究生,E-mail:liubo2012@126.com
△通讯作者,Corresponding author,E-mail:xinlingdu@hust.edu.cn

