不同生物型BVDV 感染对MDBK 细胞类泛素基因转录水平的影响
韩玉霞,孟露萍,孙志华,刘 娟,张 辉,陈创夫
(石河子大学动物科技学院,新疆石河子832000)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是一种重要的动物疫病病原,在全球范围内广泛分布。它能够感染牛、羊、骆驼、鹿等动物,引发牛病毒性腹泻-黏膜病;还能够造成动物源性产品如冷冻胚胎、精液等的污染,造成重大的畜牧业经济损失。BVDV 是黄病毒科瘟病毒属的成员之一,为单股正链RNA 病毒。根据能否使感染的细胞产生病变,将BVDV 分为致细胞病变型(cp 型)和非致细胞病变型(ncp 型)。BVDV 能够感染怀孕母畜,造成胎儿免疫耐受,从而发展为持续性感染(persistent infection,PI),感染病畜终生带毒、排毒,是畜群中主要的传染源[1]。目前,我国尚无有效的疫苗用于控制该病的发生与流行,因此研究BVDV 致病的分子机制将为研发新型有效的疫苗提供基础资料。
类泛素蛋白质家族(ubiquitin like protein,UBL)是近几年新发现的一类小分子蛋白质,含有与泛素高度同源的结构域,在细胞生长调控中发挥多种重要作用[2]。小泛素相关修饰物(small ubiquitin-related modifier,SUMO)是一种重要的类泛素蛋白,在生物进化过程中高度保守[3]。作为一种重要的蛋白质翻译后修饰,SUMO 调控蛋白质间相互作用、参与DNA 的复制与修复以及转录调控等过程[4]。研究表明,SUMO 化修饰能够促进肠道病毒71型3C 蛋白质降解,减少病毒的复制与细胞凋亡[5];猪瘟病毒核心蛋白与SUMO 化通路蛋白的互作影响了病毒的毒力[6];牛痘病毒E3蛋白能与细胞SUMO 共价结合,调控E3 的转录活性[7]。BVDV感染能否引起细胞SUMO 通路的改变,进而影响病毒在胞内的复制水平,目前尚未见报道。因此,本文通过实时荧光定量PCR 检测不同生物型BVDV 感染对MDBK 细胞SUMO 基因转录水平的影响,以期丰富BVDV 致病机制的理论基础。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 致细胞病变型BVDV 标准株NADL毒株由中国兽医药品监察所提供;非致细胞病变型BVDV 分离株shz132毒株由石河子大学人兽共患病实验室分离、鉴定并保存。MDBK 细胞,购自中国科学院细胞库。
1.1.2 主要试剂 DMEM 高糖培养基、胎牛血清FBS,美国Gibco公司产品;SYBR Green I荧光染料,德国Roche公司产品;超纯RNA 提取试剂盒、HiFi-MMLV cDNA 第一链合成试剂盒,康为世纪产品;其他生化试剂皆为进口或国产分析纯。
1.1.3 主 要 仪 器 LightCycler○R480 Ⅱ荧 光 定 量PCR 仪,德国Roche公司产品;DNP-9162CO2恒温培养箱;Centrifuge-5415D 低温高速离心机、微量移液器,Eppendorf公司产品;NanoDrop-2000核酸定量仪,Thermo Scientific公司产品;细胞冻存盒,美国Nalgene公司产品。
1.2 方法
1.2.1 引物设计与合成 参照GenBank中已公布的牛源SUMO1(登录号:NM-001035458.1)、SUMO2(登录号:NM-001005849.1)、SUMO3(登录号:NP-008867)、Ubc9(登录号:NM-001099372.1)、GAPDH(登录号:NM-001034034.2)基因的核苷酸序列,RT-PCR 引物设计需遵循以下基本原则:①引物长度在18bp~27bp 之间;②引物GC 含量在40%~60%之间,上、下游引物GC 含量相差不能太大;③Tm 值在55℃~65℃之间,上、下游引物Tm值相差不能太大;④产物长度在100bp~250bp之间;⑤引物与模板特异性结合,不出现发卡结构、引物二聚体及错配。根据以上原则,采用Primer 5.0软件分别设计以上基因荧光定量PCR特异性引物(表1)。引物由上海生工生物工程技术服务有限公司合成。

表1 荧光定量PCR 引物设计Table 1 Primer sequences of fluorescent quantitative PCR
1.2.2 MDBK 细胞的培养 用含100 mL/L FBS的DMEM 细胞培养液复苏MDBK 细胞,置于37 ℃、体积分数为5%的CO2饱和湿度培养箱中进行细胞常规培养。待细胞长成单层且融合度接近100%时,用含0.2g/L EDTA-Na2的2.5g/L 的胰酶进行消化传代培养。
1.2.3 BVDV 毒株的增殖 待MDBK 细胞长成单层且融合度达到70%~80%时,弃去原培养液,PBS清洗细胞3遍,加入一定体积的无血清的DMEM 原液,并按培养液体积与病毒液体积10∶1的比例接种BVDV NADL 和BVDV shz132病毒,在37 ℃、体积分数为5%的CO2饱和湿度培养箱中病毒吸附细胞2h后,更换为含20 mL/L FBS 的DMEM 培养液继续培养。48h后待BVDV NADL 接种组细胞病变达到80%以上时,反复冻融细胞3次,使之完全破裂释放病毒,收集病毒液,1 000r/min 离心5min,0.45μm 滤膜过滤后保存在-80 ℃冰箱。接种病毒48h后,BVDV shz132接种组细胞并不产生病变,用相同的方法收集病毒液。
1.2.4 BVDV 病毒液的浓缩 采用Millipore超滤管对收集的病毒液进行浓缩。将收集的所有病毒液充分混匀,0.45μm 滤膜再次过滤后,取15mL滤液加入超滤管,4 ℃、5 000r/mim 离心30 min~60 min,至超滤管中浓缩液体积达1mL 左右。将收集的所有浓缩液混匀,分装,保存在-80 ℃冰箱。
1.2.5 BVDV 病毒拷贝数的测定 通过荧光定量PCR,绝对定量的方法测定BVDV NADL 和BVDV shz132浓缩病毒液的拷贝数。浓缩后分装的BVDV NADL 和BVDV shz 132 病 毒 液 各 取3 管,每 管0.5mL,按照康为世纪超纯RNA 提取试剂盒说明书提取总RNA。采用NanoDrop-2000核酸定量仪测定收集的RNA 溶液浓度及纯度。取相同体积的RNA 溶液,使用康为世纪HiFi-MMLV cDNA 第一链合成试剂盒将总RNA 反转录获得cDNA。
通过Roche LightCycler○R480 Ⅱ荧光定量PCR仪测定两种BVDV 病毒液的Ct值。荧光定量PCR反应 为10μL 体 系:SYBR Green Ⅰ5 μL,无 菌ddH2O 3.6μL,E0基因10μmol/L 上、下游引物各0.2μL,cDNA 模板1μL。PCR 反应参数为:95 ℃5min;95 ℃15s,58 ℃30s,在58 ℃收集荧光,50个循环。基因扩增曲线、熔解曲线及样品Ct值由荧光定量PCR 仪软件自动生成,采用SPSS 17.0软件进行统计学分析,试验数据以平均值±标准差表示。
根据实验室已构建成功的BVDV E0 基因标准曲线:y=-3.401x+11.80,其中x 表示质粒浓度的对数值,y值表示Ct值,计算E0基因重组质粒浓度的对数值。依据以下公式计算得到病毒拷贝数:

其中,质粒浓度μg/mL;NA,阿伏伽德罗常数,6.02×1023;DNA 片段长度:载体长度+基因片段长度;DNA 片段100bp相当于分子量为6.6×105dt;拷贝数的最后单位是copies/mL。
1.2.6 BVDV NADL病毒TCID50的测定 将长成单层且融合度接近100%的MDBK 细胞消化后接种96孔细胞培养板,每孔接种约1×104个细胞。待每个孔的细胞长成单层约60%的丰度即可接种病毒。使用多道加样器吸去原培养液,PBS清洗细胞3遍,每孔加入100μL 无血清的DMEM 原液。在无菌EP管中用无血清的DMEM 原液将NADL 浓缩病毒液进行10倍倍比稀释(10-1,10-2,...,10-10),每个稀释度接种8个孔,每孔加入100μL 病毒液。设空白细胞对照组。将培养板置于37 ℃、体积分数为5%CO2、饱和湿度的培养箱吸附2h,更换为含20mL/L FBS的DMEM 培养液继续培养48h,显微镜下观察细胞病变,记录每个稀释度病变的孔数,按照Reed-Muench法计算病毒的TCID50。试验重复3次。计算公式如下:

1.2.7 病毒感染MDBK 细胞 将MDBK 细胞按照5.0×105个/孔接种于六孔细胞培养板,待细胞长成单层且融合度达到70%~80%时,按照100 TCID50接种BVDV NADL,且根据100 TCID50BVDV NADL所含有的病毒拷贝数,接种相同拷贝数的BVDV shz132。接种病毒后,在37 ℃、体积分数为5%CO2、饱和湿度的培养箱中吸附2h,更换为含20 mL/L FBS 的DMEM 培养液继续培养。设空白细胞对照。病毒感染后4、12、24、48h,在显微镜下观察细胞形态变化。PBS清洗细胞2遍,每孔加入1mL 裂解液buffer RLT,反复吹打后收集细胞,置于-80 ℃冰箱保存。
1.2.8 RT-qPCR 检测细胞中类泛素基因的mRNA 水平 按照康为世纪超纯RNA 提取试剂盒说明书提取收集的所有细胞的总RNA,按照2μg对总RNA 进行定量,并将总RNA 反转录为cDNA。以cDNA 为模板,进行RT-qPCR 检测。荧光定量PCR 反应体系与反应参数与1.2.5相同。以GAPDH 基因为内参基因,采用2-△△Ct法对每个基因的相对表达量进行分析。采用SPSS 17.0软件进行统计学分析,试验数据以平均值±标准差表示。
2 结果
2.1 BVDV 拷贝数的测定
提取NADL和shz 132病毒相同体积病毒液的总RNA,并将相同体积的总RNA 反转录为cDNA,以1μL cDNA 为模板进行荧光定量PCR 反应,并计算病毒拷贝数。图1为两种病毒液E0基因的扩增曲线与熔解曲线。NADL 和shz 132 病毒液E0基因的Ct值分别为33.72±1.34,33.06±0.81,两者差异不显著(P>0.05)。通过E0 基因标准曲线及公式计算可得,NADL 和shz 132 病毒液拷贝数分别为1.13×1011copies/mL 和1.77×1011copies/mL。
2.2 BVDV NADL TCID50的测定
病毒接种细胞48h 后,显微镜下观察细胞病变,记录每个稀释度病变的孔数,按照Reed-Muench法计算病毒的TCID50。每个稀释度的细胞病变孔数见表2。按照公式计算可得BVDV NADL病毒液TCID50为10-4.9TCID50/0.1mL。
2.3 BVDV 感染后MDBK 细胞形态的变化
按照100TCID50接种cp BVDV NADL 及相同病毒拷贝数的ncp BVDV shz 132,接毒后分别培养4、12、24、48h,在显微镜下观察细胞形态变化。接种NADL 4h和12h 后,MDBK 细胞没有发生病变,24h后细胞出现轻微的病变,48h后细胞发生大量的病变,细胞核浓缩,胞膜不整齐、模糊,部分细胞出现裂解。对照组及shz 132病毒接种组细胞在任何时间点都未发生病变。
2.4 RT-qPCR检测细胞中类泛素基因的mRNA水平
两种生物型BVDV 感染MDBK 细胞4、12、24、48h,以GAPDH 基因为内参基因,通过RT-qPCR方法分别对细胞类泛素基因SUMO1、SUMO2、SUMO3及Ubc9的表达量进行相对定量分析。
2.4.1 基因的扩增曲线与熔解曲线分析 如图2所示,可见各个基因扩增曲线拐点清晰,整体平行性好,斜率大,扩增效率高,且基因的熔解曲线都只存在一个特异性的峰值,Tm 值在80 ℃~90 ℃之间,不存在非特异性扩增,因此RT-qPCR 所用引物特异性高,所得Ct值有效可靠。

图1 BVDV E0基因的扩增曲线与熔解曲线Fig.1 Amplification curves and melting curves of E0gene of BVDV
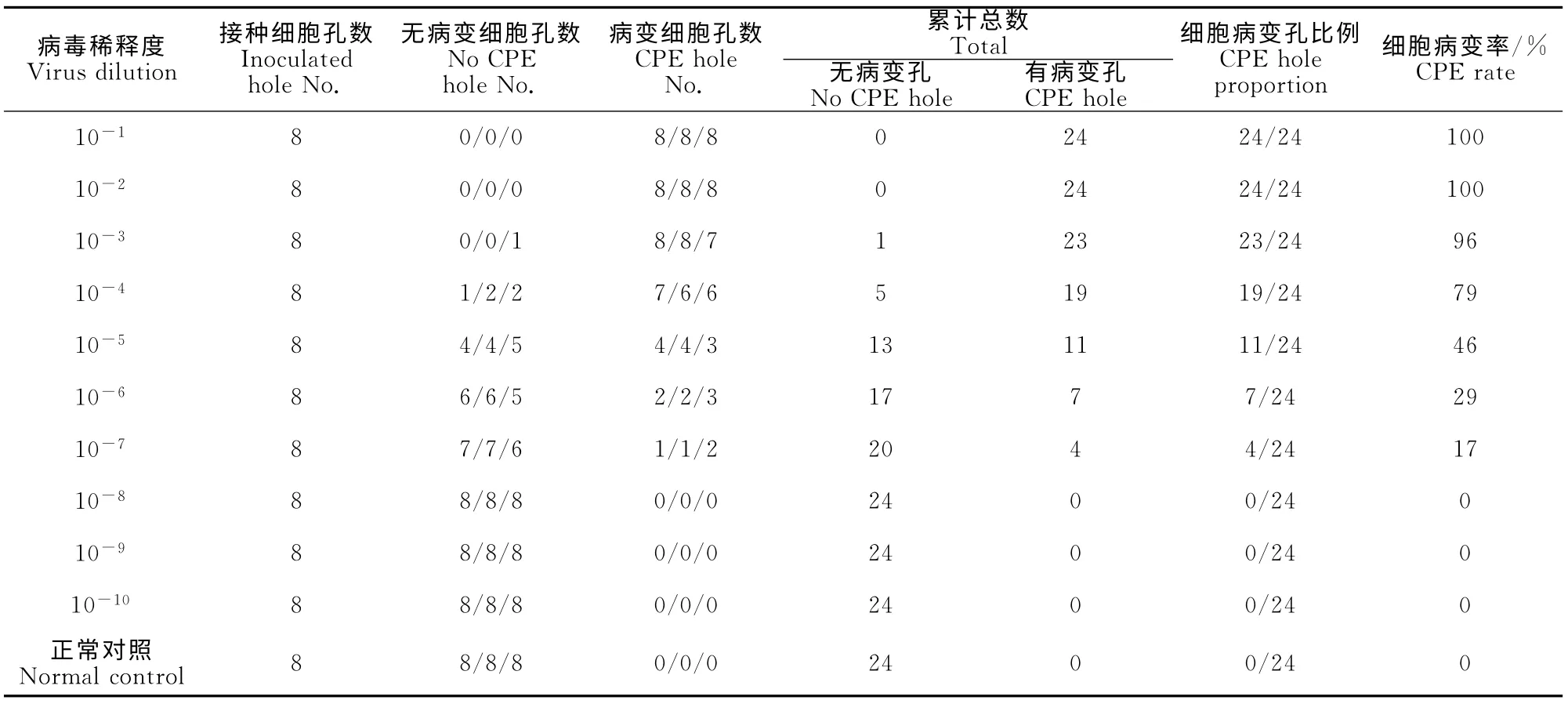
表2 病毒TCID50计算表Table 2 Table for calculating TCID50of virus
2.4.2 类泛素基因的相对表达量分析 致细胞病变型和非致细胞病变型BVDV 感染MDBK 细胞不同时间段后,对类泛素基因的表达量进行荧光定量PCR 检测。从图3中可以看出,随着感染时间的延长,对照组细胞SUMO1、SUMO2、SUMO3、Ubc9基因的相对表达量都基本保持不变(P>0.05)。在BVDV NADL 株感染组和BVDV shz 132 株感染组,SUMO1、SUMO2 及SUMO3 基 因 的 相 对 表 达量都呈现相同的变化趋势,在感染后12h上升,感染后24h下降,感染后48h再次上升。在感染后24 h,它们的相对表达量降至最低值,与对照组相比,差异极显著(P<0.01)。不同的是,在BVDV shz 132株感染的细胞中SUMO1、SUMO2及SUMO3基因的相对表达量都高于或接近于BVDV NADL 株感染的细胞。Ubc9 基因的相对表达量呈现出完全相反的变化趋势,在感染后12h下降,感染后24h上升,感染后48h再次下降。重要的是,除48h外,在其余感染时间BVDV shz 132株感染组中Ubc9基因的相对表达量都低于BVDV NADL株感染组。
3 讨论
蛋白质翻译后修饰是细胞蛋白质发挥生物学功能的重要调节机制之一。SUMO 是一种新发现的泛素样分子,能够动态可逆的修饰靶蛋白,参与靶蛋白的定位、调节转录活性、参与维持基因组的完整性、调节蛋白的核浆转运及信号转导、调节病毒感染[8-9]。目前,已发现哺乳动物4种SUMO 基因,分别是SUMO1、SUMO2、SUMO3 和SUMO4。SUMO1、SUMO2和SUMO3 基因在大部分组织中表达,而SUMO4 主要在肾脏、淋巴结和脾脏中表达[10]。Ubc9是SUMO 修饰中唯一的E2 结合酶,将SUMO 分子与靶蛋白相结合。由于SUMO4 基因核苷酸序列未公布,本文以SUMO1、SUMO2、SUMO3和Ubc9 为研究对象,探索BVDV 感染对细胞SUMO 系统的影响。

图2 类泛素基因的扩增曲线与熔解曲线Fig.2 Amplification curves and melting curves of ubiquitin like genes
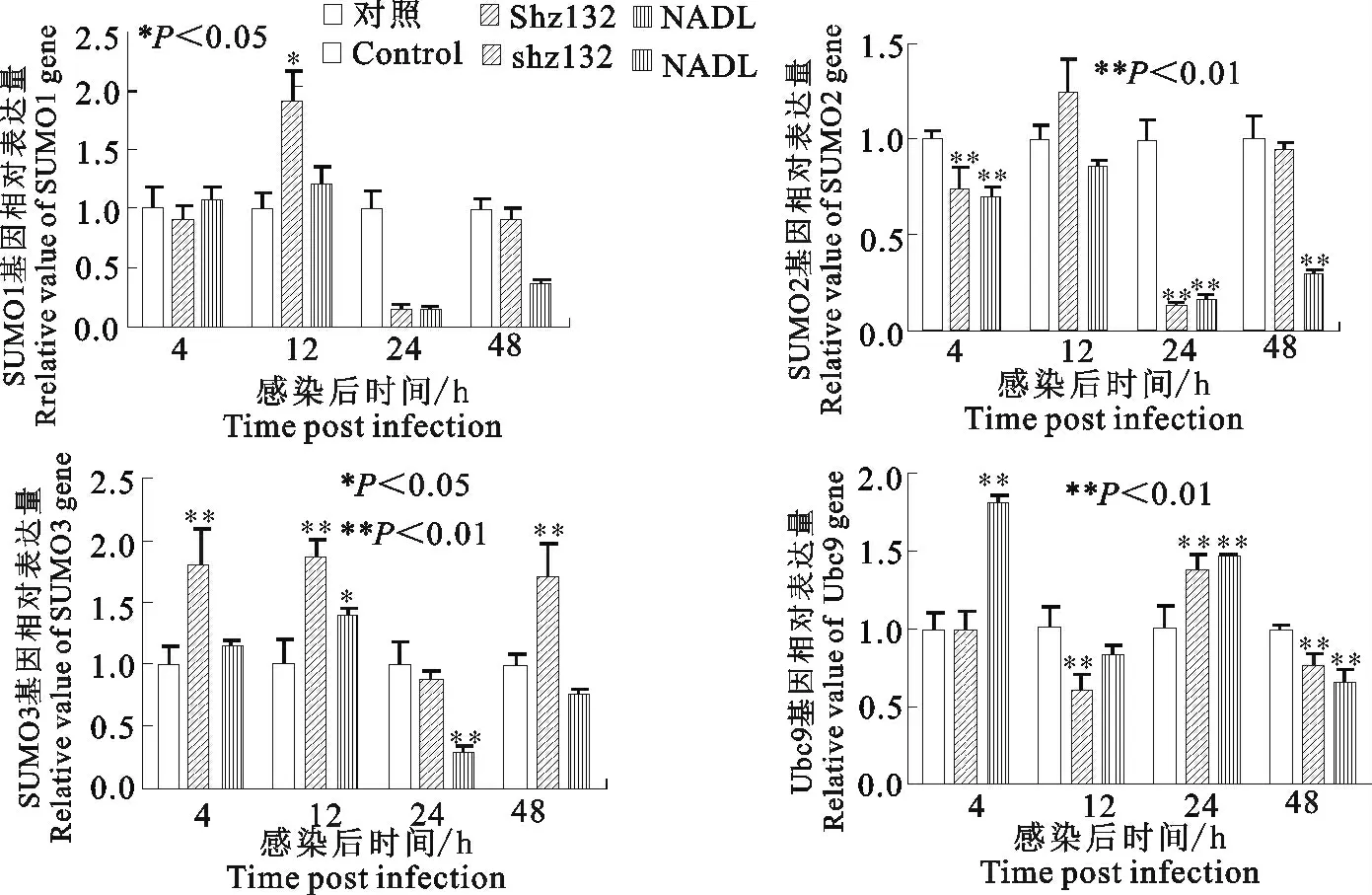
图3 不同生物型BVDV 感染MDBK 后,类泛素基因SUMO1、SUMO2、SUMO3及Ubc9的相对表达量Fig.3 Relative expression values of SUMO1,SUMO2,SUMO3,Ubc9genes of MDBK cells infected with different biotype BVDV strains
本研究发现,BVDV 感染调控了细胞SUMO 化修饰的转录水平,感染后24h,SUMO1、SUMO2及SUMO3基因的相对表达量下降,差异极显著,表明病毒感染抑制了宿主SUMO 化水平,这与Chen L M 等[11]的 观点一 致,也 说 明MDBK 细 胞SUMO 化修饰参与了BVDV 病毒在胞内的活动。向巨噬细胞中过表达SUMO1蛋白,能够提高布鲁菌引起的细胞凋亡,抑制布鲁菌在胞内的生存[12],那么SUMO 能否调控CP BVDV 感染诱导的MDBK细胞凋亡[13],仍有待于进一步研究。在大多数情况下,病毒蛋白发生SUMO 化修饰能够促进病毒的复制,有利于持续性感染[11],与此结论一致的是,在本研究中,BVDV shz 132 毒株感染细胞后SUMO1、SUMO2及SUMO3基因的相对表达量都要高于或接近于BVDV NADL株感染的细胞。也就是说,不同生物型BVDV 毒株感染引起细胞SUMO 基因转录水平不同程度的变化,可能与临床上不同的病理变化相关。宿主细胞SUMO 基因转录水平的变化,如何影响BVDV 在胞内的复制;SUMO 蛋白可与哪些病毒蛋白共价结合,进而影响病毒在胞内的活动。以上问题都有助于阐述BVDV 复杂的致病机制,也可能为新型疫苗的研发提供一个新的靶点。
[1] 任 艳,陈创夫,乔 军,等.牛病毒性腹泻病毒石河子株的分离与基因型鉴定[J].中国兽医学报,2010,30(4):433-439.
[2] 袁 浩,朱 军.蛋白质的类泛素化修饰[J].生命科学,2010,22(11):1161-1166.
[3] 叶晓峰,吴 乔.类泛素蛋白—SUMO[J].细胞生物学杂志,2004,24(1):10-14.
[4] 徐永青,曾广腾,钟阿勇.小泛素相关修饰物SUMO 的研究进展[J].安徽农业科学,2010,38(2):934-936.
[5] Chen S H,Chang L Y,Chen Y W,et al.Sumoylation-promoted enterovirus 71 3Cdegradation correlates with a reduction in viral replication and cell apotosis[J].J Biol Chem,2011,286(36):31373-31384.
[6] Gladue D P,Holinka L G,Fernandez-Sainz I J,et al.Effects of thee interactions of classical swine fever virus core protein with proteins of the SUM Oylation pathway on virulence in swine[J].Virology,2010(407):129-136.
[7] JoséG S,Michela C,María A G,et al.Regulation of vaccinia virus E3protein by small ubiquitin-like modifier proteins[J].J Virol,2011,85(24):12890-12900.
[8] 刘世荣,何 维.SUMO 化修饰:一种多功能的蛋白质翻译后修饰方式[J].医学分子生物学杂志,2006,3(3):212-215.
[9] 韦 玮,张 浩,毛建平,等.蛋白质SUMO 化修饰研究进展[J].中国生物工程杂志,2008,28(7):122-126.
[10] 何 莉,张 萍,吴敏昊,等.SUMO 化修饰在病毒感染中的作用研究进展[J].热带医学杂志,2012,12(1):116-119.
[11] Chen L M,Li S L,Li Y J,et al.Ubiquitin-like protein modifiers and their potential for antiviral and anti-HCV therapy[J].Expert Rev Proteomics,2013,10(3):275-287.
[12] 监 通.布鲁氏菌介导的宿主小泛素化及抗凋亡机制的研究[D].新疆石河子:石河子大学,2013.
[13] 王讲德,程婷婷,陈创夫,等.miRNA-125b 在牛病毒性腹泻病毒感染MDBK 细胞中诱导细胞凋亡的研究[J].中国预防兽医学报,2013,35(7):530-534.

