C17-吡唑琳基甾体衍生物诱导Hela 细胞凋亡研究
范宁娟,白育斌,师 伟,段 敏*
(1.西北农林科技大学生命科学学院,陕西杨凌712100;2.西北农林科技大学理学院,陕西杨凌712100)
在甾体分子结构的D-环引入含N、O、S等杂原子的杂环后将使得甾体衍生物呈现广泛的生物活性[1]。在杂环衍生物中,吡唑啉基甾体化合物因为具有止痛、抗菌、抗癌等功效为人们所熟悉,合成含有吡唑啉基的此类衍生物已经成为甾体结构改造和修饰的重 要 分 支[2-5]。2013 年,我 们 合 成 了 一 系 列新颖的吡唑啉基甾体衍生物,体外细胞毒活性试验显示部分化合物对肺癌(NCI-H460)、宫颈癌(Hela)和肝癌(HepG2)3种人体癌细胞具有较好的抑制活性,其中化合物1对Hela细胞的半数抑制率为12.5 μg/mL,细胞周期分析试验证明吡唑啉基甾体衍生物1(图1)具有诱导细胞周期停滞的特性[6]。据此推测吡唑啉基甾体衍生物1抑制Hela细胞增殖的活性可能与其诱导细胞周期停滞有关。

图1 吡唑啉基甾体衍生物1结构式Fig.1 Structure of derivative 1of steroidal derivatives
为了进一步研究其生物学功能,本研究将检测C17-吡唑琳基甾体衍生物1对Hela细胞的凋亡的作用及机制,为进一步明确其抗肿瘤活性研究奠定理论基础。
1 材料与方法
1.1 材料
Hela细胞购于中国科学院细胞库细胞株信息库。RPMI-1640培养液、DMEM 培养基、胎牛血清(FBS)购 自Gibico 公 司;Caspase-3、Caspase-8、Caspase-9活性检测试剂盒购自上海碧云天生物技术 有 限 公 司;Bax、PARP、Bcl-2、β-actin 抗 体 购 于Santa Cruz。辣根过氧化物酶(HRP)标记的二抗和ECL 显 色 试 剂 盒 购 自Pierce 公 司;Annexin-VFITC/PI凋亡检测试剂盒购自南京凯基生物工程有限公司。
1.2 方法
1.2.1 样品合成 C17-吡唑琳基甾体衍生物1参考文献[6]进行合成,将合成的样品溶于二甲基亚砜(DMSO)中,最终配制成2μg/μL 的储存液(含0.5 mL/L DMSO)备用,DMSO终浓度不超过10mL/L。
1.2.2 细胞培养与处理 Hela细胞用100 mL/L胎牛血清的DMEM 培养基,37 ℃、体积分数为5%的CO2条件下培养。用2.5mL/L 的胰蛋白酶(含0.4mL/L的EDTA)消化传代。
1.2.3 形态学观察 将Hela细胞接种至12孔板,待贴壁后,用12.5μg/mL的C17-吡唑琳基甾体衍生物1处理12、24、36、48h,吸弃培养基,每孔加入200μL的PBS和2μL的AO/EB染色液(各含100 μg/mL),室温避光孵育10min,用倒置荧光显微镜观察并拍照。用DMSO 处理的细胞作为阴性对照。
1.2.4 流式细胞仪检测吡唑啉基甾体衍生物1对Hela细胞凋亡率的影响 将Hela细胞接种于6孔板中,用,同时设置不用药物处理的正常细胞为对照,于药物处理后不同的时间点(0、12、24、36、48h)收集细胞,1 000r/min 离心5 min,弃掉上清,用PBS洗涤2次,收集细胞。先加入195μL Annexin V-FITC结合液轻轻重悬细胞,然后加入5μL Annexin V-FITC 和10μL 碘化丙啶染色液,轻轻混匀,最后于室温(20℃~25℃)避光孵育10min~20 min。孵育过程中可以重悬细胞2 次~3 次以改善标记效果。随即用流式细胞仪检测细胞凋亡率。
1.2.5 用分光光度法检测Caspase-3、-8和-9的活性 用12.5μg/mL 的药物处理Hela细胞,分别于不同时间点(0、12、24、36、48h)收集细胞。按照试剂盒说明书在收集的沉淀细胞中加入200μL 的Lysis buffer,吹打均匀,置冰上裂解1h,其间涡旋振荡3次,10 000r/min 离心1min,吸取上清至新的1.5mL EP管中。用BCA 法检测所提取的蛋白质浓度。分别吸取50μL 含总蛋白量为150μg的细胞裂解上清液,然后加入50μL 的2×Reaction buffer和5μL 的Caspase substrate,37 ℃避光孵育4h。以Lysis buffer 和Reaction buffer作为空白对照。在400nm 波长处测定吸光度值。
1.2.6 Western blot检测凋亡相关因子的变化
①细胞总蛋白的提取。收集细胞,PBS洗2次,加入400μL的预冷的含有1mmol/L PMSF的RIPA 裂解液,冰上裂解1h,期间涡旋混匀4 次,12 000r/min离心20min,取上清,加入4×loading buffer,煮沸10min,置-80℃保存备用。②线粒体蛋白与细胞浆蛋白的提取。收集细胞,PBS洗2次,4 ℃、600r/min离心10min,弃上清。加入1mL含有蛋白酶抑制剂(PMSF)的线粒体分离试剂,重悬细胞,匀浆细胞,4 ℃、600r/min离心10 min,将上清移至新的离心管中,4℃、11 000r/min 离心10 min(上清为去除了线粒体的胞浆蛋白液,沉淀为线粒体)。冷却后,置于-80℃中保存备用。③Western blot分析与细胞凋亡相关因子的变化。取30μg蛋白样品进行SDS-PAGE电泳,将蛋白转至用甲醇活化的PVDF膜上,用含有50g/L脱脂奶粉的PBS封闭2h,用含20g/L 脱脂奶粉的一抗4 ℃孵育过夜。次日,将PVDF 膜用PBST 洗涤3 次,每次6 min。然后将PVDF膜置于用20g/L脱脂奶粉稀释的HRP标记的二抗中,室温孵育1h,将PVDF 膜用PBST 缓冲液振摇洗涤5次,每次5min。将ECL试剂显影。
1.2.7 统计分析 将试验所得结果用统计学软件SPSS 19.0 进行单因素方差分析,试验数据运用Dunnet t的双尾检验多重比较法进行显著性检验,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
2 结果
2.1 C17-吡唑琳基甾体衍生物1诱导Hela细胞凋亡的形态学变化
透射电镜观察C17-吡唑琳基甾体衍生物1处理的Hela细胞,细胞核浓缩,随着时间的延长,细胞核发生明显的碎裂(图2A)。荧光显微镜下观察AO/EB 染色后的Hela 细胞,对照组细胞只被AO 染色,细胞核内呈均匀的亮绿色荧光;而处理组细胞于12h开始出现核内染色质固缩,随着处理时间的延长,细胞核发生明显的碎裂,晚期凋亡细胞的胞核内出现红色斑点(图2C)。
2.2 C17-吡唑琳基甾体衍生物1对Hela细胞凋亡率的影响
根据Annexin V-FITC细胞凋亡检测试剂盒说明书,运用双染流式细胞术检测细胞凋亡率。结果显示,药物处理细胞24h时,细胞凋亡率为21.3%,与对照组相比显著极差异,在48h时细胞的凋亡率为52.4%,与对照组相比差异极显著,表明C17-吡唑琳基甾体衍生物1能够诱导Hela细胞发生凋亡,且细胞的凋亡率与处理时间正相关(图2B)。

图2 吡唑啉基甾体衍生物1诱导Hela细胞凋亡Fig.2 C17-pyrazolinyl steroidal derivative induced apoptosis of Hela cells
2.2 C17-吡 唑 琳 基 甾 体 衍 生 物1 对Hela 细 胞Caspase活性的影响
利用Caspase检测试剂盒检测C17-吡唑琳基甾体衍生物1对Hela细胞Caspase分子的活化的影响。12.5μg/mL的C17-吡唑琳基甾体衍生物1处理Hela细胞后,Caspase-8分子活性无显著变化;而Caspase-3和Capase-9分子的活性在药物处理12h后发生了显著变化,在36h时,Caspase-3与Caspase-9的活性达到最高,与0h对照组细胞相比活性分别增加到了6.22和3.76倍,差异极显著(图3A)。
2.3 C17-吡唑琳基甾体衍生物1促进Caspase-3的切割底物PARP的降解
Caspase-3的切割底物PARP 在C17-吡唑琳基甾体衍生物1处理后12h开始发生降解,随着药物处理时间的延长,PARP发生降解的程度越明显,表明PARP能够被活化后的Caspase-3 切割,细胞内存在依赖于Caspase-3的其他凋亡信号转导通路被激活(图3B)。
2.4 C17-吡唑琳基甾体衍生物1 对线粒体通路中Bax与Bcl-2蛋白表达水平的影响
Western blot检测表明,C17-吡唑琳基甾体衍生物1处理Hela细胞后,细胞内促凋亡蛋白Bax表达量随处理时间而增加,抑凋亡蛋白Bcl-2表达量则逐渐降低(图4A)。
2.5 C17-吡唑琳基甾体衍生物1 对线粒体通路中Bax与Cytochrome c转位的影响
通过Western blot检测表明,药物处理Hela细胞12h后,可以在胞浆中检测到Cytochrome C,并且其表达量随时间的延长而逐渐增加,说明Cytochrome C由线粒体释放到胞浆,同时在胞浆中Bax表达量随时间延长而降低(图4B)。
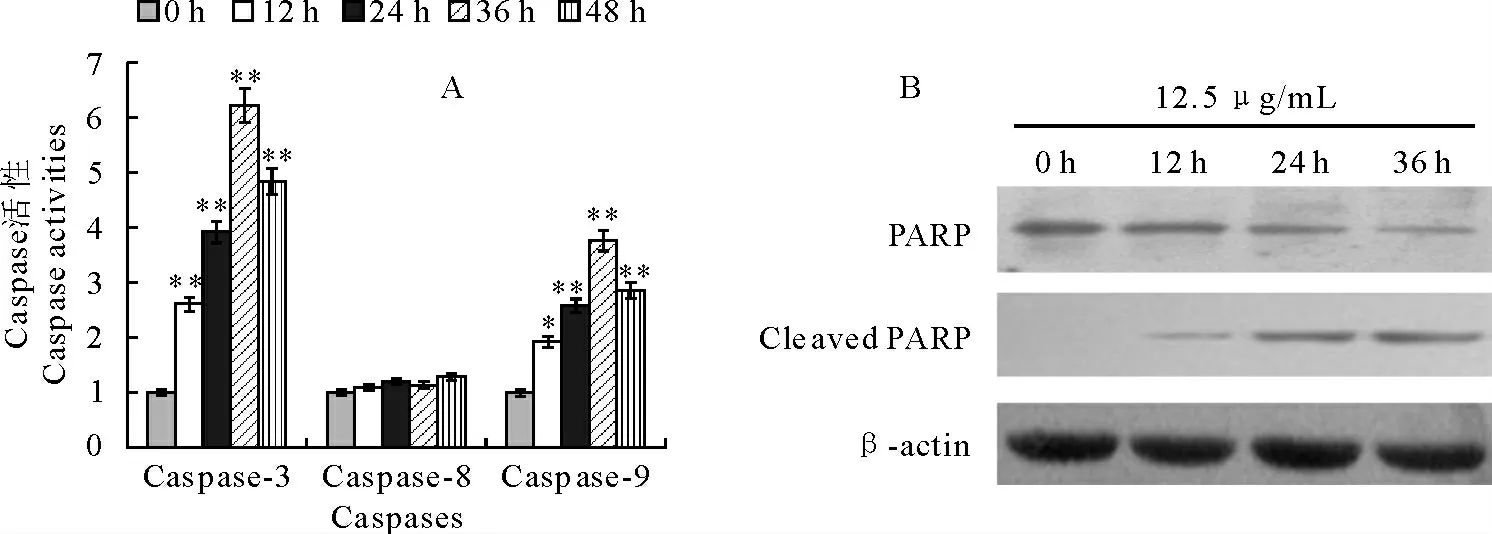
图3 吡唑啉基甾体衍生物1对Hela细胞Caspase活性的影响Fig.3 The effect of C17-pyrazolinyl steroidal derivative on Caspases activities of Hela cells

图4 C17-吡唑啉基甾体衍生物1对Hela细胞Ba、Bcl-2和细胞色素C的作用Fig.4 The effect of C17-pyrazolinyl steroidal derivative on Bax,Bcl-2,and cytochrome C in Hela cells
3 讨论
细胞凋亡是一种由基因控制的程序性细胞死亡[7]。细胞形态学观察发现,早期凋亡时,细胞核固缩,核内染色质凝集,细胞质浓缩。中晚期凋亡时,细胞膜内陷,细胞核碎裂,有凋亡小体的产生[8]。本研究利用AO/EB 染色,观察C17-吡唑琳基甾体衍生物1处理后Hela细胞核形态变化,发现经药物处理的Hela细胞的染色质固缩,随着处理时间的延长,核碎裂更加严重,最终导致凋亡小体的产生,为典型的凋亡细胞特征。
Caspases蛋白酶为天冬半胱氨酸蛋白酶,其介导的蛋白质裂解在细胞凋亡过程中起着重要的作用[9]。细胞凋亡的信号通路主要包括死亡受体通路和线粒体通路[10]。死亡受体通路主要依赖于Caspase-8活化,线粒体通路的激活主要依赖于Caspase-9活化[11]。本研究检测了Caspases活性,C17-吡唑琳基甾体衍生物1处理后,能够活化Hela细胞内的Caspase-3 和Caspase-9,而Caspase-8 的活性没有显著差异,表明该药物能够通过线粒体途径诱导细胞发生凋亡。
Bcl-2家族在细胞凋亡过程中起重要作用,其家族成员主要包括促凋亡蛋白Bax、Bad、Bak 和抑凋亡蛋白Bcl-2、Bcl-XL、Bcl-w 等,其中Bcl-2 和Bax是调控细胞凋亡的两个关键蛋白[12-14]。本研究发现,C17-吡唑琳基甾体衍生物1 处理Hela细胞后,Bax/Bcl-2的比率升高,胞浆内游离的Bax 转移到线粒体中,从而改变了线粒体膜的通透性,进而使线粒体中的促凋亡分子Cyt c释放到胞质中,参与线粒体介导的细胞凋亡通路。综上所述,合成的C17-吡唑琳基甾体衍生物1 能够通过线粒体途径诱导Hela细胞发生凋亡,为进一步研究其抗肿瘤作用提供了依据。
[1] Schneider G,Wolfling J.Synthetic cardenolides and related compounds[J].Curr Org Chem,2004,8(14):1381-1403.
[2] Amr Ael G,Sayed H H,Abdulla M M.Synthesis and reactions of some new substituted pyridine and pyrimidine derivatives as analgesic,anticonvulsant and antiparkinsonian agents[J].Archiv Der Pharmazie,2005,338(9):433-440.
[3] Banday A H.Studies on novel D-ring substituted steroidal pyrazolines as potential anticancer agents[J].Steroids,2010,75(12):805-809.
[4] Banday A H,Zargar M I,Ganaie B A.Synthesis and antimicrobial studies of chalconyl pregnenolones[J].Steroids,2011,76(12):1358-1362.
[5] Ivanyi Z.Synthesis of D-ring-substituted(5′R)-and(5′S)-17 beta-pyrazolinylandrostene epimers and comparison of their potential anticancer activities[J].Steroids,2012,77(5):566-574.
[6] Fan N J.Synthesis and cytotoxic activity of some novel steroidal C-17pyrazolinyl derivatives[J].Euro J Med Chem,2013,69:182-190.
[7] Tower J.Programmed cell death in aging[D].Ageing Res Rev,2015.
[8] Guicciardi M E,Gores G J.Apoptosis as a mechanism for liver disease progression[J].Seminar Liver Dis,2010,30(4):402-410.
[9] McIlwain D R,Berger T,Mak T W.Caspase functions in cell death and disease[J].Cold Spring Harbor Perspect Bioly,2013,5(4).doi:10.1101/cshperspect.a008656.
[10] Wang C X,Youle R J.The role of mitochondria in apoptosis[J].Annu Rev Genetics,2009,43:95-118.
[11] Yao Z.RIP1modulates death receptor mediated apoptosis and autophagy in macrophages[J].Mol Oncol,2015,9(4):806-817.
[12] Cheng E.Molecular control of mitochondrial apoptosis by the BCL-2family[J].Blood,2009,114(22):1577-1578.
[13] Wang J.Mitochondrial division inhibitor 1(mdivi-1)enhances death receptor-mediated apoptosis in human ovarian cancer cells[J].Biochem Biophys Res Commun,2015,456(1):7-12.
[14] Ding L.TGEV nucleocapsid protein induces cell cycle arrest and apoptosis through activation of p53signaling[J].Biochem Biophys Res Commun,2014,445(2):497-503.

