副猪嗜血杆菌β-半乳糖苷酶的原核表达与活性检测
刘英玉,夏利宁,刘俊飞,姚 刚,何启盖
(1.新疆农业大学动物医学学院,新疆乌鲁木齐830052;2.新疆天康畜牧科技有限公司,新疆昌吉830011;3.华中农业大学大学动物医学学院,湖北武汉430070)
副猪嗜血杆菌(Haemophilus parasuis,HPS)是猪群上呼吸道的一种常在菌,但在特定条件下可以侵入机体并引起严重的全身性疾病,以纤维素性多发性浆膜炎、关节炎和脑膜炎为特征,该病又称为Glasser′s disease[1]。蔡旭旺等[2]对HPS做 了生化鉴定,大多数生化反应较弱,对糖类发酵多不稳定,可发酵葡萄糖、蔗糖、果糖、半乳糖、D-核糖和麦芽糖,不发酵甘露糖、木糖、L-阿拉伯糖、蜜三糖,少数菌株发酵乳糖。
β-半乳糖苷酶(β-galactosidase,BgaC)又称乳糖酶,是一种能把乳糖水解成葡萄糖和半乳糖的酶,是白色或淡黄色粉末,无臭,微甜,分子质量为100ku~850ku。在水中呈混沌液(大部分溶解),不溶于乙醇、丙酮。该酶主要分布在植物、微生物及哺乳动物肠内,其与食品工业、医药卫生较为密切,因而研究较多。不同来源的微生物BgaC 在酶学性质上差别较大,如分子质量、最适温度、最适pH 和热稳定性等。一般说来,霉菌产生的BgaC 是胞外酶,较耐热、耐酸,不需要活化剂和稳定剂,稳定性较高,最适pH 偏酸性,一般在3~4 左右[3]。细菌BgaC 通常也是胞内酶,最适pH 中性附近,最适温度比酵母菌稍高,但高温菌BgaC 的最适温度可以很高,热稳定性也较好。大肠埃希菌(Escherichia coli)BgaC 是迄今为止研究最深入、了解最透彻的一种酶,商品化产品已大量应用于生化分析中。近年来,肺炎链球菌β-半 乳 糖 苷 酶 的 研 究 比 较 多,Campuzano S 等[4]对轻型链球菌NCTC 12261菌株进行β-半乳糖苷酶的克隆表达和酶活性特性研究,该酶编码2 411个氨基酸,分子质量为268ku,推测该蛋白包含1 个N-末端的信号肽和C-末端的胆碱结合域由5 个固定重复结构组成,此结构便于定向为细胞壁分泌酶。酶比活力为2 500U/mg,最适pH 为6.0~6.5,最适温度为30 ℃~40 ℃,在生物技术领域应用具有特有的特性。
β-半乳糖苷酶基因被广泛应用于分子生物学研究当中,包括载体的构建、转基因研究、基因治疗等多个领域。不同来源BgaC 在性质上的差异为寻找优良特性的酶源提供了可能性。副猪嗜血杆菌SH0165 菌株基因组DNA(GenBank accession number:CP001321)已完成测序[5]。通过序列分析,发现存在BgaC 基因,本研究进一步对BgaC氨基酸序列进行了生物信息学分析,并通过原核表达和β-半乳糖苷酶的活性测定来研究其的酶学特性,为其生产和应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 副猪嗜血杆菌SH0165用胰蛋白胨大豆琼脂(Tryptic Soy Agar,TSA)培养基中加入烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)和新生牛血清来培养,培养条件是在37 ℃,静置培养24h~48h。E.coli菌株用LB 固体或液体培养基培养。副猪嗜血杆菌SH0165、质粒pET32a、大肠埃希菌BL21(DE3)和感受态细菌DH5α,华中农业大学农业微生物学国家重点实验室动物病原分子流行病学室保存。
1.1.2 主要试剂和仪器 邻硝基苯β-D-半乳吡喃糖苷(o-nitropheyl-β-D-galactopyranoside,ONPG)、β-巯基乙醇、异丙基硫代半乳糖苷(IPTG)、氨苄青霉素,Sigma公司产品;限制性内切酶(BamHⅠ和HindⅢ)、T4DNA 连接 酶、TaqDNA 聚合酶、DNA Marker,宝生物工程(大连)有限公司产品;新生牛血清,四季青公司产品;胶回收试剂盒、小提质粒试剂盒,Omega公司产品;PCR 仪、SDS-PAGE垂直电泳仪、酶标仪、TSA,Bio-Rad公司产品;凝胶电泳仪,北京六一仪器厂产品;凝胶成像系统,Gene Company公司产品;NAD,中国上海化学试剂公司产品;Ni-NTA 亲和层析树脂,Invitrogen公司产品。
1.2 方法
1.2.1 BgaC 基因的克隆和分析 参考GenBank中HPS SH0165基因组的序列设计BgaC 基因的全长引物,引物序列为BgaC-S:CGGGATCCATGCCTTTCCAAATCGGCGAAA;BgaC-A:GGAAGC TTTTATAAGTTCTTCGTATTCAAC。引物序列增加了酶切位点BamHⅠ和HindⅢ,引物浓度10 μmol/L。通过煮沸法提取副猪嗜血杆菌SH0165的模板,反应体系50μL:10×buffer 5μL dNTPs 4μL,Taq 酶0.25μL,模板4μL,引物各1μL,H2O 46.75μL。反应条件:94 ℃5 min;94℃30s,58 ℃30s,72 ℃2min,35循环;72 ℃10 min。取7μL反应液进行10g/L琼脂糖凝胶电泳,若出现目的条带则用天根公司的胶回收试剂盒回收目的条带,将目的片段用BamHⅠ和HindⅢ进行双酶切,与经过同样酶切处理的pET-32a进行连接,转化大肠埃希菌DH5α,以PCR 和限制性酶切筛选获得阳性克隆进行测序,将测序得到的序列进行拼接,然后利用Blastn对核苷酸序列进行比对,用Blastp及ExPASy在线分析软件对蛋白序列进行分析,用Mega软件对B-Gal基因推导的氨基酸序列进行系统进化分析。
1.2.2 BgaC基因的表达和纯化 测序正确的质粒转入受体菌BL21,采用限制性酶切筛选获得阳性克隆的BL21菌体培养至OD 600nm≈0.6,加终浓度为0.1mmol/L的异丙基硫代半乳糖苷(IPTG)进行诱导表达5h,收集菌液,6 500r/min离心5min,去上清后用0.1倍体积的ddH2O 将菌体混悬均匀,在冰上用超声波破碎菌体,12 000r/min离心30min,收集上清液。用Ni-NTA 亲和层析树脂(Invitrogen)纯化含有(his)6标签的重组蛋白,参照产品说明书进行。蛋白的纯度用聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析验证,纯化后的蛋白采用1976年由Bradford建立的考马斯亮兰法(Bradford法)测定[6],蛋白含量以牛血清白蛋白为标准物。最终,重组蛋白HP0245EC冻存于-20 ℃。
1.2.3 β-半乳糖苷酶活性的测定 酶活性测定方法根据文献[6]:将BgaC 蛋白用1mL 反应液中[Z buffer,每50 mL:0.80 g Na2HPO4·7H2O(0.06mol/L),0.28 g NaH2PO4·H2O(0.04 mol/L),0.5mL KCl(0.01mol/L);0.05mL Mg-SO4(0.001 mol/L),0.135 mLβ-巯基乙醇(BME)(0.05mol/L),加入40mL H2O 后调整pH 为7.0,定容至50mL,保存于4 ℃]混匀后,加入0.1mL生色底物ONPG(0.008g/mL);在37 ℃下孵育30 min;加入0.5mL终止液(1mol/L Na2CO3)终止反应;取溶液上清,测量420nm 和550nm 下的吸光度。酶活性测定采用一式3 份。1 个酶活性单位(U)是指在特定条件下,在1 min内能水解1nmol底物的酶量。比活性为每毫克蛋白质所具有的酶活力单位数,一般用U/mg蛋白质表示。
测定反应液pH 对重组菌酶活性作用的影响,根据酶活性测定方法选择pH5~9,孵育30min来测定420nm 和550nm 下的吸光度,其中pH5~5.5用弱盐酸溶液调节,pH6~9用低浓度NaOH 调节。测定温度对重组菌酶活性作用的影响,根据酶活性测定方法选择温度范围在0 ℃~64 ℃[7],孵育30min测定420nm和550nm 的吸光度。酶活性测定采用一式3份。
2 结果
2.1 副猪嗜血杆菌BgaC基因的生物信息学分析
2.1.1 副猪嗜血杆菌BgaC 氨基酸序列同源性分析 通过BgaC-S和BgaC-A 引物扩增副猪嗜血杆菌SH0165 菌 株,得 到1 791bp 的DNA 条 带,将PCR 产物酶切后与载体pET-32a进行连接后,转入大肠埃希菌DH5α,挑取鉴定正确的重组菌进行测序,测序结果与NCBI 数据库中副猪嗜血杆菌SH0165 的BgaC 基 因 序 列(ACL31886.1)具 有100%的符合率。Blastp比对结果表明,副猪嗜血杆菌BgaC 氨基酸序列与NCBI数据库中其他微生物的BgaC基因氨基酸序列的相似性不高。其中,副猪嗜血杆菌BgaC 氨基酸序列与溶血性曼氏杆菌A1/A6PKL10BgaC(EXI62636.1)的相似性最高为82%。ExPASy 在线分析表明,副猪嗜血杆菌BgaC氨基酸序列是属于糖苷水解酶家族35(glycoside hydrolase family 35,CH35)的成员家族,EC 3.2.1.-,催化质子的供体是谷氨酸(Glu),β-半乳糖苷酶有1个TIM 筒结构和2个完整的β区域。
所有序列是通过NCBI数据库下载的(NCBI数据库网址:www.ncbi.nlm.nih.gov)。多序列比对是根据Cheng W[8]和Jeong J K[9],使用的软件是Lasergene7.1和MEGA6。如图1 所示,采用黑色三角形标记半乳糖结合位点的氨基酸,采用黑色圆形标记3 个芳香族残基位点色氨酸240 和色氨酸243,酪氨酸455,环LA(Trp240-Asp255)和环LB(Glu448-Ala461)结构采用黑色箭头表示,守卫在活性位点口袋状区域的表面哑铃型通道处,且发现3个芳香族残基位点色氨酸240和色氨酸243,酪氨酸455是此通道的峡部。副猪嗜血杆菌BgaC 有7 个高度保守的区域,采用灰色方框标记,2个氨基末端区域(domains 1 和2),3 个 小 的 中 心 区 域 群(domains 3,4和5),2个小的羧基末端区域(domains 6和7)和NHL 同源序列(the NHL repeat homologous domain)。

图1 序列比较不同病原体的BgaC同源性Fig.1 BgaC homology of sequence comparison of various organisms
2.1.2 副猪嗜血杆菌BgaC氨基酸序列系统进化分析 用Mega 6.0软件对β-半乳糖苷酶基因的氨基酸序列与GenBank中已登录的其他细菌的β-半乳糖苷酶基因氨基酸序列进行系统进化分析表明,如图2所示,12类的β-半乳糖苷酶基因被聚为3个大类群,副猪嗜血杆菌SH0165BgaC 基因与溶血性曼氏杆菌PKL10 亲缘关系最近,并且与粪肠球菌DENG1(BgaB)、肺炎链球菌TIGR4、科里氏杆菌属PW2、苏云金芽胞杆菌和粪肠球菌DENG1(LacZ)聚为一类,拟南芥、大熊猫、芽胞杆菌、链霉菌属Mg1和多形拟杆菌VPI-5482聚为一类,而乳酸杆菌单独成一类,与副猪嗜血杆菌SH0165的亲缘关系最远。
2.2 重组pET-32a+BgaC的表达和生物学特征
2.2.1 重组pET-32a+BgaC 基因克隆与表达 将重组质粒pET32a+BgaC转入受体菌BL21,经PCR鉴定转化成功后,用IPTG 对重组菌进行诱导表达,收集菌体后进行破碎,离心取上清作为粗体重组菌pET32a+BgaC。用His标签纯化树脂纯化离心后的上清,最后洗脱的蛋白是携带His标签的BgaC蛋白。通过SDS-PAGE 检测重组菌pET32a+BgaC和纯化后BgaC 蛋白的表达情况(图3),pET32a+BgaC重组菌表达蛋白为82.4ku。

图2 不同来源β-半乳糖苷酶基因的氨基酸序列聚类分析(括号中为各物种氨基酸序列GenBank登录号)Fig.2 The cluster analysis based on alignment of amino acid sequences among UPGMA and some publishedβ-Gal genes of other species in GenBank database.Amino acid sequences accession №in GenBank of different species is in brackets

图3 SDS-PAGE鉴定诱导表达pET32a+BgaC重组蛋白和纯化BgaC蛋白Fig.3 Identification of induced expression of pET32a+BgaC recombinant protein and purified BgaC protein by SDS-PAGE
2.2.2 测定纯化BgaC蛋白的酶活性和pET-32a+BgaC重组蛋白的生物学特征 采用考马斯亮蓝法做出标准蛋白的标准曲线,R2=0.978 4。在OD 595nm 处分别测定pET32a+BgaC 重组蛋白和BgaC 纯 化 蛋 白 的 含 量 为3.8 mg/mL 和0.7 mg/mL。按照酶活性测定方法取4μL BgaC纯化蛋白(0.7mg/mL)作为底物来测定酶的活性,该酶的活性单位为5U,酶比活力为1 795U/mg。
取6μL 粗提的pET32a+BgaC 重组蛋白(3.8 mg/mL)测定pH5~9范围内的酶活性(图4),pH6~7时的酶活性可达到180U,在此pH 范围内副猪嗜血杆菌的BgaC活性能够起到较理想的催化作用。取6 μL 粗 提 的pET32a+BgaC 重 组 蛋 白(3.8 mg/mL)测定温度在0℃~64℃的酶活性(图5),温度在30 ℃~37 ℃时的酶活性可达到180 U,30 ℃~37 ℃时副猪嗜血杆菌的BgaC活性的最佳温度。
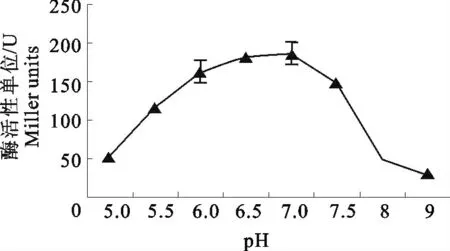
图4 不同pH 的酶活性测定Fig.4 Detection of enzyme activities in various pHs

图5 测定不同温度的酶活性Fig.5 Detection of enzyme activities in various temperatures
3 讨论
β-半乳糖苷酶(EC 3.2.1.23)广泛的应用于乳品工业和分子生物学研究[10-11]。β-半乳糖苷酶是糖苷水解酶的一种,可以将乳糖等含β-半乳糖苷双糖和寡糖降解为单糖,为生物提供可利用的碳素营养[12]。经过长期的自然进化,微生物为了适应不同的生活环境,自然界的广泛分布的β-半乳糖苷酶被分成了许多种类。根据氨基酸序列的相似性和系统进化分析,β-半乳糖苷酶可以分别归入糖苷水解酶1、2、35 和42 家 族(glycoside hydrolase family,GHF)[13]。家族之间的氨基酸序列相似性很低,每个家族具有独特的保守结构域。为了方便研究糖苷酶的作用机理,Henrissat B[14]提出了一种新的序列分类法,该方法具有方便获取糖苷酶结构、功能和作用机理信息,显示酶之间相互进化关系,预测未知酶的功能区域的优点。随着细菌全基因组测序的进行,在更多的细菌中发现了该酶。副猪嗜血杆菌BgaC是属于CH35家族的成员,但其具体生物活性研究还没有报道。Jeong J K 等[15]报道肺炎链球菌BgaC的序列比较,发现肺炎链球菌BgaC 氨基酸序列中存在7个高度保守的区域,2个氨基末端区域,3个小的中心区域群,2个小的羧基末端区域和NHL同源序列[9],通过构建突变株研究发现BgaC蛋白在链球菌的黏附性和致病性方面具有重要意义。副猪嗜血杆菌BgaC氨基酸序列与肺炎链球菌TIGR4β-半乳糖苷酶的相似性虽然只有54%,但通过多序列比对,发现副猪嗜血杆菌BgaC也存在7个高度保守的区域,与肺炎链球菌报道的一致。越来越多的证据证明感染肺炎球菌可以导致宿主中聚糖发生变化,肺炎链球菌可以通过胞外糖苷酶活性修饰N 端-连接的聚糖,O 端-连接的聚糖和氨基多糖途径。链球菌和副猪嗜血杆菌都是上呼吸道病原菌,且都是营养苛刻性细菌,菌落形态相似,猪只感染后临床症状会出现关节积液,胸膜炎和脑膜炎的症状,预测肺炎链球菌与副猪嗜血杆菌在β-半乳糖苷酶具有类似的功能,值得我们进一步研究。
1998年β-半乳糖苷酶被中国食品添加剂标准化委员会列为食品添加剂新酶种。目前应用于乳品工业的β-半乳糖苷酶多来自于酵母、曲霉菌或乳酸菌。Nguyen等提纯了嗜酸乳杆菌R22菌株的LacLM,通过研究酶学特性确认该酶可用于乳品工业[16]。BgaC除参与乳糖的消化吸收外,也是水解蛋白多糖的重要水解酶。主要用于乳品工业,加入乳品中可使乳糖分解为半乳糖和果糖而促进其消化的酶,降低乳糖结晶析出并增加甜度。Campuzano S等[4]对慢型链球菌NCTC 12261菌株进行β-半乳糖苷酶的研究,发现β-半乳糖苷酶由2 411个氨基酸编码,分子质量为268ku,酶比活力为2 500U/mg,最适pH为6.0~6.5,最适温度为30 ℃~40 ℃。本研究发现原核表达的副猪嗜血杆菌β-半乳糖苷酶分子质量为82.4ku,酶比活力为1 795 U/mg,最适pH 为6.0~7.0,最适温度为30 ℃~37 ℃。与慢型链球菌NCTC 12261菌的BgaC进行比较,发现副猪嗜血杆菌BgaC 蛋白的分子质量较小,但酶比活力、最适pH 和最适温度的差别不是很大。副猪嗜血杆菌BgaC蛋白具有糖苷酶活性,能够介导糖蛋白的降解。
β-半乳糖苷酶可用作酶免分析的标记酶,中性β-半乳糖苷酶(SA-β-gal)是一种很好的可用于体内外衰老研究的生物学标志[3]。β-半乳糖苷酶基因在基因工程中的应用包括作为报告基因构建载体转基因研究和基因治疗等多个分子生物学研究领域。目前分子生物学研究中使用的克隆载体一般都具有一段大肠埃希菌β-半乳糖苷酶的启动子及其α肽链的DNA 序列,可通过蓝白菌的颜色变化筛选出阳性重组载体菌[17]。在基因治疗方面,Fukui T 等[18]为了探讨基因治疗用于口腔癌的可能性,将含β-半乳糖苷酶基因的腺伴随病毒载体转染人口腔鳞状细胞癌细胞株,通过检测β-半乳糖苷酶的表达情况来研究转染的效率。Terra V S等[19]研究表明肺炎链球菌中β-半乳糖苷酶能够从宿主糖苷类代谢中获得能量,证明宿主体内有效的糖蛋白降解与肺炎球菌的毒力有关,该蛋白可用于分子诊断和亚单位疫苗的候选基因。副猪嗜血杆菌β-半乳糖苷酶是分子质量较小的糖苷酶蛋白,在氨基酸序列上存在高度保守的区域,该蛋白也具有较高糖苷酶活性,因此,在生物技术领域具有广泛的应用前景。
[1] 刘英玉.副猪嗜血杆菌耐药性调查和耐药机制研究[D].湖北武汉:华中农业大学,2013.
[2] 蔡旭旺,刘正飞,陈焕春,等.副猪嗜血杆菌的分离培养和血清型鉴定[J].华中农业大学学报,2005(24):55-58.
[3] 郭志华.产β-半乳糖昔酶芽抱杆菌的筛选及酶学性质研究[D].山东青岛:山东大学,2009.
[4] Campuzano S,Serra B,Llull D,et al.Cloning,expression,and characterization of a peculiar choline-binding beta-galactosidase fromStreptococcus mitis[J].Appl Environ Microbiol,2009,75(18):5972-5980.
[5] Yue M,Yang F,Yang J,et al.Complete genome sequence of Haemophilus parasuis SH0165[J].Bacteriol J,2009(191):1359-1360.
[6] Bradford M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976(72):248-254.
[7] Miller J H.Experiments in molecular genetics[M].Cold Spring Harbor:NY,1972.
[8] Cheng W,Wang L,Jiang Y L,et al.Structural insights into the substrate specificity of Streptococcus pneumoniaeβ(1,3)galactosidase BgaC[J].Biol Chem J,2012,287(27):22910-22918.
[9] Jeong J K,Kwon O,Lee Y M,et al.Characterization of the Streptococcus pneumoniae BgaC protein as a novel surface-galactosidase with specific hydrolysis activity for the Gal1-3GlcNAc moiety of oligosaccharides[J].Bacteriol J,2009,191(9):3011-3023.
[10] Chen W,Chen H,Xia Y,et al.Production,purification,andcharacterization of a potential thermostable galactosidase for milk lactose hydrolysisfromBacillus stearothermophilus[J].J Dairy Sci,2008,91(5):1751-1758.
[11] Ravelojaona V,Robert A M,Robert L.Expression of senescence-associated beta-galactosidase(SA-beta-Gal)by human skin fibroblasts,effect of advanced glycation end-products and fucose or rhamnose-rich polysaccharides[J].Arch Gerontol Geriatr,2009,48(2):151-154.
[12] 汪 川,张朝武,余 倩,等.保加利亚乳杆菌产β-半乳糖苷酶特性的研究[J].现代预防医学,2005,32(10):1274-1277.
[13] Hidaka M,Fushinobu S,Ohtsu N,et al.Trimeric crystal structure of the glycosidehydrolase family 42 beta-galactosidase fromThermus thermophilus A4and thestructure of its complex with galactose[J].J Mol Biol,2002,322(1):79-91.
[14] Henrissat B.A classification of glycosyl hydrolases based on amino acid sequence similarities[J].Biochem J,1991,280:309-316.
[15] King S J.Pneumococcal modification of host sugars:a major contributor to colonization of the human airway[J].Mol Microbiol,2010,25(1):15-24.
[16] 潘 渠.嗜酸乳杆菌lac基因簇两个β-半乳糖苷酶基因的克隆表达和功能研究[D].四川重庆:第三军医大学,2008.
[17] 张 莉,李庆章,田 雷.β-半乳糖苷酶研究进展[J].东北农业大学学报,2009,40(7):128-131.
[18] Fukui T,Hayashi Y,Kagami H,et al.Suicide gene therapy for human oral squamous cell carcinoma cell lines with adeno-associated virus vector[J].Oral Oncol,2001,37(3):211-215.
[19] Terra V S,Homer K A,Rao S G,et al.Characterization of novelβ-galactosidase activity that contributes to glycoprotein degradation and virulence in Streptococcus pneumoniae[J].Infect Immun,2010,78(1):348-357.

