猪流行性腹泻病毒流行毒株S基因的遗传变异和B 细胞线性抗原表位分析
程小娜,张 志,樊雅婷,刘自立,吴发兴,刘 爽,董雅琴,邵卫星,杨雨辉,王树双,李晓成*
(1.海南大学,海南海口 570228;2.中国动物卫生与流行病学中心,山东青岛 266032;3.云南农业大学,云南昆明 650201)
猪 流 行 性 腹 泻 (Porcine epidemic diarrhea,PED)是以腹泻、呕吐、脱水和对哺乳仔猪高致死率为主要特征的一种高度接触性肠道传染病,在我国猪场大规模暴发和流行,给养猪业带来极大的损失,其病原主要是猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)[1-3]。PEDV 属于冠状病毒科冠状病毒属,病毒粒子呈多形性,其基因组为单股正链RNA,大小约28ku[4]。病毒基因组主要编码多聚酶蛋白(rab)、纤突蛋白(S)、ORF3蛋白、膜蛋白(M)、包膜蛋白(E)和核蛋白(N)等,其中,S蛋白由1 383个氨基酸组成[5],是病毒的囊膜结构蛋白,在病毒与受体细胞结合吸附、膜融合等方面发挥重要作用,也是诱导机体产生保护性中和抗体的主要免疫蛋白。尽管PEDV的S基因没有酶裂解位点,但根据其他冠状病毒S蛋白序列可以将PEDV S蛋白人为地划分为S1区(1-789位氨基酸)和S2区(790-1 383位氨基酸);S1可识别受体,S2负责病毒囊膜与宿主细胞膜融合[6]。由于受到宿主免疫选择的压力和病毒自身进化的需要,S蛋白易发生变异,因此S基因常被用来研究PEDV不同毒株的遗传演化规律[7-9]。2014年,本课题组对山东、河北等地发生流行性腹泻的猪场开展了流行病调查和监测,从中分离和鉴定了数株PEDV流行毒株,为进一步研究这些毒株流行特点,对这些毒株的S基因进行了克隆测序和分析,并对其抗原性和B细胞线性表位进行了深入分析,为更深入了解PEDV流行毒株的分子流行病学积累了资料。
1 材料与方法
1.1 材料
1.1.1 病毒 4份PEDV 流行毒株SDZB01、SDZB02、SDZY03和HB04,采集和分离自山东和河北3个发病猪场的小肠及粪便样品,这3个猪场的仔猪均发生严重腹泻、呕吐、脱水和死亡等症状,经中国动物卫生与流行病学中心畜病检测室鉴定和分离后制备和保存。
1.1.2 材料 Trizol为Invitrogen公司产品;RTPCR一步法扩增试剂盒、胶回收试剂盒、克隆载体PMD18-T easy Vector、DH5α感受态细胞等为大连Takara公司产品。
1.2 方法
1.2.1 病毒RNA的提取 取发病仔猪的粪便样品或细胞培养物,按照Trizol试剂盒说明书提取病毒的RNA,纯化后的RNA用20μL DEPC处理水溶解,置-80℃冻存备用。
1.2.2 PEDV的S基因扩增和测序 以GenBank中登录的PEDV毒株CH/GDGZ/2012(KF384500)的S基因序列作为参考序列,将整个S基因分为S1、S2、S3三段进行扩增,利用 DNA Star中的Primer Select软件,分别设计3对引物S-F1/S-R1、S-F2/S-R2和S-F3/S-F3。引物序列和位置见表1,由宝生物工程(大连)有限公司合成。

表1 PEDV S基因的扩增引物序列Table 1 Primer sequences for amplification on S gene of PEDV
1.2.3 S1、S2、S3片段的PCR扩增与克隆 以提取的样品 RNA 为模板,以S-F1/S-R1、S-F2/S-R2、S-F3/S-F3为引物进行PCR,反应条件为:S-F1/SR1:42℃1h;94℃5min;94℃40s,50.5℃40s,72℃2min 30s,35个循环;72℃10min。S-F2/SR2:42℃1h;94℃5min;94℃40s,60.5℃40s,72℃1min 50s,35个循环;72℃10min;扩增 F3片段的退火温度为57℃,其他扩增条件均与F2片段相同。PCR产物经纯化回收与PMD18-T Vector载体连接,转化到E.coliDH5α感受态细胞中,培养后挑取单个菌落进行PCR鉴定,重组质粒由宝生物工程(大连)有限公司进行测序。
1.2.4 序列分析 采用 DNA Star软件对4株PEDV野毒株的S基因进行拼接接和同源性分析,用CLUSTAL1.83软件和 MEGA6构建基因系统发生树,用DNA Star中Jameson-Wolf法分析野毒株和疫苗株CV777的抗原性,用BepiPred 1.0Server(http://www.cbs.dtu.dk/services/BepiPred/)分析B细胞线性抗原表位,PEDV参考序列为Gen-Bank中所有已发表S全基因的序列(截止2014年11月20日),分别来自我国、韩国、美国、日本、加拿大等国2004年-2014年度毒株,共178株,以及CV777、DR13和KPEDV-9等3株疫苗参考序列。
2 结果
2.1 PEDV流行毒株S基因的扩增和测序
以病料样品制备的总RNA为模板用一步法扩增S1、S2、S3三段S基因,PCR产物经琼脂糖凝胶电泳分析。可以看见到各3条分别为1.8、1.6、1.4kb的条带(图1),其大小与预期相符。将4个PEDV流行毒株分别扩增出PEDV S1、S2、S3三段基因的12份阳性克隆菌液送样进行测序,用Seqman拼接后分别命名这4个PEDV流行毒株为SDZB01/2014、SDZB02/20l4、SDZY03/2014、HB04/2014。4株PEDV S基因全长分别为4 158、4 158、4 161和4 161个核苷酸,分别编码1 386、1 385、1 387和1 387个氨基酸。
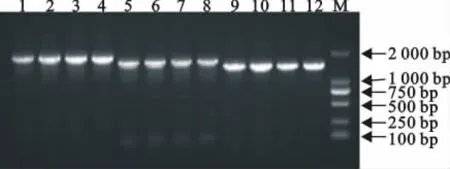
图1 连续RT-PCR法扩增全长S基因的PCR扩增结果Fig.1 Continuous amplification of spike gene from PEDV field strains by RT-PCR
2.2 S基因进化树分析
MEGA分析显示,PEDV毒株可以分为G1和G2两个大的进化分支,在分析的185株PEDV中,G1分支包括32株PEDV,占总毒株的17.3%,G2分支含153株PEDV,占总毒株数的82.7%,也是近年PEDV主要的流行优势分支。G1群可以分为G1.1和 G1.2等2个次分支,其中,G1.1 含有CV777、DR13、KPEDV等疫苗株、我国部分毒株及日本分离株(MK),G1.2分支含有8株我国2011年流行毒株、1株2012年流行毒株、1株2004年毒株(JS-2004)2013年-2014年美国和加拿大流行毒株。G2群可分为G2.1、G2.2和G2.3等次分支,G2.1为韩国和日本2011年-2012年流行毒株,G2.1中的G2.1a分支中的毒株为韩国和日本2011年-2012年流行毒株,而且韩国和日本流行的毒株均各自成簇,G2.1b中的毒株全部为韩国2011年流行毒株;G2.2分支由我国部分2011年-2013年分离毒株组成,分别来自我国的河北、广东、广西、河南等省份,我们此次鉴定的4株毒株中的2株(SDZB01和SDZB02)也位于此进化分支内;另一个流行分支是G2.3分支,它包含大多数PEDV流行毒株,包括中国2011年-2014年不同省份的毒株,本次的2个流行毒株(SDZY03和HB04),以及美国和韩国近2年的毒株,而且美国和韩国毒株的流行毒株均属于同一个小分支(图2)。

图2 PEDV的同源进化树Fig.2 Phylogenetic trees constructed by spike protein of PEDV field strains
2.3 S基因同源性分析
Megalign软件分析可知,SDZB01、SDZB02与SDZY03和HB04的同源性为97.5%~97.6%,相互之间的同源性为99.9%。SDZB01、SDZB02与G1群的同源性为92.4%~94.9%,参考病毒株CV777、DR13、KPEDV-9、83P-5(100th)等的同源性为92.4%~93.1%,SDZY03和HB04与与G1群的同源性为92.5%~95.6%,与参考病毒株CV777、DR13、KPEDV-9、83P-5(100th)等的同源性为92.5%~93.3%。SDZB01、SDZB02与 G2分支内其他他毒株的同源性分别为96.1%~99.9%,与近两年出现的美国毒株Iowa103-2013、Ohio120-2014的同源性分别为97.8%~97.9%。SDZY03和HB04与与G2分支内其他他毒株的同源性分别为96.5%~99.9%,与近两年出现的美国毒株Iowa103-2013、Ohio120-2014的同源性分别为99.1%~99.2%。
与参考病毒株CV777相比,流行毒株存在2个插入突变和1个缺失突变,插入的部位在流行毒株的59-62(GENQ)、140(N),缺失突变位于163-164(NI),除此之外,野毒株的多个氨基酸位点还存在碱基替换,如27-29位(QST→SAN)、64(S→T)、68-72(GTGIE→AGQHP)、84(Y→H)、86~87(DS→RG)、89(Q→H)、120(I→T)、130-131(DN→SI)、159-164(QDGKNI→SEHS)、178(A→S)、186(I→F)、196(R→K)、200-202(SGG→KRS)、209(E→T)、227-229(SYQ→YYE)、246(EP→DS)、270(V→L)等。
2.4 抗原性分析
用DNA Star中的Protean软件分析PEDV流行毒株SDZB01和疫苗株CV777,SDZB01等野毒株的抗原区域明显增多的区域为:25-95、250-275、370-380、990-1 030、1 180-1 260等,其他区域的抗原性与疫苗株类似,详见图3。
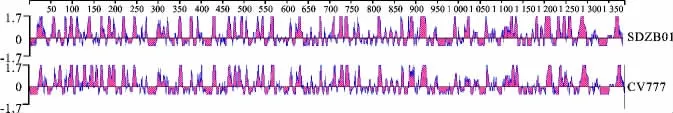
图3 CV777和SDZB01毒株S基因的抗原性分析Fig.3 Antigenicity of spike genes of CV777and SDZB01strains
2.5 S基因的B细胞线性表位分析
使用 BepiPred 1.0Server(http://www.cbs.dtu.dk/services/BepiPred/)软件对 PEDV 流行毒株SDZB01和疫苗毒株CV777等毒株进行分析,软件的Threshold取值为0.35,其敏感性为0.49,特异性为0.75。结果发现,该毒株SDZB01的线性B细胞抗原表位有34个(threshod值>0.35),分布区段分别 为 22-27、53-62、66-76、96-104、113-120、133-144、168-171、190-200、219-230、242-253、304-317、350-357、428-436、483-500、521-537、561-572、608-612、627-638、676-680、700-710、724-730、738-745、761-785、866-873、883-891、910-925、1 019-1 028、1 041-1 047、1 123-1 138、1 208-1 217、1 235-1 246、1 259-1 266、1 283-1 298、1 370-1 374位氨基酸,其中S1片段有23个,S2片段有11个,这个结果与S的功能相一致,也进一步证实了S1片段是S基因的主要抗原区域,35个线性表位中,Threshold最大值超过1.0的线性表位有15个。与参考毒株CV777相比,4个野毒株有6个区域的Threshold值有明显差异,其中148-156和346-353两个区域的Threshold值比CV777毒株小,而其余区域的Threshold值都大于CV777毒株,详见表2和表3。
3 讨论
S基因是PEDV主要的抗原决定基因,其基因结构和功能与病毒的感染性、致病性、抗体的产生和细胞结合能力密切相关。本文研究发现,PEDV流行毒株的S基因在进化树上与CV777、DR13等疫苗株存在明显区别,二者之间的同源性也只有92.4%~93.3%,从进化树上可以看出疫苗株与流行毒株分别位于不同的进化分支,表明PEDV流行毒株已经与疫苗株存在较大的变异。
Li Z L等[10]分析了我国南部部分 PEDV 流行株S基因的同源进化树,他将PEDV分为3个进化分支,G1-G3型,其中G1和G2型实际上与本文的G1群一致,G3型与本文的G2群一致,其研究结果显示PEDV的流行毒株均属于G3群,与本文PEDV流行毒株主要属于G2型的研究结果一致。这说明G2群是全球目前PEDV主要的优势流行毒株,该分支既有美国、加拿大、墨西哥等美洲毒株,也有中国、韩国和日本等国的毒株。
从地域上看,PEDV流行毒株具有一定的地区分布性特点:①除了中国以外的其他国家的流行毒株分布相对集中。不同国家的分离株基本属于同一个分支,如G1.2、G2.1a、G2.1b和G2.3各分支中韩国和日本等国家的流行毒株都形成一个单独的进化分支;②中国PEDV流行毒株缺乏地区性。很多进化分支中既有河北省,也有广东省,甚至一个省内部的分离株也难以形成单独的进化分支,如本文山东省的3株毒株分布于2个不同的进化分支,其中1株与河北省的1株高度同源。这一结果提示我国猪群PEDV的发病和流行可能与我国生猪无序调运密切相关,生猪的频繁调运增加了生猪之间相互流通的可能性,导致不同的PEDV流行毒株之间相互交叉感染。从时间上看,PEDV毒株没有见到明显的时空聚集性,同一个进化分支内可以含有不同年代的流行毒株。
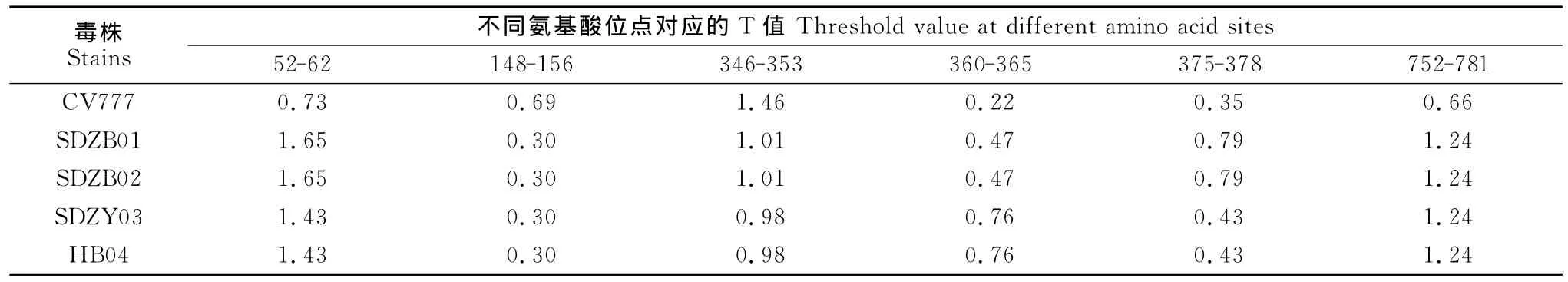
表2 CV777的S基因氨基酸位置及相应位置的SDZB01毒株的Threshold值Table 2 Different threshold values of S genes from CV777strain and corresponding SDZB01strain at some certain regions
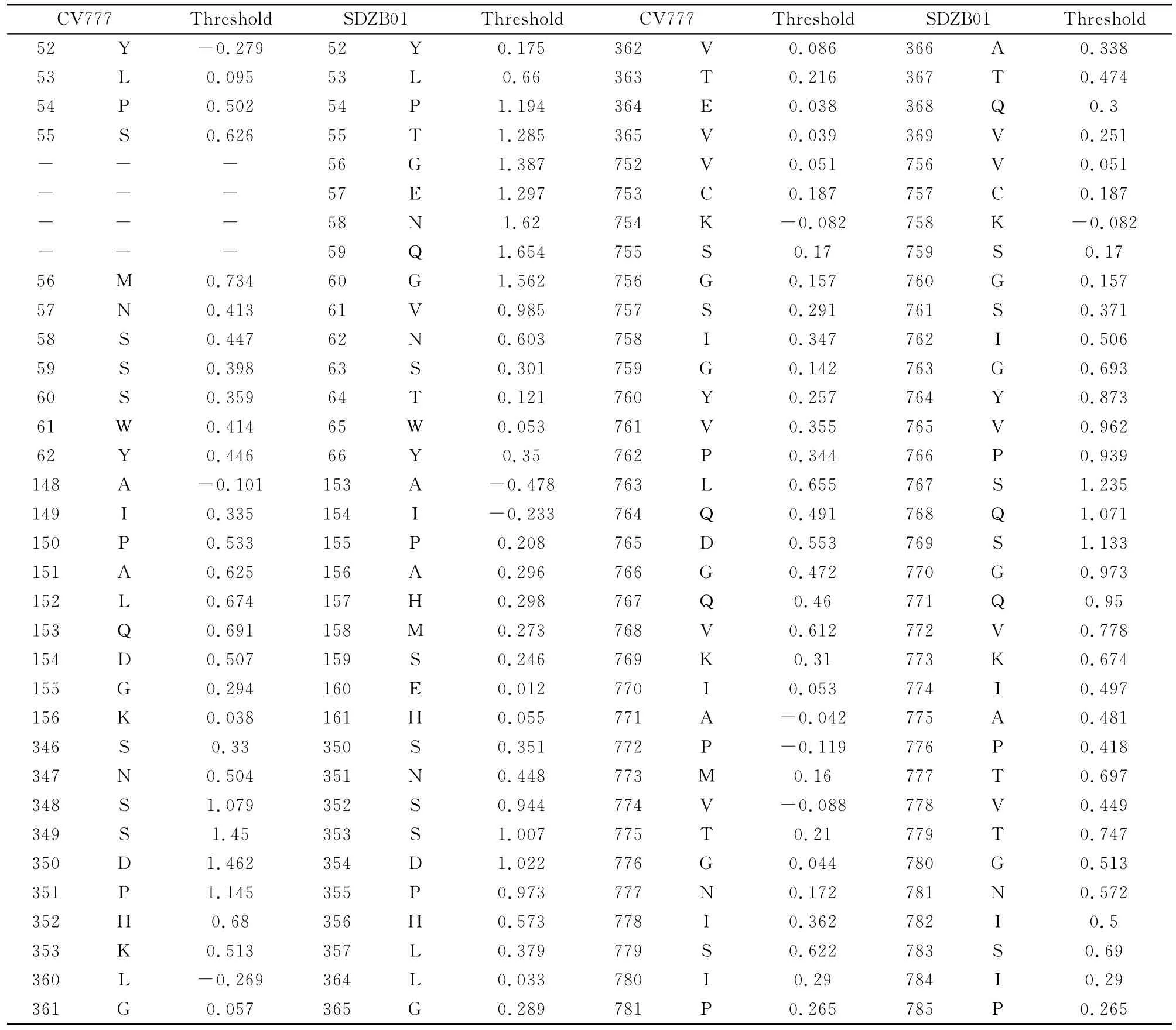
表3 SDZB01与CV777毒株Threshold明显差异的氨基酸位点及对应值Table 3 Significant difference of Threshold values and amino acid sites for S gene from SDZB01and CV777strain
从同源性上看,近年来PEDV的流行毒株与疫苗株的同源性不断加大,2012年,GDGZ/12毒株与CV777、DR13的氨基酸同源性分别为97.7%和98.0%[11],而本文的同源性只有92.3%和92.4%,这说明流行毒株不断和持续受到疫苗的免疫压的影响。
从B细胞线性表位上看,与CV777毒株比较,发现SDZB01有4段B细胞线性表位的Threshold值大于CV777毒株,分别位于52-62、360-365、375-378和752-781等处。特别是52-62位,流行毒株相比CV777插入了4个额外的氨基酸(GENQ),从而增加了一个超强的抗原表位(出现一个7个连续的Threshold值超过1的氨基酸PTGENQG),这样一个超强抗原表位的出现必然影响PEDV毒株的许多生物学特性。长期以来,人们一直想弄清楚PEDV野毒难以培养的机制,现在普遍认为,PEDV受体结合域是PEDV与感染细胞结合的部位,其结构的特点决定了病毒的侵染性高低,孙东波等[12]研究认为PEDV毒株CV777的S基因的249-529位氨基酸区域是PEDV的受体结合域,本文发现的另外2个存在差异的抗原表位,即346-353aa和360-365aa,也恰好位于此区间。对于表位346-365aa来说,SDZB01和SDZB02流行毒株的Threshold值约是疫苗株的2倍,SDZY03和HB04流行毒株甚至是疫苗株的3.5倍;对于表位375-378aa,尽管SDZY03和HB04流行毒株的Threshold值略高于疫苗株,但SDZB01和SDZB02流行毒株的Threshold值仍是疫苗株的2.5倍。这种抗原表位的差异也可能影响PEDV流行毒株与细胞受体的结合,从而影响其感染性。另外,在对S基因抗原表位的研究中,Sun D B等认为[13-14],S基因636-789位氨基酸特别是其中的748-755aa和764-771aa还是S基因的2个引起PEDV中和抗体的线性表位,这一结果与752-781段抗原表位基本一致,在此区域,尽管野毒株和疫苗株之间只有3个碱基发生了变异(S→L、S→D、T→M),但其 Threshold值却由0.655迅速上升到1.235。这种变异是否影响了野毒株的抗原性还有待进一步研究。
[1]孙振钊,赵伟男,王靖飞.猪腹泻病例中PEDV、TGEV及PRV的感染调查[J].动物医学进展,2014,35(5):132-135.
[2]秦谷雨,杨 勇,李 郁,等.安徽省仔猪腹泻5种病毒感染情况的调查研究[J].动物医学进展,2014,35(12):59-63.
[3]Pan Y,Tian X,Li W,et al.Isolation and characterization of a variant porcine epidemic diarrhea virus in China[J].Virol J,2012(9):195.
[4]Song D,Park B.Porcine epidemic diarrhoea virus:a comprehensive review of molecular epidemiology,diagnosis,and vaccines[J].Virus Genes,2012,44:167-175.
[5]Chen J,Wang C,Shi H,et al.Molecular epidemiology of porcine epidemic diarrhea virus in China[J].Arch Virol,2010,155:1471-1476.
[6]Park J E,Cruz D J,Shin H J.Receptor-bound porcine epidemic diarrhea virus spike protein cleaved by trypsin induces membrane fusion[J].Arch Virol,2011,156:1749-1756.
[7]Chen J,Liu X,Shi D,et al.Detection and molecular diversity of spike gene of porcine epidemic diarrhea virus in China[J].Viruses,2013(5):2601-2613.
[8]Hao J,Xue C,He L,et al.Bioinformatics insight into the spike glycoprotein gene of field porcine epidemic diarrhea strains during 2011-2013in Guangdong,China[J].Virus Genes,2014,49:58-67.
[9]Tian P F,Jin Y L,Xing G,et al.Evidence of recombinant strains of porcine epidemic diarrhea virus,United States,2013[J].Emerg Infect Dis,2014,20:1735-1738.
[10]Li Z L,Zhu L,Ma J Y,et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus(PEDV)field strains in south China[J].Virus Genes,2012,45:181-185.
[11]田 野,苏丹萍,蒋 伟,等.华南地区猪流行性腹泻病毒的分离鉴定及其S基因抗原表位片段的遗传变异分析[J].中国兽医杂志,2013,49(5):3-8.
[12]孙东波 ,陈建飞,时洪艳,等.猪流行性腹泻病毒S蛋白受体结合域的分析[J].畜牧兽医学报,2009,40(4):528-553.
[13]Sun D B,Feng L,Shi H Y,et al.Spike protein region (aa 636789)of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies[J].Acta Virologica,2007,51:149-156.
[14]Sun D,Feng L,Shi H,et al.Identification of two novel B cell epitopes on porcine epidemic diarrhea virus spike protein[J].Vet Microbiol,2008,131:73-81.

