mTOR启动子区基因多态性与肾癌发病风险的关系
张 井,张 磊,李 双,柳金良,曹 强,秦 超,殷长军
(南京医科大学第一附属医院泌尿外科,江苏南京 210000)
·基础研究·
mTOR启动子区基因多态性与肾癌发病风险的关系
张 井,张 磊,李 双,柳金良,曹 强,秦 超,殷长军
(南京医科大学第一附属医院泌尿外科,江苏南京 210000)
目的 mTOR 信号通路在肾癌的形成过程中起着重要作用。本研究旨在探索mTOR信号通路相关基因多态性与肾癌易感性的关系。方法 采用病例-对照研究,对710例肾癌患者和760例健康人群,应用TaqMan探针分型法对AKT1、AKT2、PTEN和mTOR基因功能区8个基因多态性进行分型。控制混杂因素,应用非条件逻辑回归,评价基因多态性与肾癌的关系。结果 在8个基因多态性位点中,我们通过校正后的多因素分析发现位于mTOR启动子区的(rs2295080)与肾癌的风险成负相关(P=0.005,OR=0.74, 95%CI=0.59~0.91, TG/GGvs. TT)。另一位于PTEN基因3’端非翻译区的位点,其多态性与肾癌的风险成正相关(P=0.014,OR=1.45,95%CI=1.08~1.96, CCvs. TT),然而通过校正后的多因素分析,我们发现上述关系在统计学上并无明显统计学意义。此外,rs2295080 G等位基因肾脏组织中,mTOR表达水平明显降低。没有发现其他几个多态性位点与肾癌风险存在明显的相关性。结论 位于mTOR启动子区的rs2295080多态性与肾癌的易感性有关。
单核苷酸多态性;肾细胞癌;rs2295080; 风险
肾癌是最常见的肾脏肿瘤,占所有肾脏恶性肿瘤的80%以上[1-2]。尽管肾癌的确切病因仍然未知,异常的血管形成被认为是一个重要因素[3-4]。mTOR信号通路在细胞的生长、生存、增殖和血管生成过程起着重要的作用[5]。mTOR信号通路相关基因改变,如PI3K、 AKT、PTEN的突变,促进了肿瘤的形成,这在人类肿瘤中相当常见[6-8]。
目前,已有研究报道本研究所涉及的单核苷酸多态性可以影响个体肾癌的易感性[9]。基于mTOR信号通路在肾癌中的重要作用,本实验研究了此信号通路中5个核心基因(PI3KCA、AKT1、AKT2、 PTEN、MTOR),分析所选的8个位点的单核苷酸多态性,以及它们在中国人群肾癌形成过程中的作用。
1 对象与方法
1.1 研究对象 本研究总共招募了从2004年5月至2011年9月期间在南京医科大学第一附属医院就诊或体检的710例肾癌病例与760名健康个体。病例和对照的入组条件参照先前的研究[10]。所有新诊断为肾癌的病例均得到了组织病理学的确认。两组排除标准:既往患肿瘤病史、放化疗病史。无年龄与性别限制,符合条件者即招募入组。依据WHO标准分类,并参照2002年美国联合委员会制定的癌症TNM标准对肾癌分期。对照组主要来自至我院门诊健康体检的人群,并依据同性别年龄±5岁与病例组匹配。对照人群来自我院门诊体检正常人群,与病例组人群之间无血缘关系,并且没有癌症病史。在招募入组前,由经过专业培训的调查人员进行面对面的标准问卷调查来收集人口特征和相关因素资料。征得书面知情同意后,抽取每位研究对象5 mL外周血。病例和对照组的响应率>85%。
1.2 单核苷酸多态性 mTOR信号通路的5关键基因:PI3KCA、AKT1、AKT2、PTEN和mTOR。通过检索HapMap(http://hapmap.ncbi.nlm.nih.gov)和dbSNP(http://www.ncbi.nlm.nih.gov/projects/SNP)数据库的数据,筛选出这些基因的单核苷酸多态性位点(表1)。多态性位点的选取标准:①定位于5′末端序列,5′非翻译区,3′非翻译区,或者有氨基酸变化的编码区;②中国人群中最小等位基因频率>5%;③有研究表明与癌症相关。根据该标准,我们筛选出8个单核苷酸多态性位点:包括AKT1的rs2494750和rs2498786,AKT2的rs33933140和rs7254617,PTEN的rs11202607和rs701848,以及mTOR的rs2295080和rs2536。
表1 单核苷酸多态性分析的引物与探针序列

单核苷酸多态性引物与探针序列(5′~3′)rs2494750FCGGAGGAACTTCTGGCTAGGARTGGGACACAGACCCCTTTCTCGFAM⁃CCTGCACTCTCCTGT⁃MGBCHEX⁃CCTGCACTGTCCTGT⁃MGBrs2498786FGGATTCGTCCCTGACCTGTCTRTCAGTTTCCCCGTCTGTAAAGTGGFAM⁃CTCGCTCTGCCGTGACCCTAGC⁃MGBCHEX⁃CTCGCTCTGCGGTGACCCTAGC⁃MGBrs7254617FGCAGACGTCGGAGTCCTAGTGRTGCGCACATTAGACAACTTTGGGFAM⁃TGCGTAGCCCCATC⁃MGBAHEX⁃TGCGTAGCTCCATC⁃MGBrs33933140FCAGGCGCCATGCTTCACRCCAGACTCGCATTTGGAAGACGHEX⁃ATTAAAACCTGAGTCTCCAA⁃MGBAFAM⁃ATTAAAACCTGAATCTCCAA⁃MGBrs701848FCATAGTGCTCCCCCGAGTTGRCCGCTTAAAATCGTATGCAGTCTTFAM⁃ACTAGGGCTTCAATTT⁃MGBCHEX⁃ACTAGGGCCTCAATT⁃MGBrs11202607FTCTTTGTTACAATTTCGGGCACRAATAATAACAGTGCAAAAGCCCATTHEX⁃CGCATATTAAAATGTAACTT⁃MGBCFAM⁃CGCATATTAAAACGTAACT⁃MGBrs2295080FCTTCCCCGCTGTCCTCTAAGRCCATCTTCTCCCTATACCTGTCGGHEX⁃CTCAGGGCTGGGAA⁃MGBTFAM⁃TCAGGGATGGGAAC⁃MGBrs2536FCATGGTGTCTAGACATGGCTACACTRGAGGTGCTGAACACAGGGAAGTFAM⁃CTCATAATTTCCAATATGT⁃MGBCHEX⁃CTCATAATTCCCAATATG⁃MGB
1.3 DNA提取与基因型分型 通过蛋白酶K消化和氯仿萃取,从外周血中提取基因组DNA。在南京医科大学的分子与毒理学实验室,用预先设计的探针单核苷酸基因分型试剂(Applied Biosystems, Foster City, CA, USA)对8个单核苷酸多态性位点进行分析。引物和探针的序列见表1,采取10 μL的反应体系,包括20 ng基因组DNA,3.5 μL 2×TaqMan Genotyping Master Mix,0.25 μL引物和探针混合物,以及6.25 μL的去离子水。扩增过程及条件如下:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,45个循环。依据说明书,扩增与分析过程在384孔板ABI7900HT 实时PCR系统(Applied Biosystems)上进行。使用SDS2.4(Applied Biosystems)分析样本的等位基因型。这些单核苷酸的基因分型率均在98%以上。为了使实验更加精确,每块板包含了4个阴性对照,随机选取5%的样本进行重复基因分型,并且每次结果都是一致的。
1.4 mTOR mRNA的表达分析 选取18对手术切除的肾癌组织及相应的癌旁组织,另加24个癌旁正常肾组织,分析体内mTOR mRNA 的表达水平。从手术切除的组织上切取标本,并立即存于液氮。选取100 mg组织,用Trizol(Invitrogen, Carlsbad, CA, USA)试剂提取总RNA,然后应用oligo(dT) 引物和Superscript II(Invitrogen)将其逆转录为单链cDNA。在ABI Prism7900 sequence detection system (Applied Biosystems, Foster City, CA,USA),通过实时定量RT-PCR的方法,以ACTB基因作为内参,检测mTOR mRNA的表达水平。mTOR:前引物:5′-TTGCTTGAGGTGCTACTG-3′;后引物:5′-CTGACTTGACTTGGATTCTG-3′。ACTB:前引物5′-TGGCACCCAGCACAATGAA-3′;后引物:5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。反应混合物包含各种引物0.1 M,26 μL SYBR Green PCR Master Mix (TaKaRa, Berkeley, CA, USA)以及1 μLcDNA(1∶10稀释)。反应条件如下:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s,40个循环。每个反应重复3次。
1.5 统计学分析 运用t检验(连续变量)或者χ2检验(分类变量)统计病例组与对照组之间的人口分布特征及基因型频率的差异。在进行Hardy-Weinberg平衡定律分析之前,我们运用拟合优度卡方检验,检测研究对象的单核苷酸多态性等位基因的频率。校正可能的混杂因素后,我们运用非条件逻辑回归分析,计算比值比(OR)和95%可信区间(CI),评估多态性与肾癌风险性之间的关系。基于Benjamini-Hochberg方法,我们应用假阳性率校正P值,进行多重比较。当基于假阳性率校正后的P值<0.05为两者之间的关系在统计学上是有意义的。所有的分析均使用SAS 9.1.3软件,所有的统计均为双侧检验。
2 结 果
2.1 研究人群的变量分布 710例病例与760例健康对照的人口学指标及吸烟、饮酒等危险因素的差异见表2。两组之间的年龄、性别、BMI和饮酒之间差异无统计学意义(均P>0.05)。但病例组中吸烟、高血压和糖尿病患者所占比例显著高于对照组(P值分别为0.035,<0.01和<0.01)。在710例患者中,肾癌分期为Ⅰ、Ⅱ、Ⅲ、Ⅳ期的患者分别占62.8%、19.6%、7.3%、10.3%;肿瘤Ⅰ、Ⅱ、Ⅲ、Ⅳ分级的比例分别是19.2%、48.0%、24.5%和8.3%。
2.2 肾癌中mTOR的表达、mTOR rs2295080 和mTOR表达的相互联系 采用实时定量PCR,我们检测肾癌及癌旁组织中mTOR表达水平,并探索癌旁肾组织中rs2295080多态性与mTOR表达水平之间的关系。如图1A所示:与邻近的正常肾组织相比,肾癌组织中mTOR的表达水平显著升高。
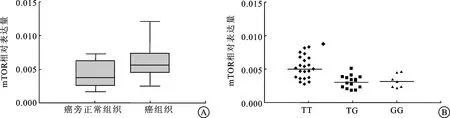
图1 肾透明细胞癌组织及邻近癌旁正常组织中mTOR的表达情况
A:与癌组织相比,邻近癌旁组织中mTOR表达量升高(P=0.018);B:与mTOR rs2295080 TG和GG基因型相比,mTOR rs 2295080 TT基因型中mTOR 表达量更高,P值分别为0.003和0.011。
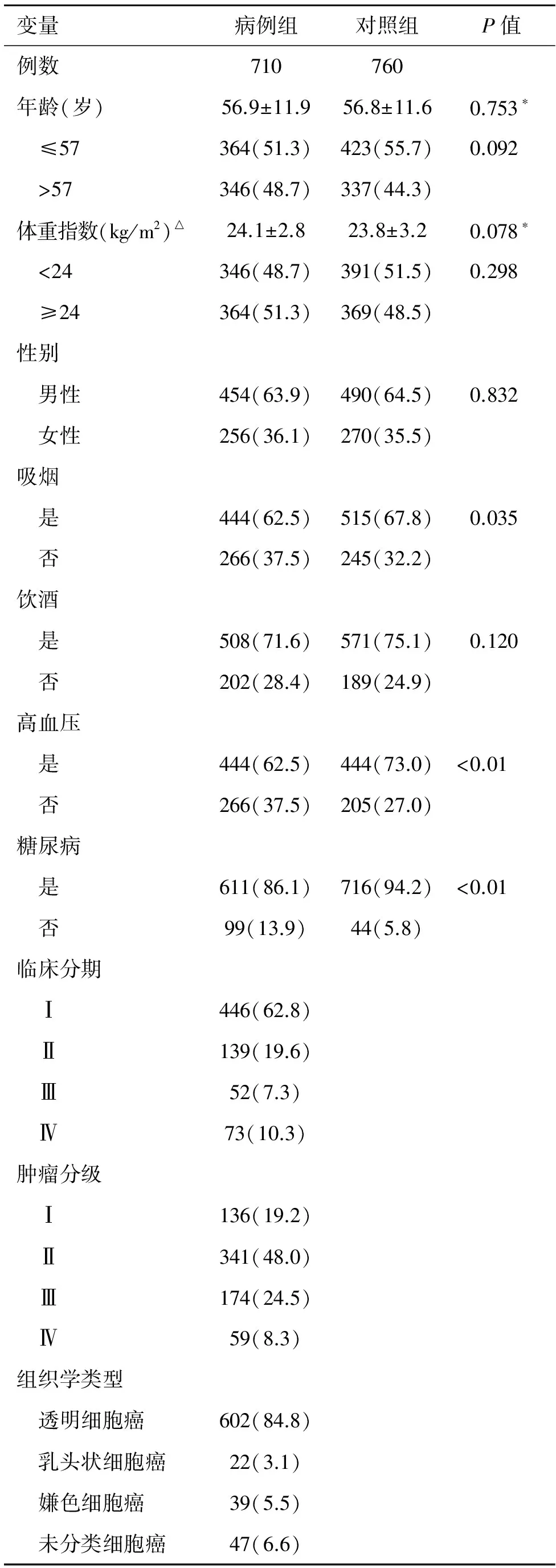
表2 病例组与对照组的各项人口学特征分布情况 [例(%)]
此外,在癌旁组织中,与携带G等位基因(TG和GG基因型)的个体相比携带TT基因型的个体组织中mTOR的表达水平显著升高(TGvs.TT and GGvs. TT,各自的P值分别为0.003和0.011)(图1B)。这些结果表明:mTOR表达水平的升高有可能参与了肾癌的发生,其原因可能与mTOR启动子区rs2295080位点的多态性通过调节mTOR的转录,参与了肾癌的形成。
2.3 AKT1/AKT2/PTEN/MTOR多态性和等位基因频率以及与肾细胞癌风险性之间的关系 遗传模型显示了这些多态性与肾细胞癌风险性之间的相互关系(表3)和多态性的基因型的详细分布信息(表4)。八个多态性位点均符合Hardy-Weinberg平衡。与肾细胞癌的风险相关性最显著的多态性位点为rs2295080,它位于mTOR的启动子区域。与携带rs2295080 TT的基因型的个体相比,携带TG基因型或TG/GG基因型的个体肾癌发病风险明显降低(TG:P=0.021,OR=0.81, 95%CI=0.68~0.97;TG/GG:P=0.005,OR=0.74,95%CI=0.59~0.91)。经过多重检验校正后,rs2295080和肾癌风险之间的相关性仍然有显著统计学意义[假阳性率(false discovery rate,FDR)=0.040]。除了这个位点外,位于PTEN基因 3′非翻译区的rs701848位点的纯合子(CC)与肾癌发病显著相关(P=0.014,OR=1.45, 95%CI=1.08~1.96)。在多重比较后,这种相关性仍然具有显著统计学意义(FDR=0.056)。基于PTEN的负性调节作用,我们研究了mTOR rs2295080和 PTEN rs701848两者的相互作用及其对肾癌风险的影响。结果显示,尽管同时携带两个危险基因型(rs2295080 TT and rs701848 CC)的个体肾癌的风险性增加了1.72倍(表5),两者之间并无明显的相互作用(P相互=0.118)。在筛选出的几个位点中,由于mTOR rs2295080位点显现出最佳的相互关系,因此我们将它作为主要研究对象。
4 讨 论
我们研究了中国人群中mTOR信号通路相关基因的8个多态性位点与肾癌易感性之间的关系。位于mTOR启动子区的rs2295080的多态性降低了肾癌的易感性。我们发现携带rs2295080 G等位基因的个体mTOR mRNA水平呈低表达。此外,这些实验证实rs2295080 G 等位基因显著减低了mTOR的转录水平。因此,mTOR rs2295080位点多态性是功能性的单核苷酸多态性。
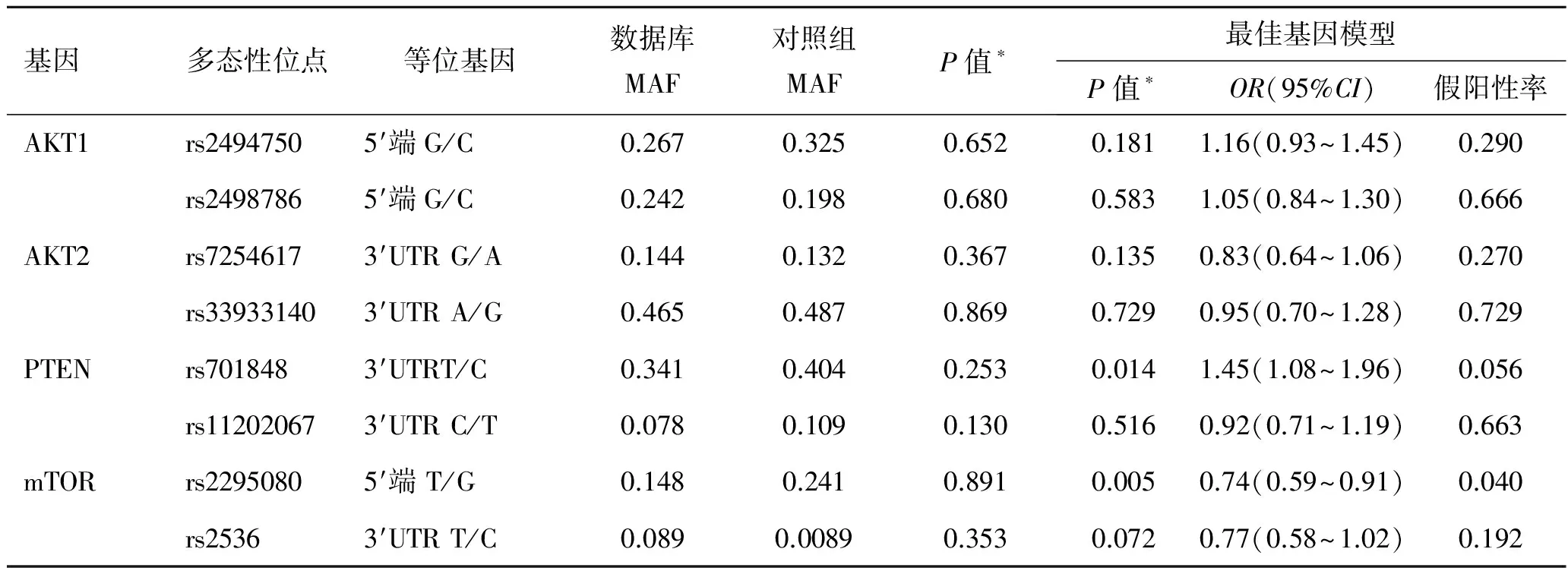
表3 AKT1、AKT2、PTEN和MTOR基因型单核苷酸多态性的信息及肾癌风险性的关系 [例(%)]
*调整年龄、性别、吸烟、饮酒、糖尿病、高血压后的回归模型;SNP:单核苷酸多态性;MAF:最小等位基因频率;3′UTR:3′非翻译区。
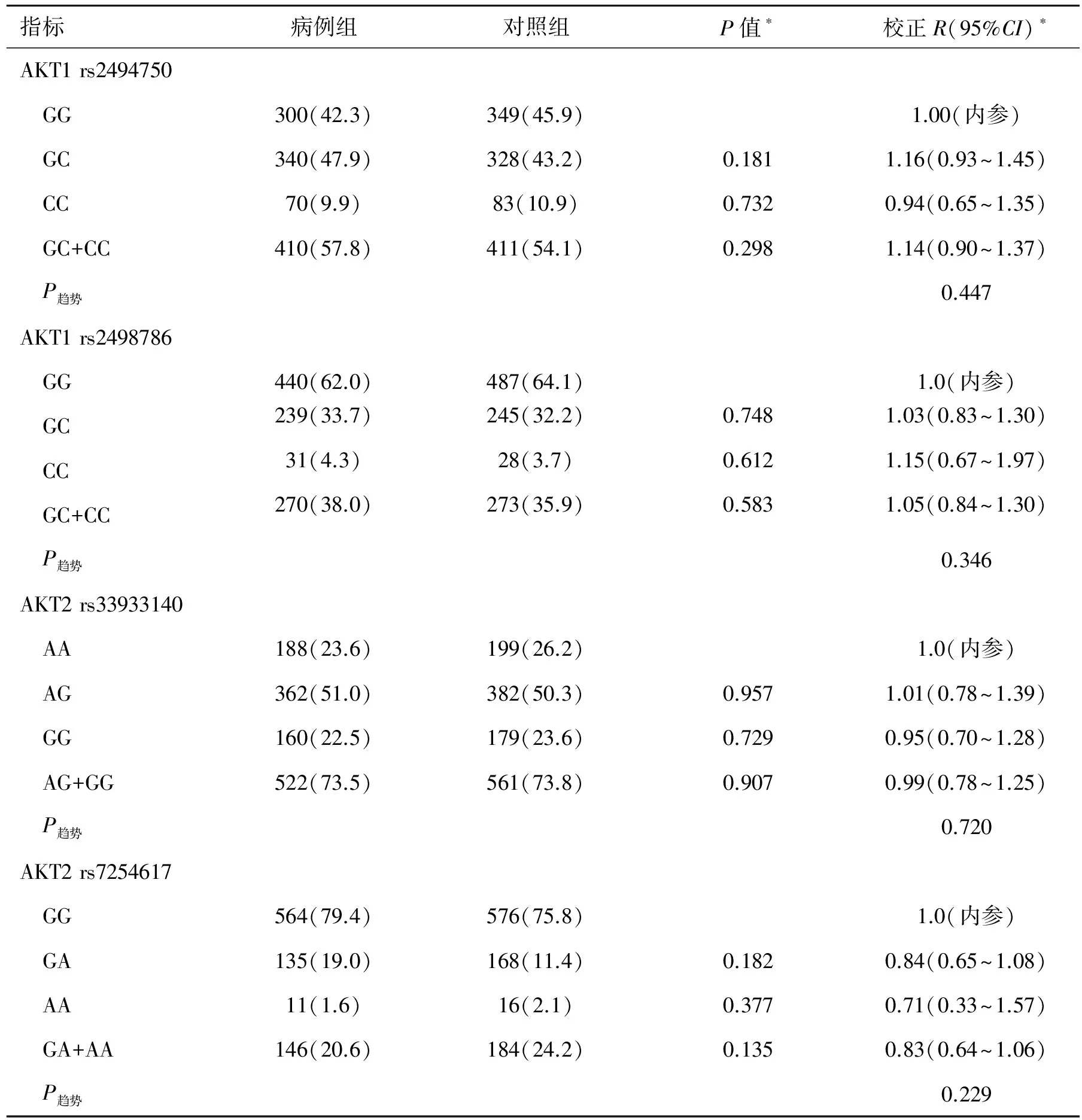
表4 病例组与对照组中各基因型和等位基因的分布差异及与肾癌风险性的关系 [例(%)]
续表4
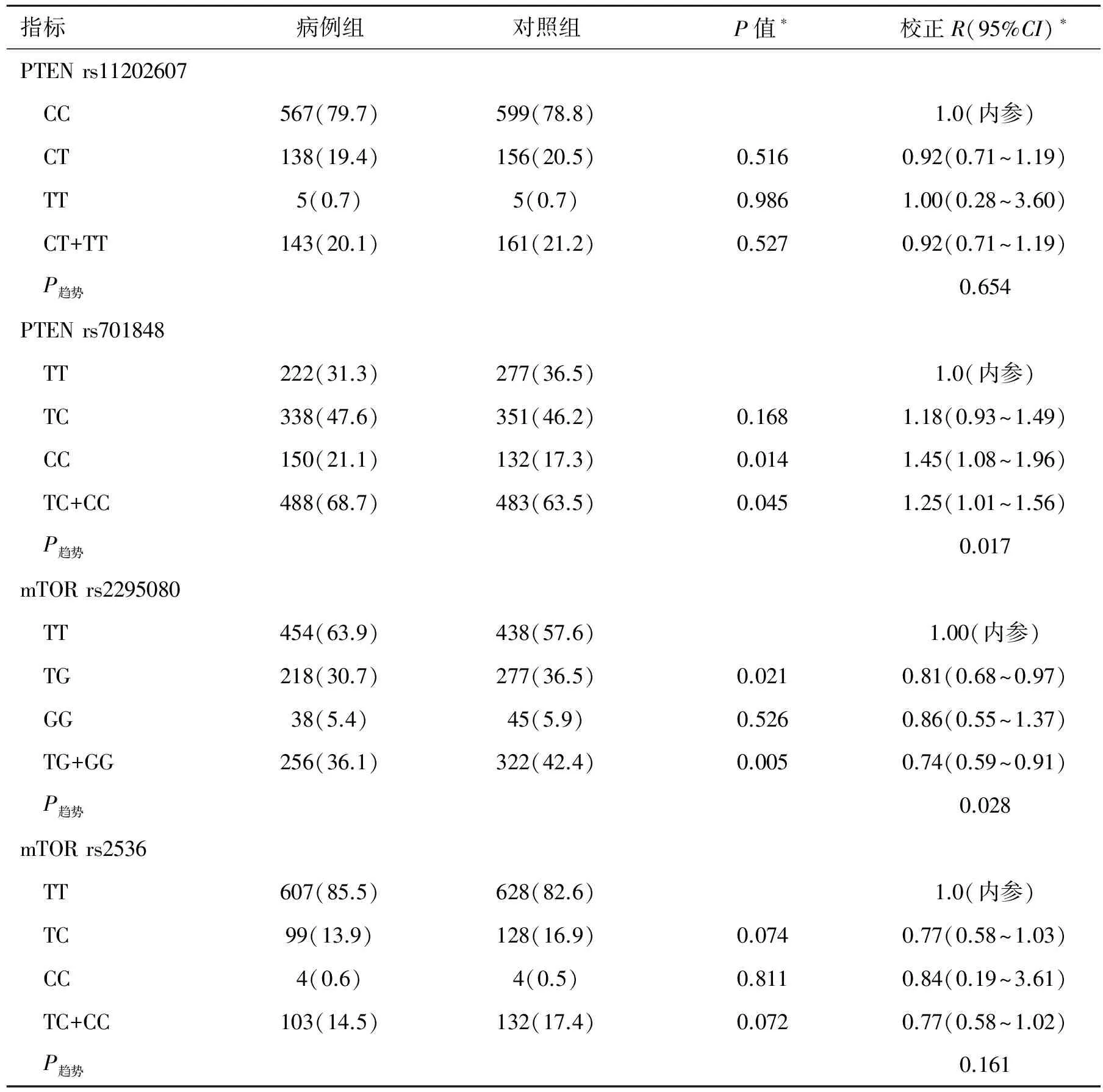
指标病例组对照组P值∗校正R(95%CI)∗PTENrs11202607 CC567(79.7)599(78.8) 1.0(内参) CT138(19.4)156(20.5)0.5160.92(0.71~1.19) TT5(0.7)5(0.7)0.9861.00(0.28~3.60) CT+TT143(20.1)161(21.2)0.5270.92(0.71~1.19) P趋势0.654PTENrs701848 TT222(31.3)277(36.5)1.0(内参) TC338(47.6)351(46.2)0.1681.18(0.93~1.49) CC150(21.1)132(17.3)0.0141.45(1.08~1.96) TC+CC488(68.7)483(63.5)0.0451.25(1.01~1.56) P趋势0.017mTORrs2295080 TT454(63.9)438(57.6)1.00(内参) TG218(30.7)277(36.5)0.0210.81(0.68~0.97) GG38(5.4)45(5.9)0.5260.86(0.55~1.37) TG+GG256(36.1)322(42.4)0.0050.74(0.59~0.91) P趋势0.028mTORrs2536 TT607(85.5)628(82.6)1.0(内参) TC99(13.9)128(16.9)0.0740.77(0.58~1.03) CC4(0.6)4(0.5)0.8110.84(0.19~3.61) TC+CC103(14.5)132(17.4)0.0720.77(0.58~1.02) P趋势0.161
*调整年龄、性别、吸烟、饮酒、糖尿病、高血压后的回归模型。
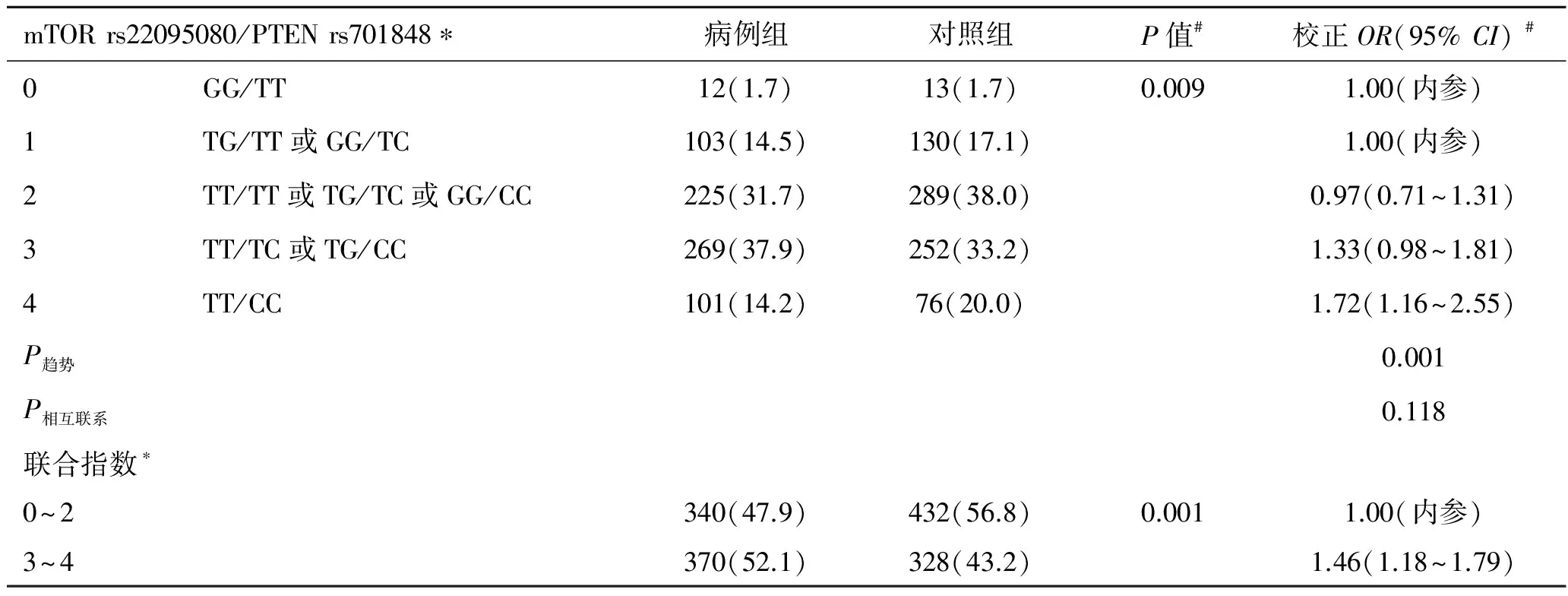
表5 mTOR rs22095080与PTEN rs701848及肾癌发病风险性的关系 [例(%)]
*代表等位基因的频率;#调整年龄、性别、体重指数、饮酒、糖尿病、和高血压后的逻辑回归模型。
本研究验证了mTOR通路与肾癌的关系,尽管mTOR的过度活化是源于蛋白表达的增加还是源于mTOR蛋白的过度磷酸化仍然未知[11-12],但是过度活化的mTOR一直被认为是肾癌的标志。结合一些与肾癌细胞株[11]和肾癌切除标本[13]有关的研究,我们推测mTOR的高表达可促进肾癌的形成。在本研究中,我们也观察到肾癌组织与癌旁组织相比,mTOR mRNA表达水平显著增高,这进一步表明mTOR的过度表达促进了肾癌的形成。在一些肿瘤中,mTOR高表达被认为与不良的预后相关,如肺癌[14]、乳腺癌[15]、喉鳞癌[16]以及胆道腺癌[17]。mTOR启动子区rs2295080 G等位基因多态性引起mTOR的表达减少,可能降低了肾癌的易感性。
此外,经多重比较校正后,我们发现PTEN基因rs701848多态性一定程度上增加了肾癌的风险性。这一多态性位于PTEN基因的3′非翻译区,它可以通过影响mRNA的稳定性,进而改变PTEN的表达水平。然而,这一推测有待进一步证实。由于PTEN负性调控mTOR信号通路,mTOR rs2295080和PTEN rs701848多态性也可能存在相互关系。尽管同时携带两个单核苷酸多态性风险基因型(rs2295080 TT和rs701848 CC的个体罹患肾癌的风险性增加了1.57倍,我们并未发现这两个单核苷酸多态性之间存在显著的相关性。
目前,分子靶向药物,如酪氨酸激酶抑制剂舒尼替尼、血管内皮生长因子受体抑制剂帕唑帕尼以及mTOR抑制剂西罗莫司和依维莫司,已被批准用于治疗晚期肾癌。最近有研究证实血管生成相关基因的多态性可以预测肾癌患者对帕唑帕尼单药治疗的疗效[18]。此外,也有文章报道,参与影响舒尼替尼药代动力学的基因多态性与使用舒尼替尼治疗转移性肾癌患者的无进展生存期相关[19]。此外,mTOR rs2295080多态性与接受放化疗治疗的食管癌患者的临床预后有关[20]。基于rs2295080在调节mTOR表达方面的作用,这一多态性可能作为遗传标志,用于预测患者对西罗莫司或依维莫司的治疗反应性。
本研究结果表明,mTOR rs2295080多态性影响中国人群肾癌易感性。mTOR rs2295080变异可能通过调节内源性mTOR表达水平,进而影响肾细胞癌的易感性。但是rs2295080多态性改变mTOR表达水平,是否能影响mTOR的磷酸化,从而影响下游信号通路和这种多态性是否影响肾癌患者的预后,以及肾癌患者对西罗莫司和依维莫司治疗的反应,有待进一步研究。
[1] COHEN HT, MCGOVERN FJ.Renal-cell carcinoma[J]. N Engl J Med, 2005, 353(23): 2477-2490.
[2] LJUNGBERG B, ET AL, The epidemiology of renal cell carcinoma[J]. Eur Urol, 2011, 60(4): 615-621.
[3] CHOW WH,DONG LM,DEVESA SS, Epidemiology and risk factors for kidney cancer[J]. Nat Rev Urol, 2010, 7(5): 245-257.
[4] BALDEWIJNS MM, ET AL, VHL and HIF signalling in renal cell carcinogenesis[J]. J Pathol, 2010, 221(2): 125-138.
[5] JIANG BH, LIU LZ, PI3K/PTEN signaling in angiogenesis and tumorigenesis[J]. Adv Cancer Res, 2009, 102: 19-65.
[6] STILES B, ET AL, Essential role of AKT-1/protein kinase B alpha in PTEN-controlled tumorigenesis[J]. Mol Cell Biol, 2002, 22(11): 3842-3851.
[7] ALTOMARE DA, TESTA JR, Perturbations of the AKT signaling pathway in human cancer[J]. Oncogene, 2005, 24(50): 7455-7464.
[8] ARCARO A,GUERREIRO AS, The phosphoinositide 3-kinase pathway in human cancer: genetic alterations and therapeutic implications[J]. Curr Genomics, 2007, 8(5): 271-306.
[9] PURDUE MP, ET AL, Genome-wide association study of renal cell carcinoma identifies two susceptibility loci on 2p21 and 11q13.3[J]. Nat Genet, 2011, 43(1): 60-65.
[10] QIN C, ET AL, The polymorphisms in the VHL and HIF1A genes are associated with the prognosis but not the development of renal cell carcinoma[J]. Ann Oncol, 2012, 23(4): 981-989.
[11] SOURBIER C, ET AL, The phosphoinositide 3-kinase/Akt pathway: a new target in human renal cell carcinoma therapy[J]. Cancer Res, 2006, 66(10): 5130-5142.
[12] KRUCK S, ET AL, Activation of mTOR in renal cell carcinoma is due to increased phosphorylation rather than protein overexpression[J]. Oncol Rep, 2010, 23(1): 159-163.
[13] ELFIKY AA, ET AL, Characterization and targeting of phosphatidylinositol-3 kinase (PI3K) and mammalian target of rapamycin (mTOR) in renal cell cancer[J]. J Transl Med, 2011, 9:133.
[14] GATELY K, ET AL, Overexpression of the mammalian target of rapamycin (mTOR) and angioinvasion are poor prognostic factors in early stage NSCLC: a verification study[J]. Lung Cancer, 2012, 75(2): 217-222.
[15] ZHOU X, ET AL, Activation of the Akt/mammalian target of rapamycin/4E-BP1 pathway by ErbB2 overexpression predicts tumor progression in breast cancers[J]. Clin Cancer Res, 2004, 10(20): 6779-6788.
[16] MARIONI G, ET AL, Mammalian target of rapamycin expression and laryngeal squamous cell carcinoma prognosis: novel preliminary evidence[J].Histopathology, 2011, 58(7): 1148-1156.
[17] HERBERGER B, ET AL, Activated mammalian target of rapamycin is an adverse prognostic factor in patients with biliary tract adenocarcinoma[J]. Clin Cancer Res, 2007,13(16):4795-4799.
[18] XU CF,ET AL.Pazopanib efficacy in renal cell carcinoma:evidence for predictive genetic markers in angiogenesis-related and exposure-related genes[J].J Clin Oncol,2011,29(18):2557-2564.
[19] VAN DER VELDT AA, ET AL, Genetic polymorphisms associated with a prolonged progression-free survival in patients with metastatic renal cell cancer treated with sunitinib[J]. Clin Cancer Res, 2011, 17(3): 620-629.
[20] HILDEBRANDT MA, ET AL, Genetic variations in the PI3K/PTEN/AKT/mTOR pathway are associated with clinical outcomes in esophageal cancer patients treated with chemoradiotherapy[J]. J Clin Oncol, 2009, 27(6): 857-871.
(编辑 何宏灵)
Polymorphism in the mTOR promoter is associated with risk of renal cell carcinoma
ZHANG Jing, ZHANG Lei, LI Shuang, LIU Jin-liang,CAO Qiang, QIN Chao, YIN Chang-jun
(Department of Urology, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210000, China)
Objective To explore the association between the polymorphism of mTOR pathway-related genes and risk of renal cell carcinoma (RCC). Methods Eight potentially functional polymorphisms in AKT1, AKT2, PTEN and mTOR genes were genotyped using the TaqMan method in a case-control study of 710 RCC patients and 760 cancer-free subjects. Unconditional logistic regression, adjusted for potential confounding factors, was used to assess the risk associations. Results Of the 8 polymorphisms, after being adjusted for multiple comparisons, a significant association was found between one variant (rs2295080) in the promoter of mTOR and reduced RCC risk (P=0.005,OR=0.74, 95%CI=0.59-0.91, TG/GGvs. TT). Another variant (rs701848) in the 3’UTR region of PTEN was associated with increased RCC risk (P=0.014,OR=1.45, 95%CI=1.08-1.96, CCvs. TT); however, the association was not significant after being adjusted for multiple comparisons. Furthermore, lower mTOR mRNA levels were observed in the presence of the rs2295080G allele in normal renal tissues. No other significant association between the selected polymorphisms and RCC risk was observed. Conclusion Our results suggest that the mTOR promoter rs2295080 variant affects RCC susceptibility, which needs further validation.
single nucleotide polymorphisms; renal cell carcinoma; rs2295080; risk
2014-10-08
2015-01-25
国家自然科学基金(81201571)
殷长军,教授.E-mail:drcjyin@163.com
张井(1989-),男(汉族),硕士研究生.研究方向:泌尿系肿瘤.E-mail:zhangjing2711@126.com
R699
A
10.3969/j.issn.1009-8291.2015.05.014

