柔嫩艾美耳球虫SAG2基因的克隆及其在卡介苗中表达
曹利利,姚新华,郭衍冰,王英贺,,任科研,3,魏 峰,苑淑贤*
(1.吉林省畜牧兽医科学研究院,吉林长春130062;2.吉林农业大学生命科学学院,吉林长春130118;3.吉林省畜牧兽医总站,吉林长春130062)
鸡球虫病是一种危害极其严重的寄生虫病,它是由艾美耳球虫属寄生于肠道所引起的,其中以柔嫩艾美耳球虫危害最为严重,该病严重影响家禽的生长发育,给养禽业造成巨大的经济损失[1]。目前,鸡球虫病主要以药物防治为主,但存在耐药性和药物残留等问题[2]。因此,疫苗免疫已成为预防鸡球虫病的主要措施[3]。目前,鸡球虫疫苗主要以强毒活疫苗和致弱苗为主,虽然显示出良好的免疫效果[4-5],但是由于活疫苗存在潜在的致病力、生产成本高、运输保存困难等缺点[6],使得基因工程疫苗的研制成为鸡球虫疫苗发展的必然趋势[7]。
近年来,鸡球虫的重组疫苗得到广泛的研究,利用细菌、真菌、蓝藻、植物等表达系统可以源源不断地制备出球虫的保护性抗原[8-10]。卡介苗(Bacillus Calmette-Guerin,BCG)是一种减毒的牛分支杆菌,其毒性较弱,而且本身作为一种免疫佐剂具有很强的生物免疫调节功能,是被人们认可的活菌苗[11]。目前,已利用卡介苗表达了多种疾病抗原,为抗细菌、病毒和寄生虫病疫苗的研制提供确实的材料。
表面抗原蛋白是一种入侵相关蛋白,在宿主细胞免疫应答过程中起重要作用。由于鸡球虫是一种寄生于肠内的原虫,因此在球虫感染的入侵阶段,虫体的表面抗原能够刺激宿主的先天性保护性免疫应答,从而避免健康鸡的肠上皮细胞受到虫体的入侵。研究表明子孢子和裂殖子生殖阶段是球虫入侵最危险的阶段[12]。柔嫩艾美耳球虫SAG2抗原是柔嫩艾美耳球虫在第二裂殖子阶段进行表达的表面抗原,是球虫入侵相关蛋白之一,具有良好的抗原性[13]。
本研究将柔嫩艾美耳球虫SAG2基因克隆到大肠埃希菌-分支杆菌整合表达载体pMV361中,获得重组表达质粒pMV361-SAG2,电穿孔转染到卡介苗中高效表达,为重组卡介苗作为球虫病疫苗的应用研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 卡介苗,购自长春生物制品所;整合表达载体pMV361和大肠埃希菌DH5α,本实验室保存。
1.1.2 主要试剂TaqDNA聚合酶、T4连接酶、限制性内切酶HindⅢ和EcoRⅠ和DNA片段纯化回收试剂盒等,购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 引物合成及RT-PCR扩增 根据GenBank中SAG2基因序列及pMV361载体物理图谱设计两对引物并引入酶切位点:上游引物5'-CAAGCTTATGTCTCGCCTGGCCTCTG-3',5'端含有HindⅢ位点,下游引物5'-GGAATTCTTAAAAAAGCCCGTAAGCAAAAA GC-3',5'端含有EcoRⅠ位点,引物由上海生工生物工程技术服务有限公司合成。用RT-PCR扩增得到SAG2基因的开放阅读框序列。反应程序:①RT:30℃5min;42℃30 min;5℃ 5min。②PCR:95℃ 5min;94℃30s,58℃1min,72℃ 1min,30个循环;72℃延伸10 min;4℃保存。PCR结束后,10g/L琼脂糖凝胶电泳观察SAG2扩增结果,产物用DNA片段纯化回收试剂盒回收,置-20℃保存备用。
1.2.2 pMD18-T-SAG2载体的构建 将上述PCR纯化产物与pMD18-T载体连接,16℃连接过夜,构建pMD18-T-SAG2,转化入E.coli(DH5α)感受态细胞,通过PCR鉴定筛选阳性克隆菌株,并送上海生工生物工程技术服务有限公司进行序列测定。
1.2.3 重组整合载体pMV361-SAG2的构建 用HindⅢ和EcoRⅠ双酶切重组质粒pMD18-T-SAG2和pMV361,分别回收SAG2目的片段和pMV361载体大片段,将目的片段和载体大片段进行连接,16℃连接过夜,转化入DH5α感受态细胞,挑取阳性克隆,提取质粒。分别用PCR和双酶切的方法进行鉴定,构建整合表达载体pMV361-SAG2。
1.2.4 电穿孔转染BCG 将BCG接种于MB7H9液体培养基中,37℃培养至对数生长期(3周~4周),OD 600nm≈0.5,离心收集菌体,沉淀用100 mL/L甘油洗涤,最后重悬于1mL 100mL/L甘油中,置-80℃保存备用。取80μL~100μL菌液加入0.1μg质粒DNA置于电极杯中,按照1.8KV,25μF,100Ω进行电击,转染后立即加入MB7H9液体培养基中,37℃培养2d后涂布于含20μg/mL卡那霉素的MB7H9培养基平板中,用封口膜密封培养皿,21d后选取阳性菌落。
1.2.5 重组质粒pMV361-SAG2在卡介苗中的表达 挑取卡那霉素抗性平板上的菌落接种到MB7H9液体培养基中,加入卡那霉素至终浓度为20μg/mL,于37℃培养。当 OD 600nm 为0.5~0.8时(约20d~25d),将含有外源基因的重组卡介苗置于45℃水浴2h~3h,诱导蛋白表达。
1.2.6 表达产物的SDS-PAGE分析 离心收集菌体和上清液,菌体加入分支杆菌裂解缓冲液以重选沉淀,并加入终浓度为10g/L的SDS,终浓度为100 μg/mL的溶菌酶,37℃作用15min,超声裂解溶液至不再黏稠,加等量的2×SDS加样缓冲液,100℃煮沸10min,加入预先灌制的SDS聚丙烯酰胺凝胶中,每孔的上样量为15μL,70V~120V电泳。电泳结束后进行考马斯亮蓝染色并观察结果。
1.2.7 表达产物Western blot分析 按上述方法,将重组卡介苗pMV361-SAG2,进行SDS-PAGE电泳分离。将面积大小与凝胶相同的6张Whatman滤纸和1张硝酸纤维素膜,预先浸泡于转移缓冲液中10min。电泳完后取出凝胶,放入转移缓冲液中平衡,组装转移夹层。从阳极到阴极顺次放置3层滤纸、硝酸纤维素膜、凝胶、3层滤纸,小心排出气泡,对齐并加紧,置于支架内。加转移缓冲液,以250mA电泳1h,取出转移膜,并标记。用2g/L丽春红染色液快速显色,观察转印效果,用封闭液进行封闭,洗涤3次后,用自制柔嫩艾美耳球虫(E.tenella)多克隆抗体对封闭液按1∶500稀释,37℃孵育转印膜2h,洗涤3次,加入1∶1 000稀释的HRP标记的羊抗鼠IgG二抗,孵育1h,洗涤后用DAB显色试剂盒进行避光显色,当出现清晰的目的条带时,立即水洗并照相保存。
2 结果
2.1 SAG2基因的RT-PCR扩增和pMD18-TSAG2克隆质粒的构建
经琼脂糖凝胶电泳分析,柔嫩艾美耳球虫SAG2基因的RT-PCR扩增产物中均出现大小为813bp的条带,与预期大小一致(图1)。将SAG2基因的RT-PCR产物克隆至PMD18-T载体后转化E.coli(DH5α),挑取阳性克隆株提取克隆质粒,出现大小为3 506bp的条带,与预期大小一致(图2)。
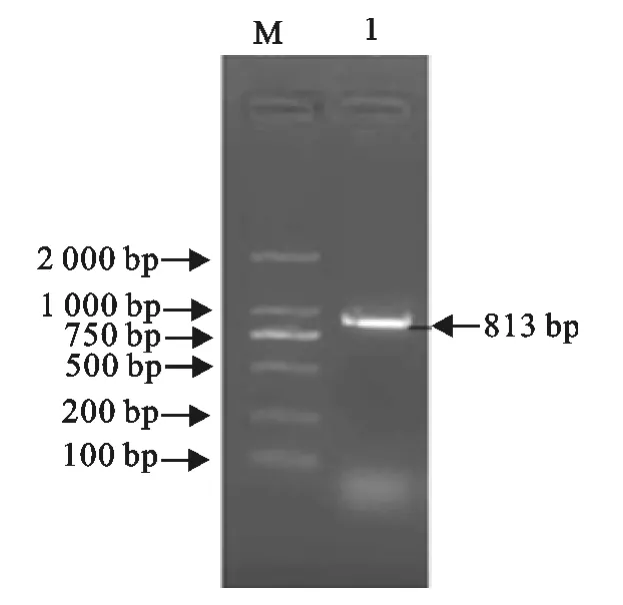
图1 SAG2基因RT-PCR产物电泳Fig.1 Electrophoresis of RT-PCR products of SAG2gene
2.2 重组质粒pMV361-SAG2的鉴定
酶切鉴定:挑选阳性克隆菌落,提取质粒,分别用HindⅢ和EcoRⅠ进行双酶切鉴定,产物经10 g/L琼脂糖凝胶电泳,在813bp处见到明显目的条带(图3)。
PCR鉴定:以筛选的阳性克隆菌落为模板,进行PCR扩增,产物经琼脂糖凝胶电泳在813bp处出现清晰的阳性扩增带(图3)。
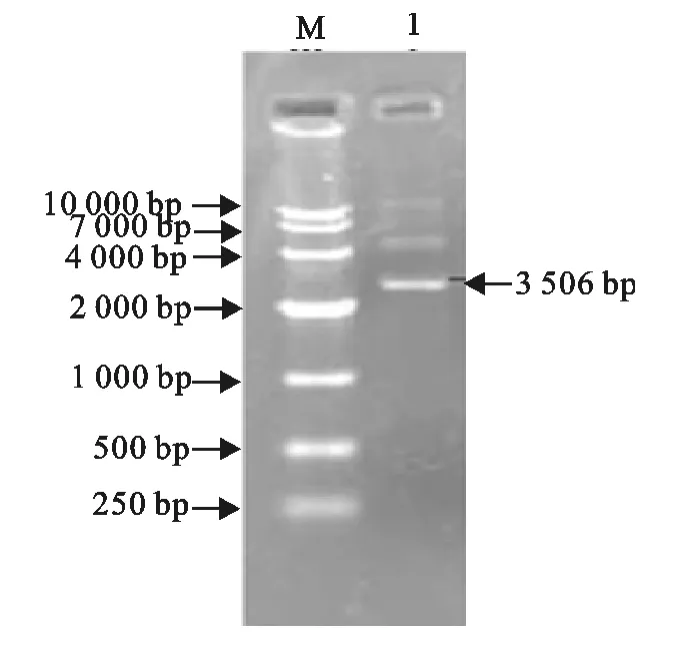
图2 pMD18-T-SAG2质粒电泳Fig.2 Electrophoresis of pMD18-T-SAG2plasmid
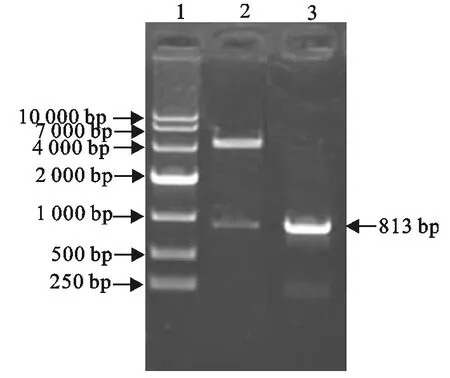
图3 PCR和双酶切鉴定重组质粒pMV361-SAG2Fig.3 Identification of pMV361-SAG2plasmid by PCR and double restriction enzyme digestion
2.3 SAG2基因核苷酸序列测定
经DNA Star软件分析,测序结果与原序列同源性为100%,与本实验室研究人员先前测定的SAG2核苷酸序列完全相同。表明成功获得重组质粒pMV361-SAG2。
2.4 柔嫩艾美耳球虫SAG2基因在卡介苗中表达产物的SDS-PAGE分析
将重组卡介苗菌液45℃诱导2h后,120g/L SDS-PAGE电泳检测,结果显示,在约28ku处出现目的蛋白带,与预期蛋白分子质量相符(图4)。

图4 柔嫩艾美耳球虫SAG2基因在卡介苗中表达产物SDS-PAGE分析Fig.4 Analysis of products of E.tenella SAG2 expressed in BCG by SDS-PAGE
2.5 柔嫩艾美耳球虫SAG2基因在卡介苗中表达产物的Western blot分析
Western blot结果显示,重组卡介苗pMV361-SAG2表达产物可被抗柔嫩艾美耳球虫的多克隆抗体识别,产生特异性条带,而对照组则无此反应(图5)。证实SAG2在卡介苗中的得到了正确的表达。

图5 柔嫩艾美耳球虫SAG2基因在卡介苗中表达产物 Western blot分析Fig.5 Analysis of products of E.tenella SAG2 expressed in BCG by Western bolt
3 讨论
柔嫩艾美耳球虫的子孢子和裂殖子表面抗原在球虫识别、黏附和侵入宿主细胞等的过程中发挥关键作用。已有报道克隆表达了E.tenella表面抗原SAG5、SAG10基因,二者均在子孢子入侵和裂殖子生殖阶段有表达,并证明了重组蛋白均具有一定的抗球虫感染保护力[14]。目前已克隆表达了许多具有免疫原性的球虫表面抗原,例如,鸡柔嫩艾美耳球虫5401基因在大肠埃希菌中成功表达[15],柔嫩艾美耳球虫MZ5-7基因在真核表达载体中表达[16]以及柔嫩艾美耳球虫EtIMP12基因的重组表达等[17],且都表现出一定的免疫效果。然而,柔嫩艾美耳球虫SAG2抗原是柔嫩艾美耳球虫在第二裂殖子阶段进行表达的表面抗原,且具有良好的免疫原性。因此,SAG2抗原也是与虫体对宿主的识别、黏附和侵入相关抗原之一。
卡介苗是由减毒牛分支杆菌悬液制成的活菌苗,能够有效地诱导病毒、细菌、寄生虫等抗原的获得性免疫应答。由卡介苗表达的蛋白不需要纯化,而且其本身作为免疫增强剂,能激活机体免疫细胞,诱导细胞因子产生,从而引起T细胞免疫反应来提高机体的免疫力。卡介苗由于其较好的免疫效果,以及毒副作用小、安全性高、生产成本低廉等特点,已被广泛的应用。在抗寄生虫感染方面,已经构建了血吸虫[18-19]、肝片吸虫[20]、疟原虫[21-22]、利什曼原虫[23]和弓形虫[24-26]等抗原的重组卡介苗,对机体均有不同程度的免疫保护力。利用卡介苗研制抗球虫疫苗,也越来越受到人们的关注,已报道运用卡介苗来表达柔嫩艾美耳球虫Rhomboid基因[27]和巨型艾美耳球虫AMA1抗原[28],均显示出一定的免疫保护效果,但未见有利用卡介苗来表达柔嫩艾美耳球虫主要表面抗原蛋白的报道。由于鸡球虫主要寄生于鸡的盲肠和直肠黏膜内,细胞免疫在机体抗球虫免疫中起主要作用,因此,利用卡介苗来研制抗球虫疫苗具有潜在的研究价值。
本研究利用卡介苗来表达柔嫩艾美耳球虫主要表面抗原蛋白SAG2,构建整合表达载体pMV361-SAG2,并转入卡介苗进行表达,构建的重组卡介苗热稳定性强,易于生产,为下一步研究疫苗的免疫保护性奠定基础。
[1]Williams R B.A compartmentalised model for the estimation of the cost of coccidiosis to the world's chicken production industry[J].Int J Parasitol,1999,29(8):1209-1229.
[2]Sangster N,Batterham P,Chapman H D,et al.Resistance to antiparasitic drugs:the role of molecular diagnosis[J].Int J Parasitol,2002,32(5):637-653.
[3]Allen P C,Fetterer R H.Recent advances in biology and immunobiology ofEimeriaspecies and in diagnosis and control of infection with these coccidian parasites of poultry [J].Clin Microbiol Rev,2002,15(1):58-65.
[4]Bangoura B,Alnassan A A,Lendner M,et al.Efficacy of an anticoccidial live vaccine in prevention of necrotic enteritis in chickens[J].Exp Parasitol,2014,145:125-134.
[5]Fetterer R H,Jenkins M C,Miska K B,et al.Evaluation of an experimental irradiated oocyst vaccine to protect broiler chicks against avian coccidiosis[J].Avian Dis,2014,58(3):391-397.
[6]Chapman H D,Cherry T E,Danforth H D,et al.Sustainable coccidiosis control in poultry production:the role of live vaccines[J].Int J Parasitol,2002,32(5):617-629.
[7]Shirley M W,蔡建平,谢明权.鸡球虫病的免疫控制技术[J].中国家禽,2003,25(7):33-35.
[8]Sathish K,Sriraman R,Subramanian B M,et al.Plant expressed EtMIC2is an effective immunogen in conferring protection against chicken coccidiosis [J].Vaccine,2011,29(49):9201-9208.
[9]楼士林,章 军,吴巧娟,等.蓝藻基因表达载体系统的构建和应用[J].厦门大学学报:自然科学版,2001(2):586-591.
[10]Zhang J,Chen P,Sun H,et al.Pichiapastorisexpressed Et-Mic2protein as a potential vaccine against chicken coccidiosis[J].Vet Parasitol,2014,205(1-2):62-69.
[11]Delogu G,Brennan M J.Comparative antigens ofMycobacteriumtuberculosisimmune response to PE and PE PGRS[J].Infect Immun,2001,69(9):5606-5611.
[12]Lillehoj H S.Role of T lymphocytes and cytokines in coccidiosis[J].Int J Parasitol,1998,28(7):1071-1081.
[13]曹利利,姚新华,侯洪烈,等.柔嫩艾美耳球虫长春株SAG2基因的克隆与序列分析[J].动物医学进展,2013,34(12):1-5.
[14]麦 博.鸡柔嫩艾美耳球虫表面抗原SAG5和SAG10基因的克隆与表达及免疫保护性试验[D].陕西杨凌:西北农林科技大学,2007.
[15]杜爱芳,王素华,索 勋.鸡柔嫩艾美耳球虫ZJ株5401基因在大肠杆菌中的表达 [J].畜牧兽医学报,2005,36(2):187-190.
[16]Geriletu,Xu L,Xu R H,et al.Vaccination of chickens with DNA vaccine expressingEimeriatenellaMZ5-7against coccidiosis[J].Vet Parasitol,2011,177(1-2):6-12.
[17]Yin G,Lin Q,Wei W,et al.Protective immunity againstEimeriatenellainfection in chickens induced by immunization with a recombinant C-terminal derivative of EtIMP1[J].Vet Immunol Immunopathol,2014,162(3-4):117-121.
[18]Varaldo P B,Leite L C,Dias W O,et al.RecombinantMycobacteriumbovisBCG expressing the SmL4antigen ofSchistosomamansoniprotects mice from cercarial challenge [J].Infect Immun,2004,72(6):3336-3343.
[19]李文桂,石佑恩,汪燕鸣,等.血吸虫重组BCG-Sj26GST疫苗接种后保护力的观察[J].同济医科大学学报,1999,24(1):13-16.
[20]周 宇,张文露,黎万奎,等.肝片吸虫保护性抗原基因在卡介苗中的表达[J].四川大学学报 :自然科学版,2003,40(2):356-360.
[21]Zheng C,Xie P,Chen Y.Molecular cloning and sequencing of the circum sporozoite protein gene fromPlasmodiumfalciparumstrain FCC-1/HN and expression of the gene in Mycobacteria[J].J Clin Microbiol,2001,39(8):2911-2915.
[22]Mohamad D,Suppian R,Mohd Nor N.Immunomodulatory effects of recombinant BCG expressing MSP-1CofPlasmodiumfalciparumon LPS-or LPS+IFN-γ-stimulated J774A.1 cells[J].Hum Vac Immunother,2014,10(7):1880-1886.
[23]Nahrevanian H,Jafary S P,Nemati S,et al.Evaluation of antileishmanial effects of killedLeishmaniavaccine with BCG adjuvant in Balb/c mice infected withLeishmaniamajorMRHO/IR/75/ER [J].Folia Parasitol(Praha),2013,60(1):1-6.
[24]Yu Q,Huang X,Gong P,et al.Protective immunity induced by a recombinant BCG vaccine encoding the cyclophilin gene ofToxoplasmagondii[J].Vaccine,2013,31(51):6065-6071.
[25]Wang H,Liu Q,Liu K,et al.Immune response induced by recombinantMycobacteriumbovisBCG expressing ROP2gene ofToxoplasmagondii[J].Parasitol Int,2007,56(4):263-268.
[26]Supply P,Sutton P,Coughlan S N,et al.Immunogenicity of recombinant BCG producing the GRA1antigen fromToxoplasmagondii[J].Vaccine,1999,17(7-8):705-714.
[27]Wang Q,Chen L,Li J,et al.A novel recombinant BCG vaccine encodingEimeriatenellarhomboid and chicken IL-2induces protective immunity against coccidiosis[J].Korean J Parasitol,2014,52(3):251-256.
[28]Li W C,Zhang X K,Du L,et al.Eimeriamaxima:efficacy of recombinantMycobacteriumbovisBCG expressing apical membrane antigen1against homologous infection[J].Parasitol Res,2013,112(11):3825-3833.

