超排兔卵巢卵母细胞直接用于体细胞核移植的研究
尚江华,邹雨汐,秦玲莎,徐如祥*,姜晓丹*
(1.广东省脑功能修复与再生重点实验室,南方医科大学珠江医院神经外科,广东广州510282;2.中国农业科学院水牛研究所,农业部(广西)水牛遗传繁育技术重点实验室,广西南宁530001)
体细胞核移植(somatic cell nuclear transfer,SCNT)技术发展到今天,已经获得了许多物种的后代[1]。而且,随着该项技术与其他生物技术相结合,其研究重点已经由以前的技术体系研究转向生产和应用的研究,如转基因动物用以异种器官移植或乳腺生物反应器大量生产人源性的蛋白等[2-3]。同时,SCNT也成为获得以治疗为目的的克隆源性胚胎干细胞[4-5]以及以保存野生动物为目的的异种克隆的核心技术之一。家兔是一种使用广泛的实验动物,在许多领域都用作动物模型。家兔与小鼠、大鼠等啮齿类小型动物相比,其生殖特性及胚胎发育、着床机理等方面更接近人类,而且卵母细胞的显微操作更容易进行;而与大型动物相比,又具有超排获得的卵母细胞较多、胎儿妊娠期短、实验成本低廉等特点,因此,在发育生物学尤其是胚胎工程方面,常常对家兔进行超排处理以获得更多的卵母细胞用于研究来阐述SCNT的原理与机制。采用兔卵母细胞为受体,已经获得了具有人遗传信息的胚胎干细胞[6],也获得大熊猫-兔、猫-兔、猕猴-兔、野山羊-兔及食蟹猴-兔的异种克隆囊胚,甚至获得早期妊娠胎儿[7]。因此,以较低的实验成本获得更多的兔卵母细胞用于SCNT研究具有实际应用价值。
为了获得尽可能多的卵母细胞,母兔通常采用PMSG或FSH进行超数排卵处理,超排方法的不同,不仅排卵数量上存在差异[8],甚至对卵母细胞或者胚胎的质量也会产生较大影响[9-10]。
家兔的核移植研究起步比较早,而且很早就成功获得胚胎细胞核移植的后代,然而直到2002年才首次成功获得了体细胞克隆兔[11]。当前,用作体细胞核移植的兔卵母细胞大多数来源于体内成熟后排出的卵母细胞,只有很少的研究采用体外成熟的卵母细胞[12]。为了从输卵管内获得体内成熟的卵母细胞,研究者通常麻醉或者杀死兔子后将卵巢和输卵管摘除,再在无菌条件下冲洗输卵管来回收卵母细胞。在这样的情况下,实验动物通常是一次性使用,卵巢上残留卵泡内的卵母细胞没有得到利用。
对许多物种而言,抽吸自卵巢表面卵泡内的卵母细胞通常被认为是未成熟的,必须经体外培养成熟后方可用于受精或核移植研究。然而,家兔是一种诱导排卵的动物,处于适当发情周期的兔卵巢表面通常会有一些成熟待排的卵泡,只有在受到公兔交配或其他刺激(如激素诱导)后卵母细胞才从这些卵泡中排出。
家兔排卵通常发生在hCG注射后的10h~12 h,到14h排卵基本完成,但是在26h~30h,排卵后的卵巢上依旧存在很多未排出的大卵泡(直径≥2mm)[13]。有研究报道注射hCG后10h~12h从家兔卵巢表面的卵泡上收集到成熟的卵母细胞成功体外受精并产下一只幼兔,证实此类卵母细胞的发育能力[14-15],提示在超排结束(注射 hCG 14h)后,抽吸自兔卵巢残留卵泡内的卵母细胞可能用作核移植的胞质受体。因此,本研究主要对抽吸自超排母兔卵巢表面卵泡内的卵母细胞不经体外成熟培养而直接用于体细胞核移植,并通过与冲洗自输卵管内的排出卵母细胞在显微操作效率、体细胞克隆和孤雌生殖胚胎发育能力的比较研究,以检验此类卵母细胞用作SCNT胞质受体的可能性。
1 材料与方法
1.1 材料
TCM-199(含25mmol/L Hepes)和 DMEM,Gibco公司产品;孕马血清促性腺激素(pregnant mare serum gonadotrophin,PMSG)和人绒毛膜促性腺激素(human choionic gonadotophin,hCG),分别购自天津华孚高新生物技术公司和宁波市激素制品有限公司;促卵泡激素(follicle stimulating hormone,FSH),购自中国科学院动物所。其余试剂均为Sigma公司产品。细胞和胚胎培养的塑料器皿,购自美国Corning或丹麦Nunc公司。
实验动物是由广东医学实验动物中心提供的体重2.5kg以上、健康的成年新西兰大白兔雌兔(实验动物合格证号:0008942,0009879)。
1.2 方法
1.2.1 实验动物超数排卵 除特别说明外,实验动物的超数排卵处理参照已经报道的方案进行[16-17]。大白兔雌兔经臀部肌肉注射150IU的PMSG 72h后,耳缘静脉注射150IU的hCG进行超排处理(PMSG+hCG+)。3只兔子注射等体积的生理盐水来代替hCG用以检测hCG注射与否对兔排出到输卵管内和卵巢卵泡内的卵母细胞成熟度是否存在影响(PMSG+hCG-)。另外,10只兔子采用FSH 和hCG联合的方法进行超排。即:大白兔雌兔经臀部肌肉连续3d6次、每次间隔12h注射FSH。注射的剂量递减,即第1、第2次剂量为0.15mg/只;第3、第4次剂量为0.10mg/只;第5、第6次剂量则为0.05mg/只。在最后一次注射FSH 12h后,耳缘静脉注射150IU的hCG处理(FSH+hCG+)。hCG或生理盐水注射后,人工刺激排卵。14h后 ,家兔用100mL/L水合氯醛麻醉后手术摘除卵巢、输卵管和小部分子宫角。
1.2.2 卵母细胞的回收 排出卵母细胞的回收:剥离了多余组织的兔输卵管用mM-199(100mL/L FBS的TCM-199)冲洗,回收卵丘-卵母细胞团。卵巢卵母细胞的抽吸:选取卵巢表面直径≥1mm的可见卵泡用10mL注射器套12号针头抽吸、回收外层卵丘细胞包裹完整、胞质均匀、形态好的卵丘-卵母细胞 复 合 体(cumulus-oocyte complexes,COCs)。冲出的卵丘细胞团(内裹有卵母细胞)或抽吸到的COCs分别在2g/L的透明质酸酶中消化5min~10min,用内径略大于卵母细胞直径的毛细玻璃管轻轻吹打去除外周包裹的卵丘细胞。200mL/L FBS的TCM-199终止透明质酸酶的作用,再用mM-199洗涤2次~3次。选取具有第一极体(PB1)的成熟卵母细胞,依据卵母细胞获取方式分组(抽吸组vs排出组)分别进行SCNT和孤雌生殖的试验比较。
1.2.3 卵母细胞的去核和注核 选取具有第一极体(PB1)的成熟卵母细胞用含7.5μg/mL细胞松弛素B(CB)和mM-199处理10min~15min,再转入添加有10μg/mL Hoechst 33342和7.5μg/mL CB的mM-199中染色处理10min。经以上处理的两组卵母细胞分别转入石蜡油覆盖的50μL 5μg/mLCB的mM-199的显微操作液滴中。去核时,用内径20 μm~22μm的斜口去核针刺破透明带并插入到卵周隙内,将PB1连同其下卵膜包围的部分胞质(含MⅡ期染色体核)吸去,再打开紫外光短暂照射吸出的胞质检查去核效果,同时看到PB1和中期核表明去核成功。去核成功的卵母细胞转入mM-199,在38℃、体积分数为5%的CO2、完全相对湿度的培养箱中静置,等待注核。
1.2.4 供体细胞的准备 COCs裸化过程中消化下来的卵丘细胞经短期培养(6代以内)后用作供体细胞。卵丘细胞用添加100mL/L FBS的DMEM在37℃、体积分数为5%的CO2、完全相对湿度的培养箱中培养。使用前,先用无钙镁的PBS洗涤2次去除漂浮的死细胞,然后经2.5g/L的胰酶消化成单个细胞后离心,再用mM-199重新悬浮并调整细胞浓度至2×105个/mL。放入38℃、体积分数为5%的CO2、完全相对湿度的培养箱中等待备用。
1.2.5 核移植、电融合和重构胚的激活 用斜口注核针选取表面平滑、形态完整的圆形细胞,单个注入卵母细胞的卵周隙内,并使注入的体细胞紧贴卵母细胞的胞膜。体细胞-卵母细胞质复合体采用电融合的方法融合。电融合仪为美国的Cyto-Pulse PA4000/PA-101S,融合槽为该公司的同心圆电极FE-C25/400,融合液采用该融合仪配套的专用融合液(CPS-LCM-C)。体细胞-卵母细胞质复合体在融合液中平衡5min~10min后,移入充满融合液的两电极间,使卵裂球与卵母细胞胞质间的接触面与电场方向垂直,进行融合。电融合参数为:场强为2 000V/cm,脉冲时程20μs,每次给予2个方波脉冲,间隔3s。融合后完整的重构胚在mM-199中洗涤2次~3次后,采用离子霉素和6-二甲氨基嘌呤联合处理的方式激活。先用含5μg/mL离子霉素(ionomycin)的 mM-199避光处理4min,mM-199洗涤3次,每次洗涤2min~3min,再移入含2 mmol/L的 6-二甲氨基嘌呤(6-DMAP)和 7.5 μg/mL CB的 mM-199中培养2.5h~3h。
1.2.6 重构胚的体外培养 激活处理结束后SCNT胚胎先在体视显微镜用微细玻璃针轻轻滚动评估SCNT胚胎的融合情况,只有融合的重构胚才用于体外培养。用于体外培养的SCNT重构胚或孤雌胚用mM-199洗涤3次后移入50μL、上覆石蜡油的相同培养液的液滴中,在38℃、体积分数为5%的CO2、完全相对湿度的培养箱中进行体外培养直至第7天。每隔48h半量换入相同的新鲜培养液。体外培养的重构胚在24h后观察卵裂情况,并观察记录随后胚胎的发育情况。
1.2.7 卵母细胞的孤雌激活 在体细胞-卵母细胞质复合体(重构胚)开始进行电融合处理的同时,用作孤雌激活的卵母细胞也采用相同的参数、按照重构胚激活程序同步进行处理。
1.2.8 统计分析 所有数据均采用SPSS 10.0统计软件的一般线性描述的方差分析(ANOVAPROC-GLM)对数据进行统计分析,以检验各处理间差异的显著(P<0.05时为差异显著,P<0.01时为差异极显著)。
2 结果
2.1 不同超排方法获得的排出或抽吸的兔卵母细胞数及其成熟情况
去除卵丘细胞的卵母细胞以在体视显微镜下见第一极体(PB1)为标准判断为成熟的卵母细胞。卵母细胞回收的结果如图1所示,注射PMSG和生理盐水处理(PMSG+hCG-)的3只供体兔冲洗输卵管没有回收到任何卵母细胞,而抽吸卵巢表面的卵泡虽然获得了62枚COCs(平均20.7±10.0枚),但是却没有成熟的卵母细胞;注射PMSG和hCG处理(PMSG+hCG+)的25只供体兔分别抽吸卵巢卵泡回收到246枚(抽吸组)和从输卵管内冲洗到得了277枚(排出组)卵母细胞,平均分别回收了9.8枚±6.5枚和11.1枚±5.0枚卵母细胞;而注射FSH和hCG处理(FSH+hCG+)的10只供体兔则分别回收了抽吸和排出卵母细胞108枚(平均10.8±3.0枚)和218枚(平均21.8±9.8枚)。FSH+hCG+处理平均回收的排出组卵母细胞显著多于PMSG+hCG+处理(P<0.05),而回收抽吸组卵母细胞平均数方面两组差异不显著(P>0.05)(图1A)。回收卵母细胞的成熟率抽吸组不如排出组,其中PMSG+hCG+处理和FSH+hCG+处理的抽吸组卵母细胞成熟率分别极显著(70.7%vs94.6,P<0.01)和显著(81.5%vs94.6%,P<0.05)低于排出组,而PMSG+hCG+处理的抽吸卵母细胞成熟率也显著低于FSH+hCG+处理(70.7%vs81.5%,P<0.05))(图1B)。
2.2 抽吸或排出的兔成熟卵母细胞作为胞质受体进行SCNT的命运
成熟卵母细胞在去核或注核后存活至显微操作的下一步视为去核或注核成功。由表1可以看出,无论PMSG+hCG+处理还是FSH+hCG+处理,抽吸组卵母细胞的去核成功率都显著低于排出组(分别为:69.2%vs83.6% 和 71.6%vs80.8%,P<0.05),但两种超排处理获得的两类卵母细胞的注核成功率差异均不显著(P>0.05),而且在去核成功后用作SCNT胞质受体注入卵丘细胞,获得的重构胚在融合率、分裂率、分裂胚胎发育至囊胚的比例差异均不显著(P>0.05)。但是,在总体效率方面,PMSG+hCG+处理的抽吸组卵母细胞要显著低于排出组(8.4%vs11.5%,P<0.05),而FSH+hCG+处理的抽吸组卵母细胞与其他组差异不显著(10.2%vs11.6%,P>0.05)。
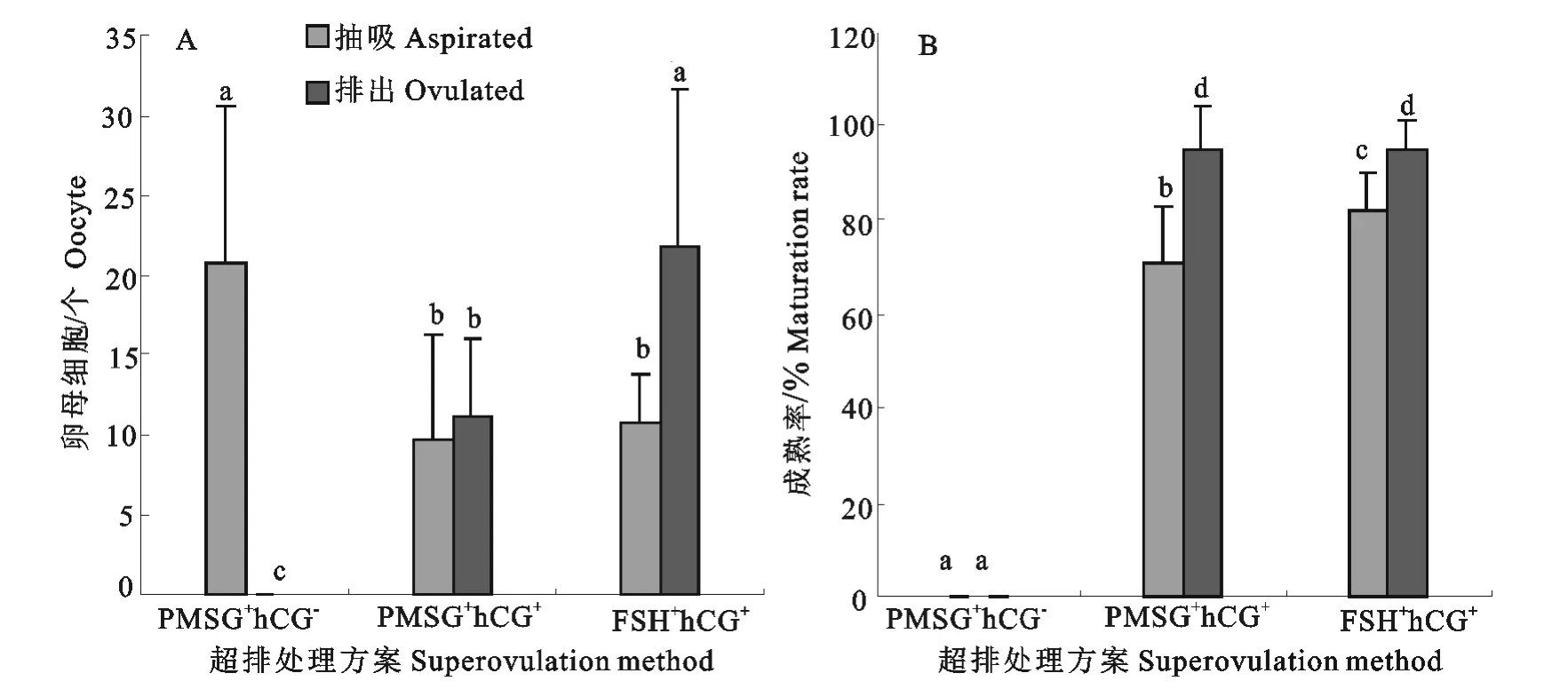
图1 不同激素超排处理回收兔抽吸和排出卵母细胞的平均数及成熟率Fig.1 Average number and maturation rate of oocytes recovered by aspirating ovarian follicles and by flushing oviducts from rabbits treated with different superovulation methods
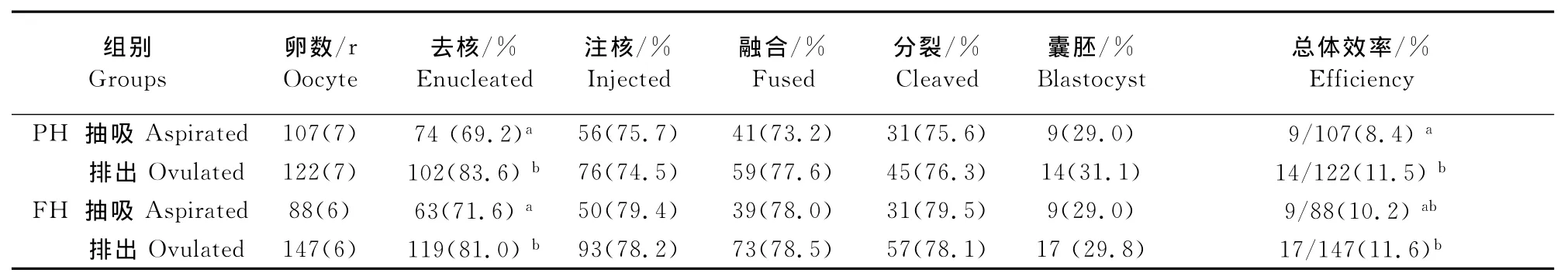
表1 PMSG+hCG+和FSH+hCG+处理的兔排出或抽吸的成熟卵母细胞SCNT的命运Table 1 SCNT fate of mature oocytes recovered by aspiration and ovulation from rabbits treated with PMSG+hCG+ and FSH+hCG+
2.3 抽吸或排出的兔成熟卵母细胞孤雌生殖胚胎的发育
3 讨论
抽吸组和排出组成熟卵母细胞在孤雌激活处理后,卵母细胞的分裂率、胚胎发育至囊胚阶段的比例及总体效率方面差异均不显著(P>0.05,表2)。
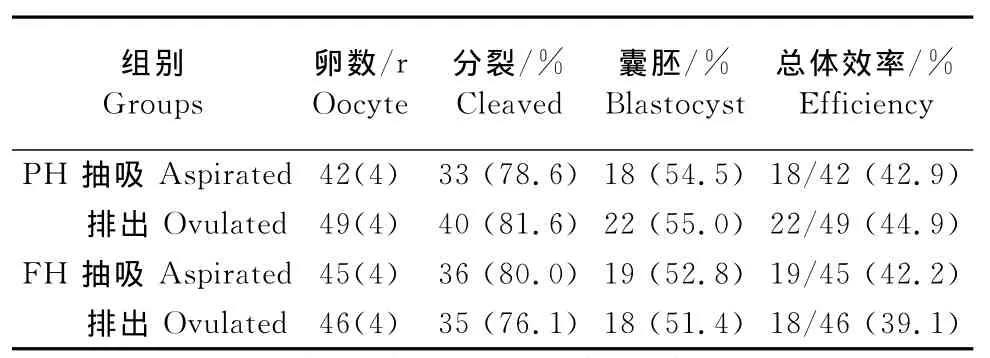
表2 PMSG+hCG+和FSH+hCG+处理的兔抽吸或排出的成熟卵母细胞孤雌生殖胚胎的发育情况Table 2 Developmental ability and total cell numbers of parthenotes derived from mature oocytes recovered by aspiration and ovulation from rabbits treated with PMSG+hCG+
超排兔卵巢卵泡内的卵母细胞不经体外成熟培养而直接用于体细胞核移植的研究,目前国内未见相关报道。试验结果表明:抽吸组获得的卵母细胞成熟率(具PB1卵母细胞的比例)极显著(PMSG+hCG+处理为70.7%,P<0.01)或显著(FSH+hCG+处理为 81.5%,P<0.01)低于排出组(94.6%),这与Brackett B G等[15]报道兔卵巢卵母细胞比排到输卵管内的卵母细胞成熟度差、体外受精效果低的结果相吻合。虽然抽吸组获得的卵母细胞成熟率显著低于排出组,但是与已经报道的兔卵巢卵母细胞经体外成熟培养后用作体外受精或SCNT的成熟率相当[12,18-19]。家兔排卵通常集中在激素处理后的10h~12h[13]并在14h完成[19],但是在26h~30h,排卵后的卵巢上依旧存在很多未排出的大卵泡(直径≥2mm)[13]。我们在hCG注射14h之后抽吸卵巢表面的卵泡依然能够获得较大比例的成熟卵母细胞,表明排卵结束后,依旧有成熟卵泡没有破裂以致成熟的卵母细胞滞留在卵巢上。
在哺乳动物的超数排卵过程中,hCG通过模拟动物自发的LH峰起到诱导卵泡的成熟、破裂和排卵的作用。在家兔上,低剂量的hCG诱导卵母细胞的核成熟,黄体化和卵泡的破裂需要高剂量的hCG[20]。本研究中,3只用生理盐水代替hCG注射的供体兔没有自输卵管中冲洗到卵母细胞,而抽吸卵泡回收到的62枚卵母细胞都没有成熟的结果印证了这一点(图1)。这一结果也与Kobayashi Y等[22]通过用不同剂量的hCG体外灌注兔卵巢诱导卵泡排卵和卵母细胞成熟的结果相吻合。Varian N B等[13]用FSH和LH联合超排母兔也发现低剂量的LH不能引发排卵,同时卵巢上有大量的未排大卵泡。
在显微操作的效率方面,本研究结果显示两种不同超排处理获得的成熟卵母细胞去核效率,抽吸组均比排出组要低(P<0.05),而注核效率差异不显著。目前,造成这种去核效率差异显著的原因尚不清楚。
抽吸组和排出组的成熟卵母细胞去核成功后、用作胞质受体注入卵丘细胞后的重构胚在融合率、分裂率、分裂胚胎发育至囊胚的比例差异均不显著,表明这两类体细胞克隆胚胎具有等同的发育能力。Oh Y K等[23]对来源于超排兔卵巢卵泡和排出的卵母细胞的超微结构以及体外受精胚胎发育的一系列变化进行比较研究发现没有显著差异,Hayashi S等[24]也发现小鼠超排后用吲哚美辛(indomethacin)抑制排卵后卵泡内的卵母细胞具有与排出卵母细胞等同的受精效果。
本研究中采用FSH超排比PMSG获得了更多的兔排出卵母细胞,这结果与一些研究者报道的一致[8-9],虽然,两类抽吸组卵母细胞的数量相当,但是前者抽吸获得的卵母细胞成熟率更高(P<0.05,图1B)。两种超排方法获得的抽吸卵母细胞用作SCNT的总体效率虽然统计学差异不显著,但与排出到输卵管内卵母细胞的SCNT总体效率相比较,PMSG抽吸组却是显著低于排出组(8.4%vs 11.5%,P<0.05),而FSH 抽吸组却差异不显著(10.2vs 11.6%,P>0.05)。
综上所述,抽吸自排卵结束后超排兔卵巢表面卵泡内的卵母细胞大多数都已经成熟,虽然去核效果要差些,但去核成功的卵母细胞用作胞质受体注入卵丘细胞后,获得的重构胚与用排出到的输卵管内的卵母细胞构建的重构胚具有等同的发育能力,而且FSH超排获得的抽吸组卵母细胞体细胞核移植的总体效率与排出到输卵管内的卵母细胞没有显著差别,可以不经体外成熟培养而直接用于体细胞核移植,能够在不增加试验成本的基础上,大幅度提高可用卵母细胞的数量。
[1]Campbell K H S,Alberio R,Choi I,et al.Cloning:eight years after Dolly[J].Reprod Dom Anim,2005,40(4):255-414.
[2]Matsunari H,Nagashima H.Application of genetically modified and cloned pigs in translational research [J].J Reprod Dev,2009,55(3):225-230.
[3]Chung Y G,Eum J H,Lee J E,et al.Human somatic cell nuclear transfer using adult cells[J].Cell Stem Cell,2014,14(6):777-780.
[4]Yamada M,Johannesson B,Sagi I,et al.Human oocytes reprogram adult somatic nuclei of a type 1diabetic to diploid pluripotent stem cells[J].Nature,2014,510(7506):533-536.
[5]Wang Y,Zhao S,Bai L,et al.Expression systems and species used for transgenic animal bioreactors[J].Bio Med Res Inter,2013,2013:580463(doi:10.1155/2013/580463).
[6]Chen T,He Z X,Liu A,et al.Embryonic stem cells generated by nuclear transfer of human somatic nuclei into rabbit oocytes[J].Cell Res,2003,13(4):251-264.
[7]Chen D Y,Wen D C,Zhang Y,et al.Interspecies implantation and mitochondria fate of panda-rabbit cloned embryos[J].Biol Reprod,2002,67(2):637-642.
[8]杨金姬,张 顺,石金月.母兔超数排卵影响因素的研究[J].中国畜牧兽医,2011,38(10):129-131.
[9]林 峰,孙克宁,陈玉霞,等.家兔超数排卵与早期胚胎发育研究[J].家畜生态学报,2011,32(4):68-70.
[10]Mehaisen G M K,Viudes-de-Castro M P,et al.Invitroandin vivoviability of vitrified and non-vitrified embryos derived from eCG and FSH treatment in rabbit does[J].Theriogenology,2006,65(7):1279-1291.
[11]Chesne P,Adenot P G,Viglietta C,et al.Cloned rabbits produced by nuclear transfer from adult somatic cells[J].Nat Biotechnol,2002,20(4):366-269.
[12]Yin X J,Kato Y,Tsunoda Y.Effect of enucleation procedures and maturation conditions on the development of nucleartransferred rabbit oocytes receiving male fibroblast cell[J].Reproduction,2002,124(1):41-47.
[13]Varian N B,Maurer R R,Foote R H.Ovarian response and cleavage rate of ova in control and FSH-primed rabbits receiving varying levels of luteinizing hormone[J].J Repord Fertil,1967,13(1):67-73.
[14]Seitz H M Jr,Brackett B G,Mastroianni L Jr.Invitrofertilization of ovulated rabbit ova recovered from the ovary[J].Biol Reprod,1970,2(2):262-267.
[15]Brackett B G,Mills J A,Jeitles G G Jr.Invitrofertilization of rabbit ova recovered from ovarian follicles[J].Fertil Steril,1972,23(12):898-909.
[16]尚江华,徐如祥,姜晓丹,等.兔骨髓基质细胞核移植的研究初报[J].中华神经医学杂志,2005,4(9):870-873.
[17]邹雨汐,尚江华,秦玲莎,等.兔卵母细胞孤雌激活及不同添加物对激活胚胎发育的影响[J].中华神经医学杂志,2013,12(1):29-33.
[18]郑瑞珍,高晓虹,王育哲,等.兔卵母细胞体外成熟和体外受精的研究[J].动物学报,1992,38(1):64-72.
[19]Lorenzo P L,Rebollar P G,Illera M J.Stimulatory effect of insulin-like growth factor I and epidermal growth factor on the maturation of rabbit oocytesinvitro[J].J Reprod Fertil,1996,107(1):109-117.
[20]Harper M J K.Ovulation in rabbits:the time of follicular rupture and expulsion of the eggs,in relation to injection of luteinizing hormone[J].J Endocrinol,1963,26(3):307-316.
[21]Bomsel-Helmreich O,Huyen L N,Durand-Gasselin I.Effects of varying doses of hCG on the evolution of preovulatory rabbit follicles and oocytes[J].Hum Reprod,1989,4(6):636-642.
[22]Kobayashi Y,Wright K H,Santulli R,et al.Ovulation and ovum maturation in the rabbit ovary perfusedinvitro[J].Biol Reprod,1981,24(3):483-490.
[23]Oh Y K,Brackett B G.Ultrastructure of rabbit ova recovered from ovarian follicles and inseminatedinvitro[J].Fertil Steril,1975,26(7):665-685.
[24]Hayashi S,Noda Y,Matsumoto H,et al.Fertilizability of unovulated mature eggs following indomethacin administration in mice[J].Gamete Res,1987,18(4):291-299.

