4种藤本植物对锰污染土壤的耐受性及其生理响应
汪结明,王良桂,韩改改
(1 南京林业大学 风景园林学院,南京210037;2 湖南科技大学 生命科学学院,湖南湘潭411201)
随着工业化、城市化的日益发展,锰矿作为一种重要的矿产资源被人类以前所未有的速度开采、消耗,而由此带来的锰尾矿重金属环境污染问题也日益严重[1-2]。土壤中过量的锰容易对植物造成伤害、还会通过食物链影响人类身体健康,如锰摄入量过高会影响免疫系统和心血管系统的正常功能,甚至引发类帕金森氏综合症等多种疾病[3-4]。传统的锰尾矿区土壤重金属修复方法如淋洗法、热处理法、客土换土法、动电修复法等,但这些方法成本高、效果差,工程量大,且往往容易破坏土壤结构造成二次污染[5-6]。利用植物进行锰尾矿修复的方法为治理重金属污染提供了新途径,该技术成本低、速度快,成效显著。目前研究较深入的植物主要有商陆(PhytolaccaacinosaRoxb)、 水 蓼(Polygonumhydropiper)、木荷(Schimasuperba)、杠板归(P.perfoliatum)和短毛蓼(P.pubescensBlume),研究发现这些植物对锰表现出极强的耐受性,属于锰超富集植物[7-8]。
近年来,利用园林植物进行锰尾矿山的植物景观化修复是一个新的发展趋势,这些植物既有较高锰富集能力又具有较高的观赏价值,且富集的重金属不会进入食物链。当前的研究主要对象是花卉植物和观赏乔木[9]。藤本植物是园林植物中的一类具有特殊生活型的类群,需匍萄地面或攀缘它物生长,具有较高的观赏价值和生态价值[10]。它们大多数适应能力强,耐瘠薄、耐干旱,是生态恢复的优良植物材料[11]。目前,藤本植物的研究与应用主要在新品种繁育、边坡绿化、防沙治沙、水土保持等方面[12],而利用其进行锰尾矿重金属修复的研究鲜见报道。本研究是在广泛调查湖南省湘潭市锰尾矿区植物生长情况以及大量前期抗锰植物筛选的基础上,以4种湖南本地生态建设中多见的藤本植物薜荔、金银花、五叶地锦、络石为研究材料,采用锰污染土壤培养法对扦插苗进行锰胁迫耐受性对比实验。分析不同锰浓度处理下,4种植物的生物量,耐性系数、Mn转移系数、Mn生物富集系数以及相关生理指标的变化,为重金属尾矿区污染土壤的园林绿化植物选择及其耐性生理机理的深入研究提供科学依据。
1 材料和方法
1.1 实验材料
供试材料为4 个藤本植物薜荔(Ficuspumila)、忍冬(LonicerajaponicaThunb)、五叶地锦(Parthenocissusquinquefolia)和 络 石(Trachelospermumjasminoides)同期的扦插苗,均取自湖南湘潭仁芳园艺场。
1.2 实验方法
实验于2014年3月中旬开始至2014年8月底结束。盆土取自湖南科技大学生命学院生物园植物繁育基地园土。土壤为红壤,pH 值为5.59,锰含量为380.16 mg/kg,全N 1.72g/kg、速效N 97.30 mg/kg、速 效P 20.50 mg/kg,速 效 K 81.30 mg/kg。采用模拟Mn污染土壤培养法,将土壤粉碎风干过5mm 筛,以溶液态加入分析纯MnCl2·4H2O,以不加Mn作为空白对照,在对照基础上配成Mn增加含量为3 000mg/kg(T1)、6 000mg/kg(T2)、9 000mg/kg(T3)、12 000mg/kg(T4)的Mn污染土壤。均匀搅拌并将这些土壤装至直径38 cm、高26cm 塑料花盆中。在湖南湘潭仁芳园艺场选择同期扦插的生长健壮的上述4个藤本植物扦插苗,扦插苗高约在25cm 左右,同种植物间大小长势基本一致,分别移栽至以上的塑料圆盆中,每种植物5个处理,每个处理5盆,每盆扦插2株,重复3次。每天观察植株生长情况,适时用不含重金属的去离子水喷洒植株,喷洒时水不能从盆底流出,以减少实验误差。
1.3 样品测定
处理150d后取4种藤本植物各处理新鲜叶片进行叶绿素含量、丙二醛(MDA)含量以及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)抗活性测定。叶绿素测定时采集植物的新鲜成熟叶片,利用分光光度法进行测定[13]。SOD、CAT、POD 的活性测定均参照李合生等[14]的方法。MDA 含量测定参照中国科学院上海植物生理研究所介绍的方法[15],将处理后的植株分为地上和根系两部分,分别测其部分长度。用超纯水进行冲洗去除粘附于待测植物样品上的污物,再用去离子水冲洗,在105℃下杀青10min,在70℃下烘48h至恒重。称重后植物粉碎机粉碎,过60目筛,储存于聚乙烯瓶中备用[16]。取植物各部分样品干粉各0.200 0g用混酸(HNO3∶HClO4=2∶1)消化,采用等离子体原子发射光谱仪(ICP-7510,岛津公司)测定植物体内的Mn含量[17]。
1.4 数据处理
耐性指数(Tolerance index,Ti)用植株的生长参数,如地上部分生物量、地下部生物量、地下部分长度、地上部分长度与对照的比值表示,即Ti=处理后的生长参数/CK 的生长参数,平均耐性参数为各参数的Ti均值[18]。转移系数(TF,Translocation factors)=地上部分锰浓度/根系锰浓度[19]。生物富集系数(BCF,Bio-concentration factors)=地上部分或根系锰浓度/土壤锰浓度[20]。实验数据统计分析采用Excel和SAS软件。
2 结果与分析
2.1 不同锰浓度处理对4种藤本植物地上部分、根的生物量、生长量的影响
由表1可知,随着Mn处理浓度的增加,络石、忍冬地上部分和根的生物量、生长量及耐性系数均出现先略有上升后大幅下降的趋势,其中忍冬在T1处理时达到峰值,络石在T2处理时达到峰值,之后各相应指标开始下降。薜荔、五叶地锦地上部分和根的生物量、生长量及耐性系数随着Mn处理浓度的增加持续下降。4种植物在T4处理时各指标均降到最低,其中地上部分和根的生物量与对照的比值按从大到小的顺序依次是络石(68.2%、71.9%)、忍冬(66.3%,57.8%)、五叶地锦(60.0%、54.7%)、薜荔(58.8%、44.7%),而生长量与对照的比值按从大到小的顺序依次是络石(88.0%、76.7%)、忍冬(82.5%、72.0%)、五叶地锦(78.3%、67.4%)、薜荔(73.0%、66.1%)。薜荔、五叶地锦、忍冬、络石的平均耐性指数分别为82.48%、84.86%、89.21%和95.41%。以上结果表明低浓度的Mn处理能小幅度促进络石、忍冬的生长,而高浓度Mn处理则会显著抑制4种藤本植物的生长,对Mn污染的耐受能力大小依次为络石、忍冬、五叶地锦和薜荔。
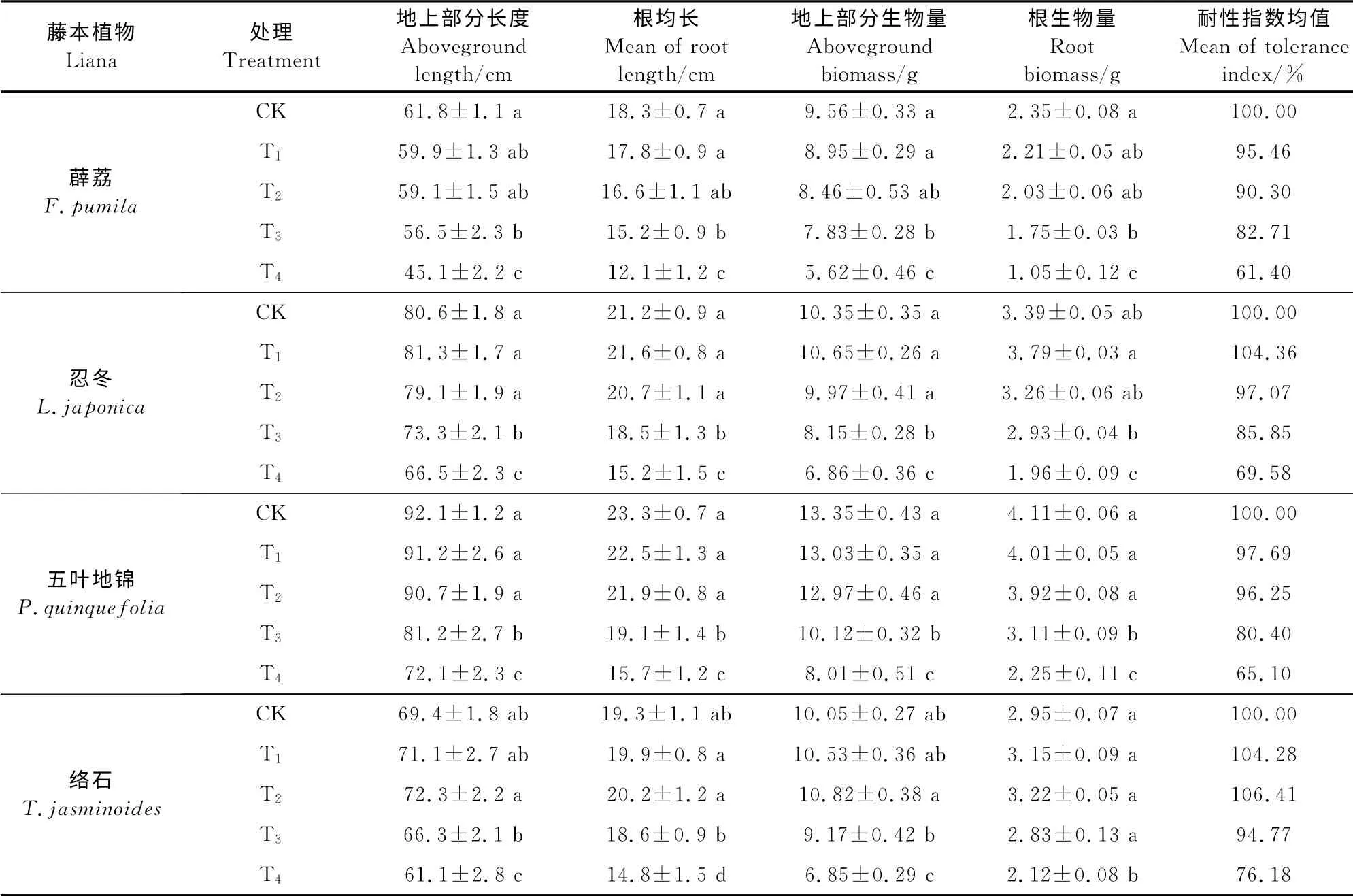
表1 不同锰处理浓度下4种藤本植物的生长指标Table1 The growth indexes of four lianas under different Mn concentration
2.2 Mn胁迫对4 个藤本植物Mn含量、转移系数和生物富集系数的影响
随土壤中Mn浓度增加,4 种藤本植物地上部分和根系Mn含量均呈现先持续上升后基本不变的趋势,在T3处理时地上部分和根系Mn含量均达到最大值(图1)。表明4种植物的锰富集量随着锰处理浓度的升高而增加,但有一定的阈值,当超过阈值时Mn含量变化不明显。分别对比4种植物地上部分以及根系的Mn含量发现,植物间有较大差异,其中络石在各处理下Mn含量均大于其他3种植物,之后依次是忍冬、五叶地锦,薜荔。将各处理下地上部分Mn含量与根系Mn含量进行比较,发现根系Mn含量均高于地上部分,这表明根系对Mn的富集能力比地上部分强。
从图2中可以看出,4种藤本植物转运系数均小于1,说明他们对Mn的转运能力不高,但植物间仍存在差异,变化幅度为0.42~0.61,其中络石在各处理下的转运系数最高,均显著高于其他3种植物,忍冬次之,而五叶地锦、薜荔较小且两者差异不显著。表明络石、忍冬的根部对Mn的转移能力比五叶地锦、薜荔强,它们能将较多的Mn运送到植株地上部分,从而提高Mn的耐受能力。
图3显示,随着Mn浓度的增加4种藤本植物地上部分和根对Mn富集能力均呈现先升后降的趋势,并在T1处理就达到峰值。表明低浓度Mn处理能提升Mn的富集能力,当继续增加Mn含量富集能力变化不明显甚至出现下降,说明4 种植物Mn富集能力有一定的阈值。通过比较地上部分、根系以及植物间富集系数发现,地下部分的富集系数高于地上部分,这表明根系的富集能力高于地上部分。络石地上部分和根的Mn富集系数在各处理下均显著高于其他3种植物,其他由强到弱依次为忍冬、五叶地锦、薜荔。

图1 不同处理地上部分和根系锰含量的变化Fig.1 Change of Mn content in aboveground and root with different treatment
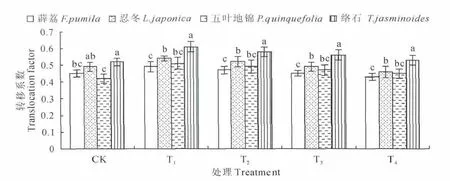
图2 不同处理转移系数的变化Fig.2 Changes of TF factor with different treatment
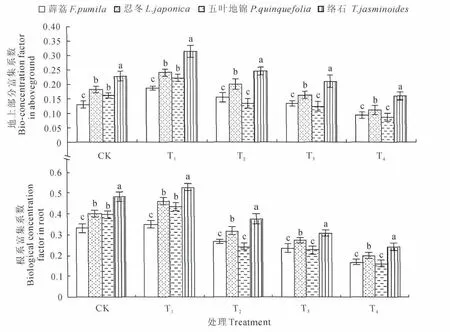
图3 不同处理地上部分和根系Mn富集系数的变化Fig.3 Changes of BCF in aboveground and roots with different treatments
2.3 Mn对4种藤本植物叶片叶绿素总量和MDA含量的影响
由表2可以看出,随着Mn处理浓度的不断增加,薜荔叶绿素总含量持续降低,而忍冬、五叶地锦、络石均呈现先上升后持续下降的趋势。其中,五叶地锦在T1处理到达峰值,忍冬、络石在T2处理时达到峰值,这表明低浓度的Mn处理能小幅度地促进络石、忍冬、五叶地锦叶绿素的合成。络石、忍冬、五叶地锦、薜荔的叶绿素含量均在T4处理时降到最低,分别为对照的67.19%、62.61%、56.51%、49.46%。由此可见,络石叶绿素含量下降幅度最小,而薜荔下降幅度最大。
同时,随着Mn处理量的增加,薜荔叶片MDA含量持续升高,而络石、忍冬、五叶地锦均表现为开始无明显差异后持续显著上升的趋势(表2)。在T4处理下络石、忍冬、五叶地锦、薜荔MDA 含量均升到峰值,分别为对照的1.83倍、1.91倍、1.94倍、2.11倍。由此可以看出,络石MDA 含量增幅最低,表明其抗Mn胁迫的能力最强,其他3种植物按强到弱依次为忍冬、五叶地锦和薜荔。
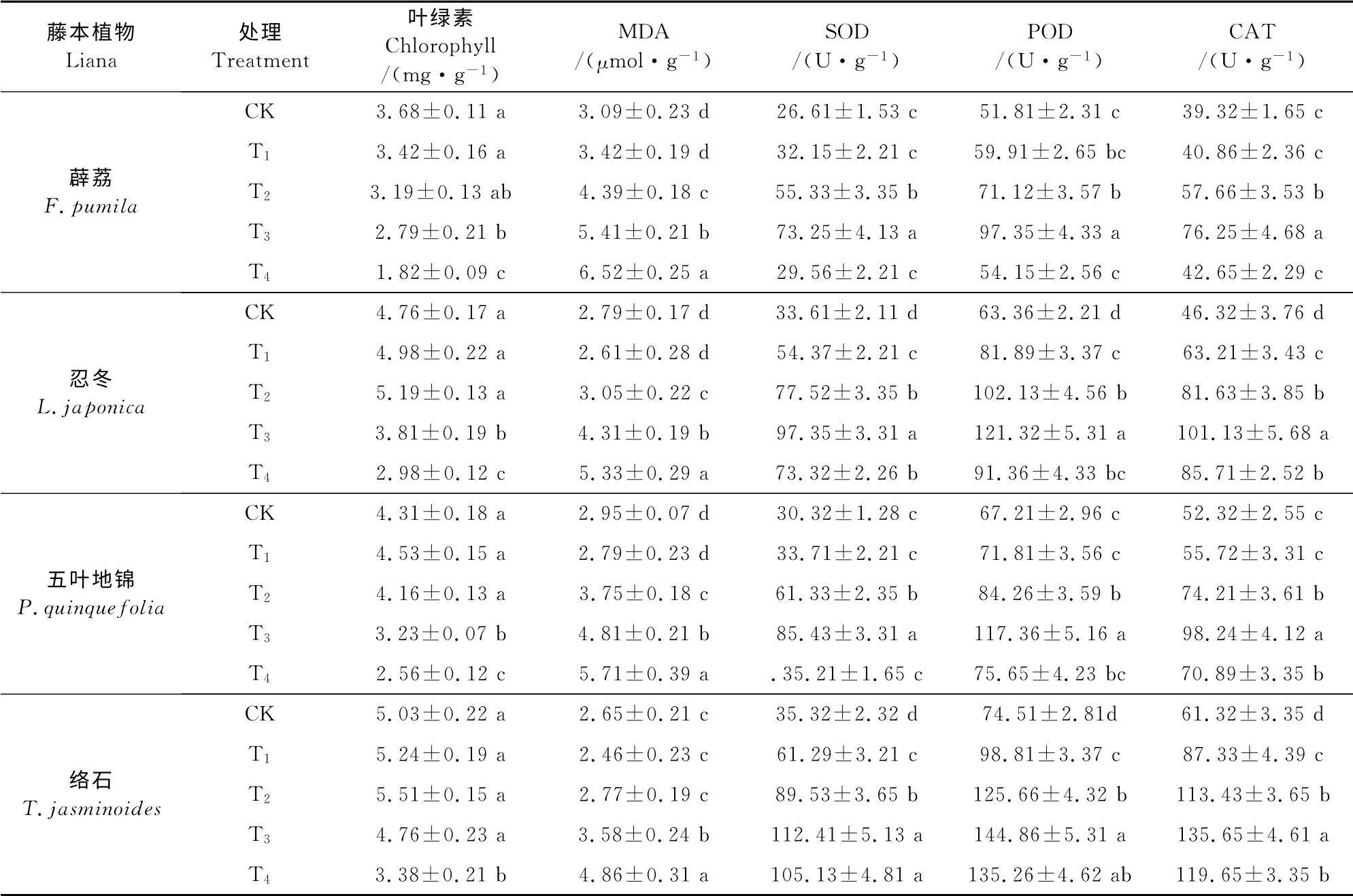
表2 不同锰处理浓度下4种藤本植物的叶绿素含量、MDA含量、SOD、POD、CAT活性Table2 Concentration of different physiology index in four lianas under different concentrations of Mn
2.4 Mn对4 种藤本植物叶片的SOD、POD、CAT活性的影响
如表2所示,4 种藤本植物的SOD、POD 和CAT 活性随Mn处理浓度的升高呈先升后降的趋势,并均在T3处理时达最大值。此时络石、忍冬、五叶地锦、薜荔SOD 活性分别为对照的3.18 倍、2.89倍、2.82倍、2.72倍,POD 活性分别为对照的1.94倍、1.91倍、1.75倍、1.88倍,而CAT 活性分别为对照的2.21 倍、2.18倍、1.94倍、1.88倍,且均与对照间差异显著(P<0.05)。T4处理络石、忍冬、五叶地锦、薜荔的SOD、POD 和CAT 活性均下降,SOD 活性分别为最高值的93.35%、75.3%、42.21%、40.5%,POD 活 性 分 别 为 最 高 值 的93.3%、75.3%、64.5%、55.6%,CAT 活性分别最高值的87.6%、84.8%、72.1%、55.9%。由此可见,T3处理时络石的3种抗氧化酶活性上升幅度均最大,而T4处理时下降幅度均最少,表明其受到Mn胁迫程度最低,其他3种植物按受胁迫程度的高低依次为:薜荔、五叶地锦和忍冬。
3 讨 论
生长量和生物量的变化是植物受到胁迫后最先表现出的可见响应,尤其是当植物根部直接接触到污染的土壤时,其生长特性会表现出快速敏感的变化[21]。Mora等 报 道 了4 种 智 利 黑 麦 草(Lolium perenne)幼苗地上部与地下部干重在锰胁迫下出现不同程度的下降[22]。本研究发现随着Mn处理浓度的增加,络石、忍冬的生长量和生物量均出现先升后降的趋势,而薜荔、五叶地锦则呈现持续下降的趋势。在低浓度的Mn处理时,络石、忍冬的生长量和生物量出现小幅度的升高,这可能是由于Mn是植物正常生命活动所必需的微量矿质元素,广泛参与各种生命活动,低浓度的Mn处理能刺激某些酶的活性,促进植物生长[23-24]。也有可能是植物对最初伤害的一种保护反应,生长越快,重金属在植物体内的相对浓度就越低[25]。在T4处理时,4 种植物的生长量和生物量均不同程度的降到最低,达到显著水平。表明4种藤本植物均不同程度地受到Mn的胁迫,抑制了植物的生长,其中络石的降幅度最小、忍冬次之,这表明这两者对土壤锰污染有较强的生长适应性。之后的耐性指数分析也印证了该结果,络石、忍冬的平均耐性指数分别达到95.41%,89.21%,明显高于其他2种植物。
4种藤本植物的锰含量在4个处理浓度下均表现为根系>地上部分,表明Mn从根部转移到地上部分的较少,更多的富集在根部。由此推测限制重金属从根部转移动到地上部分可能是4种藤本植物耐受重金属污染的重要途径,这与孙玉珍等[9]的研究一致。转移系数(TF)和生物富集系数(BCF)可以用来评价植物修复土壤重金属污染的能力[21]。本研究发现4 种藤本植物Mn 的TF 存在较大差异。络石在各处理下的TF 均高于其他3种植物,忍冬次之,而五叶地锦、薜荔较小。表明络石、忍冬与五叶地锦、薜荔相比其转运能力更强,能将根部积累较多的Mn运输到地上部分,利用植物自身的解毒机制来减少Mn所带来的危害。由于4种植物的TF最大值仅为0.61,说明4种植物的Mn转运能力总体水平均不高,根系仍然是富集Mn的主要部位。此外,通过比较地上部分和根系的BCF也发现根系的高于地上部分,这表明根系的富集能力高于地上部分。因此,可以推测4种藤本植物对Mn的耐受力是通过根系自身排斥为主,转运为辅的方式来实现的。
有研究表明在Mn胁迫下龙葵和小飞蓬的光合作用电子传递过程和传递速率都受到抑制,叶绿素含量明显下降[26]。本研究中随着Mn处理浓度的增加,络石、五叶地锦、忍冬叶绿素的含量呈现先上升后下降的趋势,说明低浓度Mn处理可以使叶绿素含量增加,以增强光合作用,分析其主要原因可能是由于Mn不但是叶绿体结构的必要组成成分,而且还直接参与光合作用中的光合放氧过程[27]。当Mn处理浓度超过植物的耐受限度时4种藤本植物叶绿素含量显著降低,按降幅从大小排序依次为薜荔、五叶地锦、忍冬、络石。叶绿素含量下降的主要原因可能是因为高浓度的Mn抑制了叶绿体片层中捕光复合体的合成,同时相关酶活性也受到了抑制,阻碍了叶绿素合成[28]。
当植物遭受重金属胁迫时,生理代谢受阻并产生大量活性氧如O·-2、H2O2等,由此引起细胞膜脂过氧化作用的加强,导致膜系统受损、植株伤害。MDA 的含量能反映植物细胞受伤害的程度[29]。本研究中4种藤本植物MDA 含量随Mn处理浓度的增加而增加,这与王海华等[17]的研究结果一致。原因可能是随着Mn处理浓度的增加,植物体内产生了大量的活性氧,其细胞膜系统结构受到严重的损害,MDA 含量也相应升高。4种植物MDA 的上升幅度依次为薜荔>五叶地锦>忍冬>络石,这表明络石抗逆性最强,而薜荔最低。SOD、CAT、POD 等保护酶系统具有清除活性氧自由基的功能。SOD能将O·-2氧化成H2O2,由CAT、POD 将H2O2分解成H2O[30]。因此,这些保护酶的活性若能提高,其清除活性氧自由基的能力会相应增强,从而减轻伤害。本研究结果表明,随着Mn处理浓度的增加,4种藤本植物的SOD、POD 和CAT 活性随锰处理浓度的升高呈先升后降的趋势,这3种酶活性升高是因为Mn胁迫下植物体内过氧化物的增加而诱导的,这也说明3种酶在缓解锰引起的氧化胁迫中起着重要作用[31]。在T4处理时SOD、POD、CAT 活性均呈现均下降的趋势,这是因为Mn胁迫超过了一定限度、其生理代谢受到了严重影响,难以继续诱导酶活性升高。
综上所述,4 种藤本植物对Mn污染土壤的耐受能力有较大差异,其中络石的耐受性最强,受Mn胁迫最小,Mn转移能力和富集能力也最高,忍冬次之,而薜荔最低;相应生理指标检测发现,相比其他3种植物,T4处理时络石的抗氧化酶活性提高幅度最大,氧化损伤最低,叶绿素含量降低幅度、MDA含量上升幅度均最低,这从侧面揭示了其耐锰的生理原因。以上结果表明络石是一种具有较高耐锰能力的潜力植物,可以利用它对Mn尾矿污染土壤进行植物修复。
[1] ZHANG Y X(张玉秀),LI L F(李林峰),CHAI T Y(柴团耀),etal.Mechanisms of manganese toxicity and manganese tolerance in plants[J].ChineseBulletinofBotany(植物学报),2010,45(4):506-520(in Chinese).
[2] LI Y ZH(李有志),LUO J(罗 佳),etal.Plant resources investigation and hyper accumulator screening in Xiangtan manganese mine area of Hunan Province,Central-South China[J].ChineseJournalofEcology(生态学杂志),2012,31(1):16-22(in Chinese).
[3] GONG J F(宫杰芳),ZHOU Y CH(周运超),LI X Y(李小永),etal.Responses of physiological indices ofPinusmassonianaseedlings to high manganese stress[J].ChineseJournalofEcology(生态学杂志),2012,31(3):520-525(in Chinese).
[4] HAO Y B(郝雅宾),LI F Y(李凤玉),LIU H SH(刘海山),etal.Effect of soluble protein inPhytolaccaacinosaRoxb andFestucaarundinaceaSchreb under Fe2+,Mn2+stress[J].JournalofFujianNormalUniversity(福建师范大学学报),2013,29(3):28-35(in Chinese).
[5] JIN X J(金喜军),QU CH Y(屈春媛),ZHAO Y N(赵云娜),etal.Effect of manganese stress on nitrogen accumulation of soybean[J].JournalofNuclearAgriculturalSciences(核农学报),2015,29(1):146-152(in Chinese).
[6] MILLALEO R,REYES-DIAZ M,IVANOV A G.Manganese as essential and toxic element for plants:transport,accumulation and resistance mechanisms[J].JournalofSoilScienceandPlantNutrition,2010,10(4):476-494.
[7] LIANG W B(梁文斌),XUE S G(薛生国),SHEN J H(沈吉红),etal.Effect of manganese stress on photosynthesis and chlorophyll fluorescence parameters ofPhytolaccaamericana[J].ActaEcologicaSinica(生态学报),2010,30(3):619-625(in Chinese).
[8] 梁 希.锰矿尾矿库耐性植物的筛选及其耐性机理初步研究[D].长沙:中南林业科技大学,2014.
[9] 孙玉诊.花卉植物对锰污染的耐性及其影响因子研究[D].长沙:湖南农业大学,2014.
[10] WANG Y SH(王业社),YANG X J(杨贤均),CHEN L J(陈立军),etal.Diversity and ecological characteristics of wild liana in Hunan Huangsang National Nature Reserve[J].ActaBot.Boreal.-Occident.Sin.(西北植物学报),2013,33(10):2 095-2 103(in Chinese).
[11] YUAN ZH(袁 喆),HANG X Z(杭夏子),WENG SH F(翁殊斐).Geographical element of liana in Guangdong and their potential for application in landscape architecture[J].SubtropicalPlantScience(亚热带植物科学),2014,43(1):79-83(in Chinese).
[12] YAN L H(颜立红),QI CH J(祁承经),LIU X X(刘小雄),etal.The relationship between vine diameter at breast height and its host tree diameter at breast height in Hunan Province,China[J].ActaEcologicaSinica(生态学报),2007,27(10):4 317-4 324(in Chinese).
[13] GUO ZH(郭 智),YUAN H Y(原海燕),AO Y S(奥岩松).Effect of cadmium on photosynthesis and nutrient elements uptake ofSolanumnigrumseedlings[J].EcologyandEnvironmentalSciences(生态环境学报),2009,18(3):824-829(in Chinese).
[14] 李合生,孙 群,赵世杰.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:42-45.
[15] 中国科学院上海植物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999:35-37.
[16] JIA ZH M(贾中民),WEI H(魏 虹),SUN X C(孙晓灿),etal.Accumulation and tolerance ofSalixvariegateandPterocarya stenopteraseedlings to cadmium[J].ActaEcologicaSinica(生态学报),2011,31(1):107-114(in Chinese).
[17] WHAG H H(王海华),FENG T(冯 涛),PENG X X(彭喜旭),etal.Effects of manganese on antioxidant system of manganese-hyperaccumulatorPhytolaccaamericanaL.[J].ChineseJournalofAppliedEcology(应用生态学报),2009,20(10):2 481-2 486(in Chinese).
[18] WILKINS D A.The measurement of tolerance to edaphic factors by means of root growth[J].NewPhytol.,1978,80(3):623-633.
[19] MACFARLANE G R,KOLLER C E,BLOMBERG S P,etal.Accumulation and partitioning of heavy metals in mangroves:a synthesis of field-based studies[J].Chemosphere,2007,69(9):1 454-1 464.
[20] ALIAKSANDR K,LILIAN M,ROLF H.Phenotypic seedling responses of a metal-tolerant mutant line of sunflower growing on a Cu-contaminated soil series:potential uses for biomonitoring of Cu exposure and phytoremediation[J].PlantandSoil,2014,376(2):377-397.
[21] ASSUNCAO A,BOOKUM W,NELISSEN H,etal.Who differential metal-specific tolerance and accumulation patterns amongThlaspi caerulescenspopulations originating from different soil types[J].NewPhytol.,2003,159:411-419.
[22] MORA M,ROSAS,RIBERA A,RENGEL Z.Differential tolerance to Mn toxicity in perennial ryegrass genotypes:involvement of antioxidative enzymes and root exudation of carboxylates[J].PlantSoil,2009,320:79-89.
[23] ZHANG X,ZHANG S,XU X,etal.Tolerance and accumulation characteristics of cadmium inAmaranthushybridusL.[J].J.Haz.Mat.,2010,180:303-308.
[24] GIRISH C,SAIFULLAH,NANTHI B,etal.Influence of soil chemistry and plant physiology in the phytoremediation of Cu,Mn,and Zn critical reviews in plant sciences Journal[J].CriticalReviewsinPlantSciences,2014,33(5),374-382.
[25] ZACCHINI M,AGAZIO M.Spread of oxidative damage and antioxidative response through tobacco callus cell layers after UV-C pulse treatment[J].PlantPhysiol.Biochem.,2004,42:445-450.
[26] WU H F(吴惠芳),LIU P(刘 鹏),etal.Effects of manganese stress on growth,chlorophyll fluorescence parameters ofSolanumnigrumL.andConyzacanadensisL.[J].JournalofAgro-EnvironmentScience(农业环境科学学报),2010,29(4):653-658(in Chinese).
[27] XU W B(许文博),SHAO X Q(邵新庆),WANG Y T(王宇通),etal.Research progress in physiological function of manganese and manganese poisoning in plants[J].GrasslandandTurf(草原与草坪),2011,31(3):5-14(in Chinese).
[28] WANG H(王 华),TANG SH M(唐树梅),LIAO X J(廖香俊),etal.Physiological and molecular mechanisms of Mn uptake by hyperaccumulting plantPolygonumhydropiper(Polygonaceae)[J].ActaBotanicaYunnanica(云南植物研究),2008,30(4):489-495(in Chinese).
[29] IORI V,PIETRINI F,CHEREMISINA A,etal.Growth responses,metal accumulation and phytoremoval capability inAmaranthusplants exposed to nickel under hydroponics[J].WaterAirSoilPoll.,2013,224:1 450-1 459.
[30] AHMAD P,JALEEL C,SALEM M,etal.Roles of enzymatic and nonenzymatic antioxidants in plants during abiotic stress[J].Crit.Rev.Biotechnol.,2010,30(3):161-175.
[31] YAN A L(燕傲蕾),WU T T(吴亭亭),WANG Y B(王友保),etal.The characteristics of cadmium tolerance and accumulation in three kinds of ornamental plants[J].ActaEcologicaSinica(生态学报),2010,30(9):2 491-2 498(in Chinese).

