氢氧化镁溶于氯化铵溶液的实质
吉林省白山市抚松五中 曹艳红
在我从事高中化学教学的十年中,我一直在学习化学及其相关知识,以期用最准确的语言给学生讲解最准确的知识,但是要做到这一点是很难的。因为有一些探讨题或知识点根本就没有准确的解释。遇到这类情况时,都要多方面的查阅资料,寻找最合理、最贴近答案的解释。最近我就看到了这样的一个知识点:在高等教育出版社出版的高等学校教材《无机化学》上册(第三版)P115,难溶的氢氧化物都能溶于酸溶液。
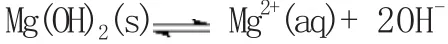

其实质是:因为Mg(OH)2固体电离出来的OH-与酸提供的H+结合生成弱电解质水,降低了溶液中的OH-浓度,使Qc﹤Ksp,于是平衡向沉淀溶解的方向移动。只要加入足量的酸,Mg(OH)2固体将全部溶解。
某些难溶氢氧化物还能溶于铵盐:
Mg(OH)2+ 2NH4+=Mg2++2NH3•H2O
书中给出了方程式,没有详细叙述原因。但其本质是什么呢?是不是与难溶氢氧化物溶于酸溶液的实质一样,溶液中酸电离出的氢离子中和碱电离出的氢氧根离子,促进难溶氢氧化物的溶解平衡向溶解方向移动,从而使难溶氢氧化物溶解呢?当我正在思考这个问题的时候,恰好遇到了一道习题,解决了我的困扰。下面我就以习题为例探究一下难溶氢氧化物溶于铵盐溶液的实质。
例:已知氨水与醋酸的电离程度在同温度同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:

由于NH4+水解显酸性,H+和OH-反应生成水,导致反应①平衡右移,沉淀溶解;
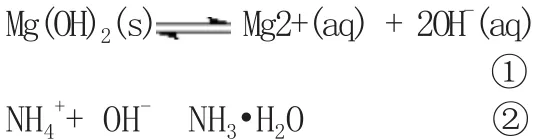
乙同学的解释是:由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3•H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
⑴丙同学不能肯定那位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是_(填写编号)。
A. NH4NO3B. CH3COONH4
C. Na2CO3D. NH3•H2O
⑵请你说明丙同学作出该选择的理由是 _。
⑶丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此可推知,甲和乙哪位同学的解释更合理_(填甲或乙);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式_ 。
答案:⑴ B
⑵CH3COONH4溶液呈中性,滴入Mg(OH)2悬浊液中,若Mg(OH)2悬浊液溶解,则说明乙同学解释正确,若Mg(OH)2悬浊液不溶解,则甲同学解释正确。
⑶乙;Mg(OH)2+ 2NH4+=Mg2++2NH3•H2O
信息:仔细阅读题干,领会题意,会得到下列信息:其一,由“氨水与醋酸的电离程度在同温度同浓度下相等”可知,同体积、同浓度的氨水和醋酸溶液反应后呈中性,因为CH3COO-和NH4+水解程度相同,所以CH3COONH4溶液呈中性;其二,由“溶有一定量氨的氯化铵溶液呈碱性”可知,氨水电离使其溶液显碱性,氯化铵水解使其溶液显酸性,二者混合后溶液呈现出碱性,说明在混合溶液中电离程度大于水解程度,体现了矛盾的主次之分。其三,氢氧化镁固体能溶于氯化铵溶液中。
解析:因为NH4Cl溶液呈酸性,而Mg(OH)2虽然是一种难溶于水的碱,但却能溶于酸中,故有甲、乙两位同学的解释。所以加入含有H+而不含NH4+的物质时,只能说明H+能使Mg(OH)2溶解,却不能排除NH4+也能使Mg(OH)2溶解的可能,因而还不足以证明甲同学的解释正确。看来只有加入不含H+而含有NH4+的物质了。选项给出的物质中NH4NO3也是强酸弱碱盐,与NH4Cl性质相似,所以无法作证;而Na2CO3和NH3•H2O由于能间接或直接地提供OH-,因而均不能使Mg(OH)2溶解,与题中信息不符,所以也不能作证。现在可以选择中性的CH3COONH4溶液,滴入Mg(OH)2悬浊液中,若Mg(OH)2溶解,则说明乙同学的解释正确,若Mg(OH)2不溶解,则说明甲同学的解释正确。根据题意,乙解释正确,原理类似“强碱制弱碱”。事实告诉我们,H+和NH+4都能使Mg(OH)2溶解,在该题的情况下,之所以是NH4+促使Mg(OH)2溶解,原因在于NH4Cl饱和溶液中NH4+比H+的浓度大得多。这从一个侧面体现了矛盾的主次之分。
做完这道题后,我设想如果往Mg(OH)2悬浊液中加入足量的NH4Cl固体,Mg(OH)2也会溶解,其实质是什么呢?究其原理实际上就是NH+先4与Mg(OH)2电离出的OH-结合还是先与H2O电离出的OH-结合的问题。为此我又用溶度积常数进行了计算,Mg(OH)2的溶度积常数为1.8×10-11。在Mg(OH)2的悬浊液中Mg(OH)2电离出的c(OH-)=3.28×10-4mol/L; 而Mg(OH)2悬浊液中H2O电离出的c(OH-)=3.05×10-11mol/L 。 Mg(OH)2电离出来的c(OH-)大于水电离出来的c(OH-),由此可见,NH4+先与Mg(OH)2电离出的OH-结合,使c(OH-)减小,溶解平衡:Mg(OH)2(s)Mg2+(aq) + 2OH-(aq)向溶解的方向移动,所以,只要有足量的NH4Cl固体,Mg(OH)2也将全部溶解。
通过对这道习题的深入解析,我得出结论:难溶的氢氧化物溶于铵盐溶液的实质是:如果难溶氢氧化物电离出的氢氧根离子浓度大于水电离出的氢氧根离子浓度时,铵根离子先与难溶氢氧化物电离出的氢氧根离子结合生成一水合氨,使难溶氢氧化物的溶解平衡向溶解方向移动,从而使难溶氢氧化物溶解;如果难溶氢氧化物电离出的氢氧根离子浓度小于水电离出的氢氧根离子浓度时,铵根离子先与水电离出的氢氧根离子结合生成一水合氨,破坏水的电离平衡,促进水的电离,使溶液呈酸性,即发生了水解,然后水解产生的氢离子与难溶氢氧化物电离出的氢氧根离子结合生成水,使难溶氢氧化物的溶解平衡向溶解方向移动,从而使难溶氢氧化物溶解。但是,这个结论有其局限性,那就是不适用于所有的难溶的氢氧化物,有一些溶解度很小的氢氧化物无法溶解于铵盐溶液中,只能溶解于酸溶液中,因为即使水解会使溶液呈现酸性,也就是c(H+)>c(OH-),但是氢离子浓度还是很小,虽然氢离子结合氢氧根离子的能力很强,但氢离子浓度小,会影响它的结合能力;而在酸溶液中,氢离子浓度要大于相同条件下的盐溶液中的氢离子浓度。因此,当在一个体系中存在多个过程的时候,一定要分清矛盾的主次。这样才能更准确地理解题意,找到最合理的解释。

