4种植物激素对紫苏叶愈伤组织诱导及黄酮积累的影响
郭云贵,程晓敏,王泽琼,于 娅,韩晓红(武汉生物工程学院 生物科学与技术学院,湖北 武汉 430415)
4种植物激素对紫苏叶愈伤组织诱导及黄酮积累的影响
郭云贵,程晓敏,王泽琼,于 娅,韩晓红
(武汉生物工程学院 生物科学与技术学院,湖北 武汉 430415)
以紫苏叶为外植体,采用单因素和正交设计试验研究了植物激素对紫苏叶愈伤组织诱导和黄酮积累的影响。结果表明:4种激素对紫苏叶愈伤组织诱导的影响依次为2,4-D>6-BA>NAA>KT;对愈伤组织积累黄酮的影响依次为2.4-D>6-BA>KT>NAA;紫苏叶愈伤组织培养的最佳激素组合为6-BA 2.0 mg/L+2,4-D 0.5 mg/L+ KT 0.6 mg/L+NAA 0.8 mg/L;经愈伤组织培养获得的黄酮含量最高达到3.925%,远高于自然界紫苏叶黄酮含量。上述试验结果说明利用组培技术获得紫苏黄酮有可行性。
紫苏叶;植物激素;黄酮;愈伤组织;正交试验
0 引言
紫苏(Perilla frutescens L Brit)是国家卫生部首批颁布的药食兼用的中药植物之一[1]。紫苏叶含多种营养成分以及迷迭香酸、多酚、黄酮等生物活性物质[2],其中黄酮类化合物由于具有防癌抗癌、抗肿瘤、抗心血管疾病等疗效[3],近年来从自然界紫苏叶中提取黄酮的研究时有报道[4-7]。但利用植物组织培养技术生产药用成分已成为开发药用植物资源的重要途径,其中激素是组织培养过程中影响药用成分含量的重要因素[8-9]。现今药用植物紫苏叶通过组培技术诱导愈伤组织并生产迷迭香酸的研究较多。刘艳等[10]对紫苏愈伤组织及其继代培养的激素条件进行了优化;吕晓玲等[11]探讨了激素对紫苏叶愈伤组织积累迷迭香的影响;李会珍等[12]利用悬浮细胞培养生产迷迭香;李荣贵等[13]对紫苏愈伤组织迷迭香进行了纯化。但目前国内利用植物组培技术生产紫苏黄酮的研究还鲜有报道。本试验以紫苏叶为外植体,利用单因素及正交试验探讨了4种激素单独使用和组合使用对紫苏叶愈伤组织诱导和黄酮积累的影响,为后期筛选高产悬浮细胞系大规模生产黄酮提供一定的技术依据。
1 材料与方法
1.1 紫苏叶愈伤组织诱导
1.1.1 外植体消毒及接种培养 取紫苏嫩叶流水洗净后入超净工作台上,先用75%酒精消毒30 s,再用0.1%HgCl2消毒6~8 min,无菌水冲洗3~4次,然后切取嫩叶中脉附近1 cm2左右的叶块,以叶片背面平铺于培养基上,将培养物放于(25±2)℃、光照时间12 h/d的培养室中培养。
1.1.2 培养基设计 单因素培养基设计:以MS+蔗糖30 g/L+琼脂7 g/L为基础培养基(pH=5.8±0.2),每种培养基分别添加不同浓度的6-BA、2,4-D、KT和NAA。
正交试验设计:在单因素试验的基础上,进行L9(3)4正交试验,各因素水平如表1所示。

表1 L9(34)正交试验因素和水平Tab.1 Factors and levels of L9(34)orthogonal experiment
1.1.3 数据统计与计算 紫苏叶培养25 d后统计有效接种数、愈伤组织形成数(以愈伤组织超过叶面积1/2为基准),并计算愈伤组织诱导率;培养40 d后称量愈伤组织重量,求取平均值。
有效接种数指接种培养25 d后未被污染的接种材料数;
诱导率/%=形成愈伤组织的有效接种数/有效接种数×100%;
愈伤组织平均重量=各处理组愈伤组织总重量/形成愈伤组织的有效接种数。
1.2 黄酮提取与含量测定
1.2.1 愈伤组织黄酮提取 将紫苏叶和各处理组愈伤组织收集并于60℃烘干,磨成粉末后过100目筛,准确称取0.4 g入锥形瓶,加入16 mL 75%乙醇,超声波处理40 min后,75℃水浴1 h,然后放入冷凝回流装置中提取75 min,过滤,收集滤液并用30%乙醇定容至10 mL备用。
1.2.2 黄酮含量测定 以芦丁为对照品,采用NaNO2-Al(NO3)3-NaOH比色法[9]测定黄酮总含量:准确称取芦丁标准品20.0 mg,用30%乙醇溶解后转入100 mL容量瓶,定容得质量浓度为0.2 mg/mL芦丁标准溶液,分别准确吸取1、2、3、4、5和6 mL芦丁标准溶液于25 mL刻度管中,加30%乙醇至6 mL,然后移取0.75 mL 5%NaNO2溶液,摇匀后静置6 min加入0.75 mL 10%Al(N03)3溶液,再摇匀后静置6 min,加人5 mL 1 mol/L NaOH溶液,并用30%乙醇溶液定容,摇匀后静置15 min,以30%乙醇为空白对照,于波长510 nm处测定吸光度 A。以质量浓度(C)为纵坐标,以吸光度(A)为横坐标,制作标准曲线: y=0.073 3x-0.001,R2=0.992 2。精密移取1 mL各处理组愈伤组织提取物于25 mL刻度管中,根据上述条件加入显色剂,用30%乙醇溶液定容至刻度,测定其吸光度,根据标准曲线计算样品中黄酮含量。
黄酮含量计算公式:

式中,V0为所得待测液定容体积,mL;V1为测量移取的待测液体积,mL;V2为移取液定容体积,mL;n为稀释倍数;M为原材料质量,g;C为被测提取液浓度,mg/mL。其中自然界紫苏叶黄酮含量为1.930%,以此作为愈伤组织培养生产黄酮含量的对照。
2 结果与分析
2.1 6-BA对紫苏叶愈伤组织诱导及黄酮积累的影响
紫苏叶培养12 d后边缘开始愈伤化,25 d后愈伤化明显,且愈伤组织紧密,观察并统计数据结果见表2。由表2可知,试验组中紫苏叶愈伤组织诱导率随6-BA浓度起伏变化而有明显差异,其中6-BA 2.0 mg/L时愈伤组织诱导率最高,达到54.5%,其愈伤组织平均重量也达到最高,为0.287 g;而6-BA 3.0 mg/L时黄酮含量最高,达到2.343%。综合愈伤组织诱导率、平均重量及黄酮含量,6-BA 2.0 mg/L时整体效果最好。
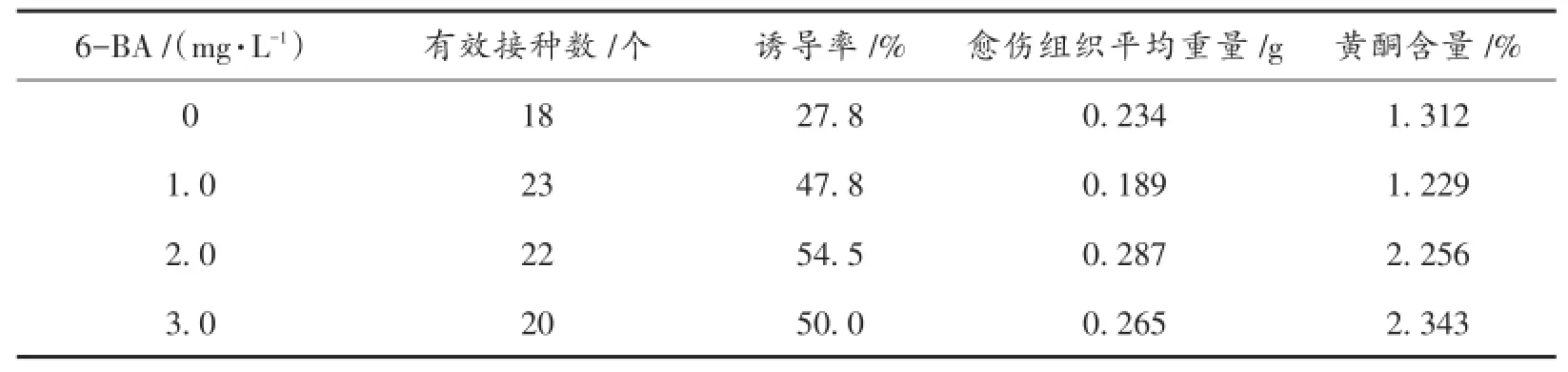
表2 6-BA对紫苏叶愈伤组织诱导及黄酮积累的影响Tab.2 Effect of 6-BA on callus inducing and flavonoid formation in Perilla Frutescens Leaves
2.2 2,4-D对紫苏叶愈伤组织诱导及黄酮积累的影响
基础培养基中添加2,4-D后,紫苏叶培养10 d后边缘开始愈伤化,25 d后部分愈伤组织出现褐化现象,统计结果见表3。由表3可知,随着2,4-D浓度升高,愈伤组织诱导率、平均重量和黄酮含量却表现下降趋势,且后期愈伤组织褐化严重。综合3个检测指标来看,2,4-D浓度为0.5 mg/L时适宜紫苏叶愈伤组织生长和黄酮积累。
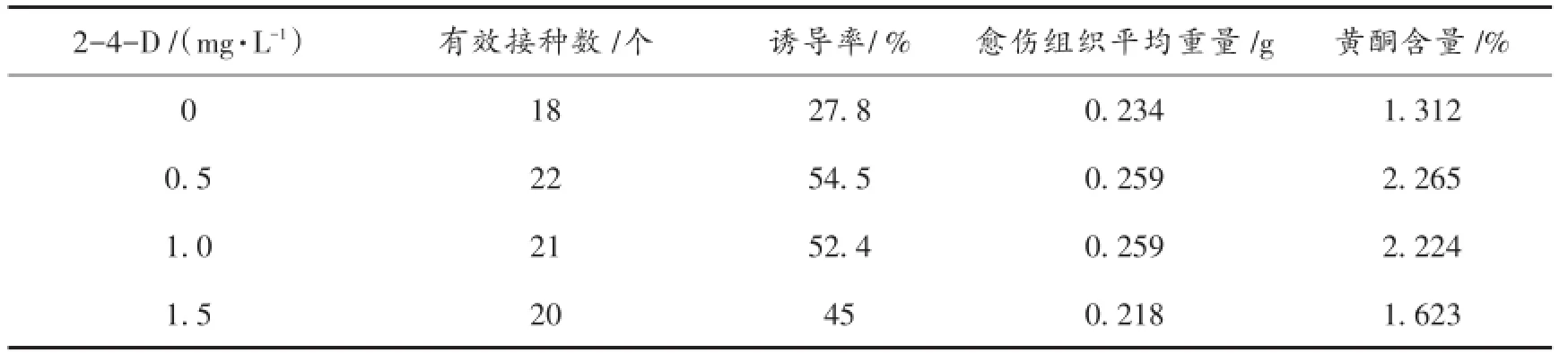
表3 2,4-D对紫苏叶愈伤组织诱导及黄酮积累的影响Tab.3 Effect of 2,4-D on callus inducing and flavonoid formation in Perilla Frutescens leaves
2.3 KT对紫苏叶愈伤组织诱导及黄酮积累的影响
紫苏叶在含有KT的培养基上培养25 d后愈伤组织较紧密,多为米黄色,生长状态没有其他组好。观察并统计数据见表4。由表4可知,愈伤组织的诱导率和黄酮含量随KT浓度的增加呈抛物线状,而愈伤组织平均重量呈下降趋势;综合诱导率、愈伤组织平均重量和黄酮含量,KT浓度为0.6 mg/L时适宜紫苏叶愈伤组织生长和黄酮积累。
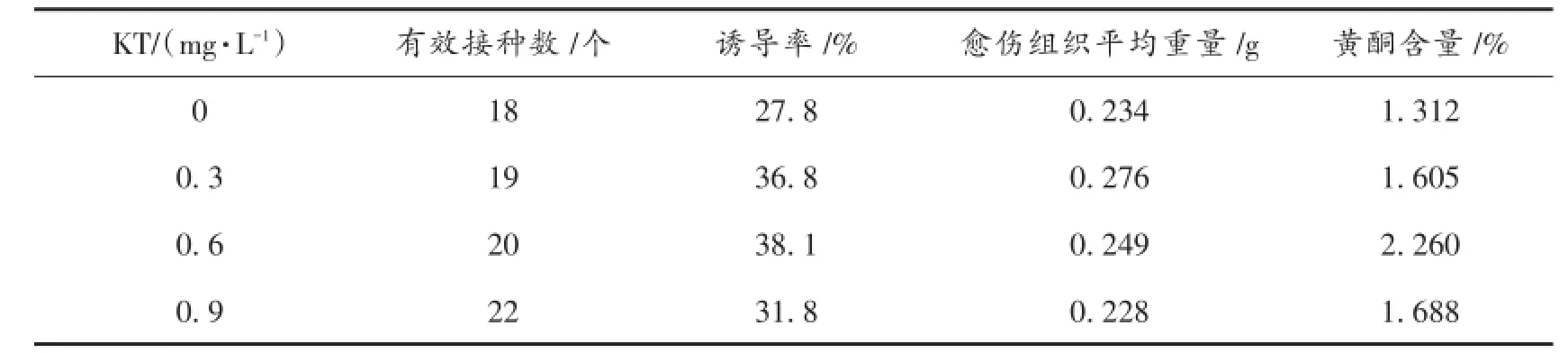
表4 KT对紫苏叶愈伤组织诱导及黄酮积累的影响Tab.4 Effect of KT on callus inducing and flavonoid formation in Perilla Frutescens leaves
2.4 NAA对紫苏叶愈伤组织诱导及黄酮积累的影响
基础培养基中添加不浓度的NAA后紫苏叶片培养15 d后边缘开始愈伤化,愈伤组织相对其他组而言较紧实,观察并且统计数据见表5。由表5可知,NAA对紫苏叶片愈伤诱导作用相对较小,试验组与对照组相比差异不明显,但仍可看出,诱导率呈现先升高后降低的趋势;愈伤组织平均重量和黄酮含量随NAA浓度的变化呈抛物线状,最高组均出现在NAA 0.8 mg/L培养基中。综合所有因素,NAA浓度为0.8 mg/L时最适宜。

表5 NAA对紫苏叶愈伤组织诱导及黄酮积累的影响Tab.5 Effect of NAA on callus inducing and flavonoid formation in Perilla Frutescens leaves
2.5 激素组合对愈伤组织诱导及黄酮积累的影响
将4种激素进行正交组合后加入培养基中培养25 d后观察,统计结果见表6。

表6 正交实验结果与分析Tab.6 Results and analysis of orthogonal experiment
由表6知,4种激素对紫苏愈伤组织诱导的影响作用依次为2,4-D>6-BA>KT>NAA,最佳激素组合为A2B1C3D2,4种激素对紫苏愈伤组织平均重量和黄酮含量的影响作用均为2,4-D>6-BA>NAA>KT,愈伤组织重量最优激素组合为A2B1C2D1,而黄酮含量的最优激素组合为A2B1C1D1;可看出3者最优激素组合中均有A2B1,而C和D因素在3者中都不统一,考虑单因素试验中KT浓度为0.6 mg/L和NAA浓度为0. 8 mg/L适宜,建议紫苏叶愈伤组织培养积累黄酮的最优激素组合为A2B1C3D2,即6-BA 2.0 mg/L+2.4-D 0.5 mg/L+KT 0.6 mg/L+NAA 0.8mg/L。
3 结论与讨论
植物组织培养中,植物激素是培养基的关键物质。诱导愈伤组织最常用的生长素是NAA和2,4-D,经常使用的细胞分裂素有6-BA和KT等。4种激素影响愈伤组织的诱导作用大小分别为2,4-D>6-BA>KT>NAA,这与伊庆良等[14]提出的品种遗传特性和2,4-D浓度是诱导愈伤组织的关键因素相符合。通过正交试验获得最优激素组合为6-BA 2.0 mg/L+2,4-D 0.5 mg/L+KT 0.6 mg/L+NAA 0.8 mg/L其愈伤组织诱导率和平均重量均为单因素试验结果的两倍,表明单一激素作用效果不如,激素之间协同作用。但激素的种类和浓度的最优组合研究是一个庞大的系统,且基本培养基、外植体、温度、湿度及光照条件等均有影响。
通过组织培养技术获得的愈伤组织生长速度快、质地疏松、呈颗粒状、易于分散,为后续细胞悬浮培养大规模生产紫苏黄酮提供了良好的培养体系。自然紫苏叶黄酮含量为1.930%,但通过本试验可以看出无论是各激素单独使用还是通过正交试验进行激素组合所获得的最优处理组的黄酮含量均较自然界紫苏叶黄酮含量高,其黄酮含量最高达到3.925%。表明利用植物组培技术从紫苏叶中获得黄酮这种药用成分是一种可行的途径。
(References)
[1] 刘海英,仇农学,姚瑞祺,等.我国86种药食两用植物的抗氧化活性及其与总酚酸的相关性分析[J].西北农林科技大学学报:自然科学版,2009,37(2):173-179.
[2] 张洪,黄建韶,赵东海.紫苏营养成分的研究[J].食品与机械,2006,22(2):41-43.
[3] 延玺,刘会青,邹永青,等.黄酮类化合物的生理活性及合成研究进展[J].有机化学,2008,28(9):1534-1544.
[4] 郭晓青,陈晓靓,杨春梅,等.紫苏叶提取物活性成分测定分析[J].安徽农业科学,2013,41(36):14039-14040.
[5] 刘毅君,曾广烨,李爱贞.超声波辅助法提取紫苏叶总黄酮的研究[J].集美大学学报:自然科学版,2014,19(1):21-24.
[6] 刘宁,仇农学,田玉霞.超声辅助提取紫苏叶黄酮及其清除自由基作用研究[J].西北林学院学报,2008,23(1):158.
[7] 李燕,曾庆华,陈利梅.正交试验法优选紫苏叶中总黄酮提取工艺[J].食品工程,2011,38(2):148-150.
[8] 胡燕梅,唐兴国,宋鹏飞,等.银杏叶愈伤组织培养及黄酮积累的正交试验优化[J].化学与生物工程,2009,26(9): 59-62.
[9] 孙军,胡正海.红豆杉愈伤组织的诱导培养及紫杉醇的产生[J].西北大学学报:自然科学版,2000,30(1):55-59.
[10]刘艳,李会珍,张志军.紫苏愈伤组织诱导及继代培养条件优化[J].西北农业学报,2013,22(10):146-151.
[11]吕晓玲,孙晶磊,王芳,等.外源激素对紫苏愈伤诱导及迷迭香酸积累的影响[J].食品与生物技术学报,2012,31(6): 575-580.
[12]李会珍,张志军,乔绍俊.紫苏细胞悬浮培养生产迷迭香酸条件研究[J].食品科学,2012,33(9):149-153.
[13]李荣贵,腾大为,杜桂彩,等.紫苏愈伤组织迷迭香酸的纯化及抗菌活性研究[J].微生物学通报,2000,27(5):324-327.
[14]伊庆良,刘世强.水稻悬浮细胞系及其单细胞培养的研究[J].沈阳农业大学学报,1994,25(4):366-372.
(责任编辑:胡燕梅)
Effect of Four Plant Hormone on Callus Induction and Flavonoid Formation in Perilla Frutescens Leaves
GUO Yungui,CHENG Xiaomin,WANG Zeqiong,YU Ya,HAN Xiaohong
(Wuhan Bioengineering Institute,Wuhan 430415,Hubei,China)
In this study,with the leaves of Perilla frutescens were used as explant,effect of different concentrations of the hormone on inducing callus and formating flavonoid in Perilla frustescens leaves were studied by single factor and orthogonal test.It was found that the effect order of four kind of hormones to callus induction was 2,4-D>6-BA>NAA>KT and the order to flavonoid formation of callus was 2,4-D>6-BA>KT>NAA,the optimum medium for callus induction was 6-BA 2.0 mg/L+2,4-D 0.5 mg/L+KT 0.6 mg/L+NAA 0.8 mg/L by orthogonal design,under the optimum conditions,the highest indution rate was 83.3%after 25 days.Furthemore,the flavonoid formation of callus achieved at 3.925%,it is much higher than the natural Perilla frustescens leaves,the experimental results indicate the feasibility of flavonoid formation with tissue engineering.
Perilla frutescens;plant hormone;flavonoids;callus;orthogonal test
Q813.12
A
1673-0143(2015)05-0460-05
10.16389/j.cnki.cn42-1737/n.2015.05.016
2015-04-20
武汉市市属高校产学研项目(CXY201434)
郭云贵(1977—),女,副教授,硕士,研究方向:动植物细胞、组织培养技术。

