土壤中蔗髓缓冲包装材料高效降解菌的筛选与鉴定
吴亚丽,廖延智,吕艳娜
(广东轻工职业技术学院 食品与生物工程系,广东 广州 510300)
土壤中蔗髓缓冲包装材料高效降解菌的筛选与鉴定
吴亚丽,廖延智,吕艳娜
(广东轻工职业技术学院 食品与生物工程系,广东 广州 510300)
以蔗髓为原料、亚硫酸氢镁法制浆废液为胶黏剂制备的蔗髓缓冲包装材料为研究对象,从土壤中筛选出其高效降解菌株,并进行鉴定,确定菌株的稳定性。采用平板水解圈法和失重法进行菌株筛选,同时采用扫描电子显微镜(SEM)对蔗髓缓冲包装材料(BPCPMs)降解前后的形貌进行表征。利用培养特征、形态学、分子生物学方法进行菌株鉴定。筛选出效果稳定的蔗髓缓冲包装材料高效降解菌株ZS0918,经基因鉴定该菌株为杂色曲霉(Aspergillus versicolor)。SEM结果表明,在霉菌作用下,BPCPMs表面出现大小不一的孔洞,材料变薄,发生显著降解。
蔗髓缓冲包装材料;降解菌株;筛选;鉴定
蔗渣是甘蔗糖厂的副产物,是一种来源丰富、成本低廉和环境友好的可再生纤维资源[1]。蔗渣纤维具有比较优良的纤维形态和结构,是一种优良的造纸原料[2]。然而,蔗渣中含有的30%~40%的海绵状蔗髓影响了浆料质量[3],所以造纸企业要将蔗渣经过除髓处理后使用[4-5]。我国年产蔗糖600万吨,绝干蔗渣率约为13%,故每年都将产生约650万吨绝干蔗渣,250万吨蔗髓。这些数量可观的蔗髓主要被用作燃烧供热和发电,经济附加值较低,造成了资源的浪费。另一方面,蔗渣酸性亚硫酸盐制浆过程产生的蒸煮废液中含有大量的木素磺酸盐,是一种具有生物降解性能的天然高分子材料,它具有多种功能团,可作为木材用胶黏剂[6]。观察发现蔗髓干燥后具有天然的泡沫结构,这些泡沫体具有一定的弹性和恢复性,有缓冲作用。而以木素磺酸盐为主要成分的碱性亚硫酸盐蒸煮废液的浓缩物具有一定粘结性能,将其作为胶粘剂使用,与具有弹性的蔗髓混合,制备有一定强度和缓冲性能的新型可降解包装材料,蔗髓缓冲包装材料,如图1所示[7]。

图1 蔗髓缓冲包装材料(粉碎后)
可降解植物纤维材料的降解方式主要有土壤掩埋法和特定微生物或酶降解法。土壤有微生物的天然培养基之称,其中存在种类繁多、数量巨大的微生物,因而土埋试验是常用的生物降解性能表征手段。在土壤中,试样被各种微生物侵蚀,逐渐降解并产生的CO2、H2O等小分子产物脱离试样从而造成试样失重。由于人工干预较少,土壤掩埋法得到的结果较为贴近实际情况,但是其花费时间长,而且难以测定和定量描述降解情况,故不适用于实验室测定可降解塑料的降解性能。与此相反,特定微生物或酶降解法试验条件可以人工控制,能够清晰反应物质降解的过程和作用机理。
1 实验
1.1材料
1.1.1样品
材料:植物纤维废弃物蔗髓(其主要成分为纤维素30.1%、木质素21.1%、半纤维素32.6%)、加适当的胶黏剂制造的蔗髓缓冲包装材料(BPCPMs)。
土壤:曾经掩埋过蔗髓缓冲包装材料(BPCPMs)、并发生明显降解的土壤。
1.1.2培养基(w/V)
驯化菌种用培养基:1 000 mL-蔗髓缓冲包装材料(BPCPMs)10.0 g,K2HPO41.0 g,MgSO41.0 g,NaCl 1.0 g,(NH4)2SO42.0 g,CaCO32.0 g,FeSO4·7H2O 0.001 g,MnCl2·7H2O 0.001 g,ZnSO4·7H2O 0.001 g。
固体培养基为上述培养基中加入 1.5%的琼脂。
透明圈测定培养基(g/L)[8]:1 000 mL-蔗髓缓冲包装材料(BPCPMs)10.0 g,KH2PO42.0 g,NH4NO32.0 g,MgSO4.7H2O 0.2 g,酵母膏5.0 g,琼脂15.0 g,pH6.5。
鉴定及摇瓶培养用培养基:1 000 mL-蔗髓缓冲包装材料(BPCPMs)10.0 g,NaNO33.0 g,KH2PO41.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g。
固体培养基为上述培养基中加入1.5%的琼脂。
1.2试剂和仪器
真菌基因组柱式抽提试剂盒、微生物 PCR 裂解液购于上海生工生物工程有限公司;Tris、Na2EDTA·2H2O、琼脂糖等其它试剂均为国产分析纯。
ZHWY-100B型多振幅轨道摇床;YX-280A型手提式高压灭菌锅;DGX-9143B型电热鼓风干燥箱;DHP-9162型培养箱;XSP-2CA型电子显微镜;SHZ-D111型循环水式真空泵(抽滤机);MX-101SP1型干式研磨器;3K15型台式高速离心机;7200型可见分光光度计;PTC0200 PCR仪、044BR3749电泳仪、720BR紫外凝胶成像系统(均购自Bio-RAD Laboratories Inc.);扫描电子显微镜(SEM)。
1.3菌株的分离和筛选
取土样10.0 g,接入含90 mL驯化培养基的摇瓶中,以BPCPMs粉末作为唯一碳源,于30℃、150 r/min震荡培养5 d,用稀释涂布法涂布鉴定培养基平板(BPCPMs作为唯一碳源)。经过 2~5 d的培养,产生水解圈的菌株即BPCPMs降解菌株。将纯化后的BPCPMs降解菌株点种到透明圈培养基上,培养4 d后测定菌落及透明水解圈的大小。以水解圈的直径D和菌落直径d比值D/d大小作为筛选的标准[9]。将水解圈在平均值以上的菌株进行继代培养,筛选出D/d值稳定的菌株进行摇瓶降解率的测定。
通过电镜观察降解后蔗髓包装材料的内部结构,与降解前原始电镜图片进行比较,观察降解效果。
1.4BPCPMs降解率测定
采用失重法测定BPCPMs的降解率[10]。首先配制BPCPMs液体培养基,分装到 250 mL三角瓶中,每瓶50 mL,在121℃下进行30 min的高压灭菌处理,冷却后待用。在无菌操作条件下,将新鲜的菌种接到配制好的培养基中,置于30℃恒温摇床中,150 r/min振荡培养。经过15 d培养,发现材料明显减少。抽滤法将摇瓶中未降解的蔗髓分离出来,用蒸馏水洗净后,置于电热鼓风干燥箱中于60℃干燥至恒重,用分析天平称重降解后的质量,计算BPCPMs降解前后的失重率,计算式如式(1)所示。选出降解率最高的菌株,进行酶活曲线测定,并做菌种和基因鉴定。

1.5菌株鉴定
1.5.1形态及菌落观察
采用载片培养法进行镜下形态观察,肉眼观察菌株在真菌鉴定常规培养基上的培养特征[11]。
1.5.2ITS序列分析
提取真菌基因组DNA。取菌液若干,用真菌基因组柱式抽提试剂盒(上海生工生物工程有限公司)抽提基因组DNA。扩增18SrDNA和5.8S rDNA之间的保守序列,其中上游引物序列为TCCGTAGGTGAACCTGCGG,下游引物序列为TCCTCCGCTTATTGATATGC,由上海生工设计合成。20 μL反应体系:模板 DNA 1 μL,PCR Premix 1 μL,dNTP(每种0.2 mmol/L)2 μL,Buffer 1 μL,引物ITS1和ITS2各1 μL,ddH2O补足至20 μL。PCR反应条件:94℃ 3 min,94℃ 0.5 min,52℃ 30 s,72℃ 1 min,30个循环;72℃ 5 min。测序由上海生工生物工程有限公司完成。
将测序结果提交到GenBank数据库获得登录号,并利用Blast程序搜索同源序列,以Clustal X软件进行多重序列比对[12]。
2 结果与讨论
2.1BPCPMs高效降解菌株的筛选
研究表明,蔗髓中含有大量的半纤维素,是少数几种半纤维素含量极高的植物纤维材料之一[13-14]。根据原料成分分析结果显示,BPCPMs的主要待降解成份确为半纤维素。对于半纤维素的降解多采用霉菌。本文的降解对象为蔗髓缓冲包装材料,其主要成份为蔗髓,因此半纤维的降解会很大程度影响材料的降解率。能够降解半纤维素的菌株,大都对其它的纤维类的成分也有降解作用。因此主要筛选霉菌菌株。
通过驯化培养,平板分离纯化,获得18株霉菌菌株,命名为ZS0901- ZS0918。将这18株菌株接种于BPCPMs分离选择培养基上进行筛选,根据根据水解圈产生时间、清晰度和D/d值大小来初步筛选半纤维素降解菌。结果表明,有5株菌株水解圈产生迅速且清晰,D/d值较大,确定为初筛菌株,为ZS0914、ZS0915、ZS0916、ZS0917、ZS0918。将上述菌剂进行继代培养,连续传代7次后,菌株无论生长状态还是D/d值均未有退化现象。将这些菌株用于BPCPMs降解率的测定,选出降解率较高的,初步检测其酶活特性。

表1 各菌株水解圈
透明圈法适用范围较广,适用于多种菌类的分离,是一种较好的分离降解菌的初筛方法。王宜磊等[8]曾用该法分别对细菌、放线菌(主要为链霉菌)、霉菌(黑曲霉、青霉、黄曲霉)和大型真菌(彩绒革盖菌、毛栓菌、金针菇、平菇)进行了研究,结果均能形成明显的透明圈。透明圈大小不能完全代表降解能力,其原因可能是多方面的。如固体和液体培养条件不同,每一株菌的最佳降解时间和最适降解温度不可能是一致的,不同菌株具有不同的酶系,所以液体发酵复筛必不可少。
2.2BPCPMs降解率测定
目前对于植物纤维类材料的可生物降解性缺乏系统的研究,试验中借鉴塑料材料生物降解评价方法与标准进行BPCPMs的可降解性研究。将5株霉菌菌株通过液体摇瓶培养法处理15 d,采用失重法测定BPCPMs降解率,菌株ZS0918降解率最大,可达60%。

表2 各菌株降解率
将降解后的BPCPMs在60℃下干燥,然后用扫描电镜,观察包装材料降解情况。结果显示,菌株ZS0918降解效果最明显。如图2、图3所示。

图2 BPCPMs表面形态图片

图3 BPCPMs降解表面形态图片
图2是BPCPMs未进行降解处理的表面形态图,材料表面被胶黏剂所形成的膜覆盖,致密厚重。经过降解处理后,材料变薄,表面被侵蚀出现大小不一的孔洞。由图2和图3中可以推断出,BPCPMs降解是由表层到深层的过程。
比较而言,菌株ZS0918降解率较其它菌株高出很多,且电镜观察出降解程度也最明显。
2.3真菌鉴定
2.3.1形态及培养特征
菌落特征:毛绒状,菌落大而疏松,不透明,与培养基结合较牢固,边缘为白色,里边为青绿色,生长速度较快,生长时先长出底下的白色菌丝,过1~2天后再慢慢长青绿色菌丝。如图4所示。
采用载片培养法进行镜下形态观察:菌株ZS0918气生菌丝长直,透明,菌丝有些有隔膜,无分枝。如图5所示。菌丝体产生大量的分生孢子梗。分生孢子梗顶端膨大成为顶囊,垂直生于菌丝体上,膨大形成单排链状孢子,孢子表面光滑、圆形、呈绿色。

图4 菌落特征观察
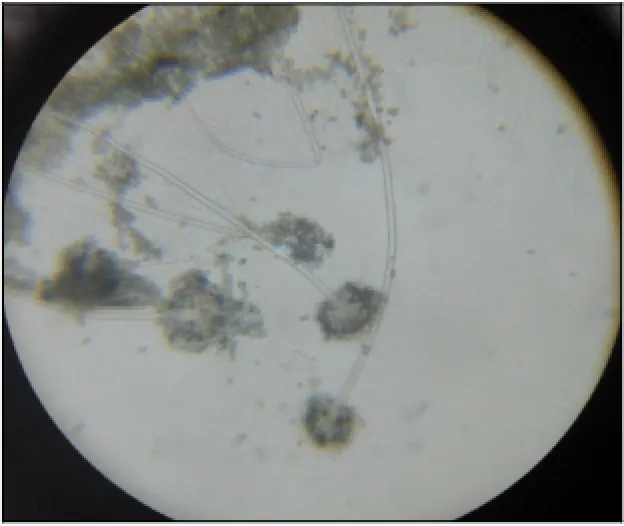
图5 镜检观察
2.3.2ITS序列分析
对菌株ZS0918的 ITS序列进行PCR扩增,产物经纯化后测序,得到500 bp左右长度的序列,在GenBank找到序列登录号;测序结果利用Blast程序与 GenBank中已登录的基因序列进行比对,获得已定名的与之相似的属、种的相关信息。同源性分析结果显示(如图6所示),菌株Aspergillus versicolor与目标菌株ITS序列同源性最高,相似度达到99%,说明它们的亲缘关系最为相近。

图6 基因序列分析
综合以上培养和形态特征 ,可以判断菌株ZS0918为杂色曲霉 Aspergillus candidus。
3 结论
目前国内外报道降解半纤维素和木聚糖的主要菌株中真菌主要是[15]:黑曲霉、黄曲霉,毛壳霉属,和木霉属。本实验筛选的菌株经形态学、分子生物学鉴定:菌株ZS0918为杂色曲霉(Aspergillus candidus),少见报道。且降解率目前可达60%。
[1] Sharma R K, Yadav K R, Maheshwari V L, et al. Bagasse preservation: A need for a biotechnological approach[J]. CriticialReviews in Biotechology, 2000, 20(4): 237-263.
[2] 吕艳娜, 何北海, 吴亚丽. 白炭黑增强蔗髓缓冲包装材料的性能研究[J]. 中国印刷与包装研究, 2014, 6(1): 60-65.
[3] Paul S K, Kasiviswanathan K S. Influence of pith on bagasse pulp, paper and black liquor properties[J]. IPPTA, 1998, 10(3): 1-8.
[4] Dixit A K, Thakur V V, Jain R K, et al. Efficient depithing of bagasse-A step towards sustained availability of raw material for paper industry to produce high quality paper[J]. IPPTA, 2010, 22(8): 163-166.
[5] Zhan Huai-yu. Supply and utilization of non-wood fibers and waste paper in China’s paper industry[J]. China Pulp and Paper, 2010, 29(8): 56-64.
[6] Nimz H H. Wood adhesives chemistry and technology[M]. New York: Marcel Dekker, 1986: 247-288.
[7] 吕艳娜. 利用制浆废料和废液制缓冲包装材料的研究[J]. 造纸科学与技术, 2006, 25(6): 124-127.
[8] 王宜磊, 邓振旭. 透明圈法快速筛选半纤维素分解菌[J]. 生物技术, 2000, 10(1): 37-39.
[9] Yuan Kang-pei, Lilian L P Vrijmoed, Feng Ming-guang. Survey of coastal mangrove fungi for xylanase production and optimized culture and assay conditions[J]. Acta Microbiogica Sinica, 2005, 45(1): 92-96.
[10] 王洪媛, 范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报, 2010, 50(7): 870-875.
[11] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[12] Thompson J D, Higgins D G, Gibson T J, et al. Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Research, 1994, 22(22): 4673-4680.
[13] 曹玉华, 王关斌, 崔淑芬, 等. 蔗髓水解生产木糖工艺研究[J]. 山东化工, 2012, 41(3): 28-29, 35.
[14] 陈军, 王元春. 蔗髓制备木糖、L-阿拉伯糖的工艺优化[J]. 食品科技, 2011, 36(11): 237-245.
[15] Karen Mine Harada, Keiko Tanaka, Yasuki Fukuda, et al. Paenibacillus sp. strain HCl xylanases responsible for degradation of rice bran hemicellulose[J]. Microbiological Research, 2008, 163(3): 293-298.
Screening and Identification of BPCPMs Degrading Microorganisms in Soil
WU Ya-li, LIAO Yan-zhi, LV Yan-na
(Dept. of Food, Guangdong Industry Technical College, Guangzhou 510300, China)
The screening BPCPMs degrading microorganisms was studied. The methods used to screen the effective strains included hydrolysis spot diameter measurement of hemicellulose plate, weight-loss method, and scanning electron microscope. Methods used to identify the strains included culture characteristics, morphological, physiological-biochemical characteristics and molecular biological methods. Isolated 5 moulds with higher degrading ability. To the best one of degradability, made hemicellulose degrading activity testing from liquid submerged-culture, up to 37.5 U/mL. By molecular biological methods, ZS0918 was Aspergillus versicolor.
bagasse pith cushioning materials; degrading microorganisms; screen; identification
Q935
A
1004-8405(2015)01-0071-06
2015-01-04
广东高校特色调味品工程技术开发中心建设项目(GCZX-B1103);广东轻工职业技术学院校级科研项目(KJ201322)。
吴亚丽(1981~),女,讲师,硕士;研究方向:生物技术、分析检测、微生物降解等。ericascut@126.com

