纤维素酶降解秸秆特性及其基因工程研究进展
张森翔 尹小燕 龚志伟 杨忠华 侯亚利 周卫
(武汉科技大学化学工程与技术学院,武汉 430081)
纤维素酶降解秸秆特性及其基因工程研究进展
张森翔 尹小燕 龚志伟 杨忠华 侯亚利 周卫
(武汉科技大学化学工程与技术学院,武汉430081)
能源短缺和环境污染问题是人们关注的焦点。秸秆类生物质以其资源丰富、无污染及可再生等特性使其在解决能源危机方面具有极大应用前景。对秸秆类生物质通过纤维素酶的水解转化为可发酵性的糖,再结合发酵技术可进一步生产乙醇、氢气等能源物质,是一条成熟的能源化技术路线。其关键是秸秆生物质的预处理与高效的糖苷水解酶获得。将从对秸秆类生物质的预处理、纤维素酶的作用机理研究和纤维素酶基因工程3个方面对当前的研究进展进行综述与分析。这对于促进秸秆类生物质能源化应用具有指导意义。
纤维素;纤维素酶;秸秆生物质;纤维素水解效率;纤维素酶基因
秸秆类生物质是全球第四大能源物质。我国每年生产的玉米秸秆生物质1.5亿t,利用纤维素转化技术可生产1 500万t生物燃料及1 800万t加工产品,相当于4 500万t石油产生的价值[1]。当前我国大量秸秆生物质未充分利用,许多在田地直接焚烧。这一方面使资源白白浪费;另一方面产生严重的大气污染,如每年春夏之交的中原小麦秸秆田间燃烧给我国许多省造成重大的空气污染。如何充分利用秸秆生物质资源,世界各国相继提出了发展生物质资源的国家战略计划[2],纤维素酶能将秸秆类生物质转化为可发酵性糖,再结合发酵技术直接生产生物燃料,其具有技术成熟、效率高、环境友好等优点,成为了新能源研究领域的主要方向之一。高效、廉价、大量的纤维素酶等糖苷水解酶是其关键。本文将从对秸秆类生物质的预处理、纤维素酶的作用机理研究和纤维素酶基因工程技术三个方面对纤维素酶的研究进展进行综述分析,以促进我国秸秆类生物质的利用技术。
1 秸秆的结构特征及其预处理方法
秸秆类生物质纤维素的结构特性直接影响纤维素酶对其的降解效率,其表面粗糙度[3]、结晶度、聚合度、木质素的组成和分布、半纤维素成分、粒度、孔隙率[4]、疏水性[5]和水吸附值[6]等都会阻碍纤维素酶的水解,故对秸秆本身的纤维素结构的研究成为纤维素酶降解纤维素基础研究的一个重要方向。
纤维素是一种由β-1,4糖苷键联接的n个D-吡喃型葡萄糖链形成的大分子多糖,通过氢键的缔合作用,形成纤维束,按分子密度大小分为结晶区和无定形区,其中天然纤维素中主要为结晶纤维素。纤维素一般均包埋或嵌合在半纤维素和木质素里,形成网状结构[7]。通过预处理,破坏木质素对纤维素的包裹及纤维素的晶体结构,使更多的纤维素裸露出来,即去除大量木质素,并最小程度的进行多糖结构修饰,保留纤维素的天然超微结构[8],达到提高工业中纤维素和半纤维素利用的目的。
甘蔗渣、玉米秸秆、小麦秸秆及稻草粉等秸秆类生物质进行预处理的方法主要有物理法(机械粉碎、辐射)、物理化学法(蒸汽爆破、AFEX、CO2爆破、湿氧处理和臭氧分解)、化学法(酸水解、碱水解、离子液体处理和有机溶剂法)[9]。主要的成果归纳于表1中。其中物理法对环境的污染小,但是其过程耗能大,成本高,不适合大规模工业生产;化学法极易产生发酵抑制物,且部分酸碱浓度过大会腐蚀设备,污染环境;而物理化学法对其反应设备或者反应试剂要求高,成本昂贵。
每年夏季,长江以南的江河湖泊生长着大量水葫芦,引起大面积生物危害。对其综合利用,可达到变废为宝的目的。常用的预处理方法,其能量损耗及产生三废处理的成本压力是制约其工业化应用的主要因素,深入研究其结构及化学特性,寻找一种经济高效的预处理方法对秸秆的利用具有重要意义。笔者所在实验室对木质纤维素成分达50%左右的水葫芦进行预处理研究,结合物理法和化学法处理,利用纤维素酶降解后糖量和糖类作为评价指标,找到进行工业高效利用的预处理方法。

表1 甘蔗秸秆、玉米秸秆、小麦秸秆、稻草秸秆的预处理研究结果
2 纤维素酶作用机理研究
纤维素酶是由多种水解酶组成的复合酶,也称纤维素酶系,包含:内切葡聚糖酶(Endoglucanase,EG;EC 3.2.1.4),外切葡聚糖酶(Exoglucanase,CBH;EC 3.2.1.91,EC 3.2.1.176),β-葡糖苷酶(β-glucosidase,BG;EC 3.2.1.21)[23]。通常认为纤维素酶降解纤维素的原理为协同作用,主要包括以下3个步骤:(1)CBH作用于纤维素线状分子末端,水解1,4-β-D糖苷键,每次切下1个纤维二糖分子;(2)EG作用于纤维素内部的非结晶区,随机水解β-1,4糖苷键,将长链纤维素分子截短,产生大量含非还原性末端的小分子纤维素AAA9家族(原GH61家族)的氧化降解酶类,具有微弱的内切葡聚糖酶活性,起初一直被作为糖苷水解酶,后经研究发现其三维结构与一般的EG不同,其可以通过氧化反应使得纤维素被部分氧化降解,并在一定程度上破坏其结晶结构,从而使纤维素更容易被纤维素酶降解[24];(3)BG将纤维二糖和寡糖水解成葡萄糖分子[25]。
Cao等[26]通过利用纤维素酶降解不同类型的纸浆发现,纤维素酶解必须首先对纤维素的晶体结构进行破坏,并推断出纤维素结晶区的解聚与解链是纤维素酶解过程的限速步骤,这导致CBH成为目前的研究热点。CBH是持续性催化酶类,酶分子能相对线性底物进行单方向运动,在结合底物后至解离前可执行上千次持续性催化。其具有2个独立的结构域,即1个催化功能结构域(Catalytic domain,CD)和1个纤维素结合功能结构域(Cellulose binding domain,CBD,或称Carbohydrate binding module, CBM)。其中CD代表CBH的催化活性及对特定水溶性底物的特异性,其活性中心一般为孔道或者是深陷的凹槽,不同于一般酶分子的开放裂痕型结构,使其具有持续性酶解能力,其催化糖基转移的机制与溶菌酶相似,是酸/碱催化的双置换机制,在异头碳原子位通过构型的保留或构型的转化完成催化反应,其中两个保守的羧基氨基酸分别作为质子供体和亲核试剂[8,27,28]。CBM具有维持酶分子的构象稳定性,调节酶对可溶性、非可溶性底物专一性活力的作用;能疏解结晶纤维素结构的能力,维持纤维素酶的持续性降解,并利用吸附作用增大酶分子与底物的结合,辅助外切葡聚糖酶对天然纤维素底物的接近、定位与干扰等作用[28]。CBH借助CBM的吸附作用,结合并水解结晶纤维素的疏水表面,识别并解离纤维素链游离的还原末端,游离分子链还原端进入CD 催化孔道,形成复合物。每次水解产生一个纤维二糖,然后发生初步线穿和去结晶化运动,水解并排出纤维二糖,随后进入下一催化循环过程进[27](图1)。

图1 CBH线穿-释放催化循环
Ciolacu等[32]对CBD进行吸附和解吸试验发现,酶解过程中,纤维素酶需要通过CBD与结晶纤维素Ⅰ型结合,使分子间或分子内的氢键断裂,之后酶解反应开始进行,其吸附动力学受表面积和孔隙率影响,解吸过程受无定形纤维素的疏水作用和pH及温度的影响。Ding[8]、Costaouec[30]和Lou[31]的研究发现,木质素会对CBD产生非必要性吸附,浪费部分纤维素酶水解能力,而CBM对于纤维素酶降解可溶性的纤维素没有辅助作用,但是对于结晶纤维素的降解促进作用表现很明显。
虽然大量的研究成果使人们对纤维素酶的作用机制有了更深入的了解,但是纤维素酶在底物上进行持续性的水解纤维素的催化动力来源仍不明确,如CBD打断分子链间和分子内氢键的动力机制。完成对CBH这种典型的持续性酶的降解机制的原理,将为人们研究其他类似持续性酶反应过程有一个指导作用,并对利用分子改造技术提高酶分子转化效率奠定正确的理论基础。
3 纤维素酶基因工程研究
纤维素酶工业化应用中有两大难题,一是生物质细胞壁的抗降解屏障极大地制约了木质纤维素的转化效率;二是现有的纤维素酶对于生物质中纤维素的糖转化能力较低[8]。预处理技术能有效的解决第一个难题,而第二个难题常见以下2种方法,一种是筛选高效纤维素酶菌株,这是最常见的方法,如笔者所在实验室筛选的一株高效的产纤维素酶菌株Trichoderma viride WUST 01[33];另一种是采用基因工程技术构建所需产酶菌株。
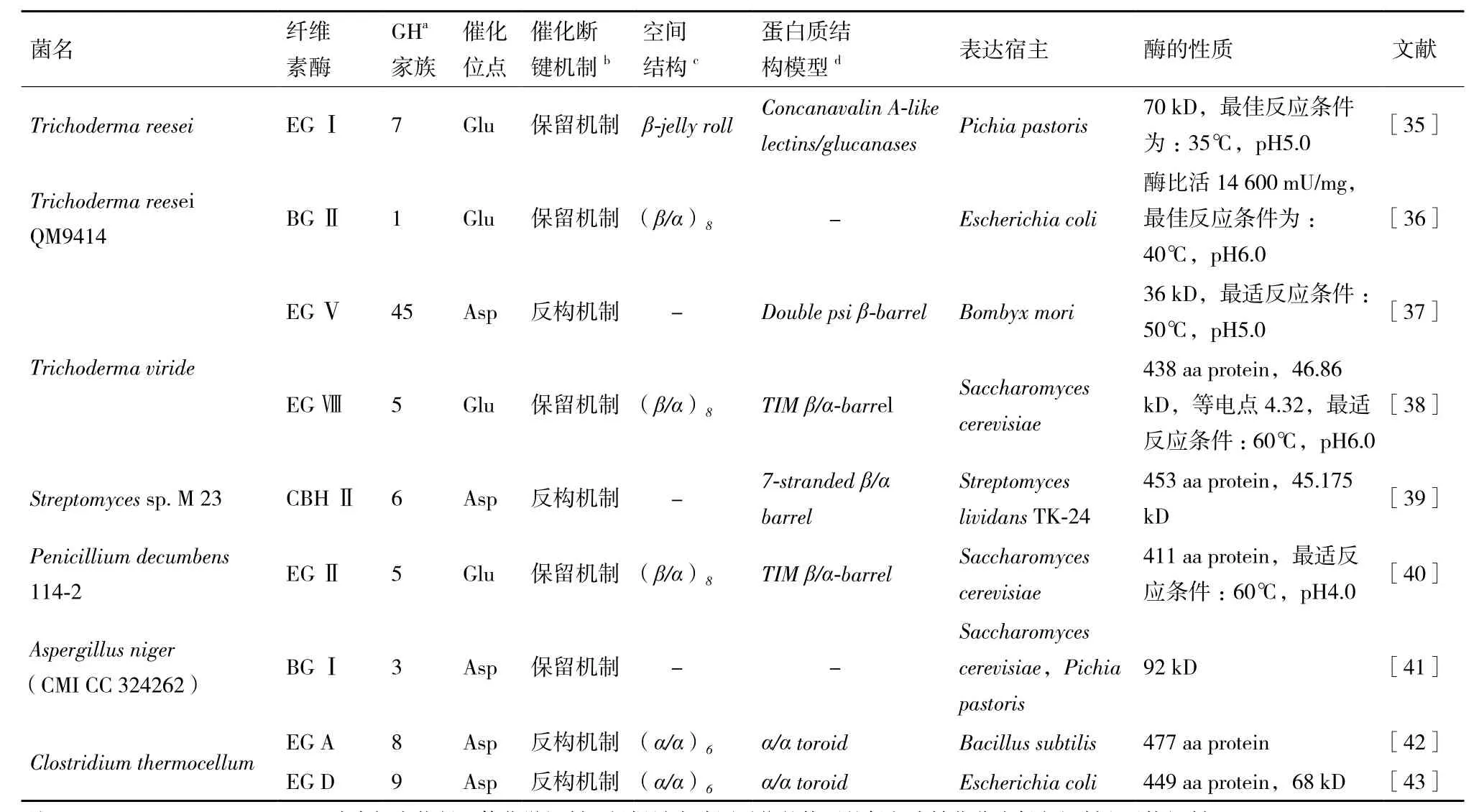
注:a:Glycoside hydrolases;b:酶水解底物得立体化学机制,根据异头碳原子位的构型的保留或转化分为保留机制和反构机制;c:3D structure status;d:蛋白质结构分类数据库;-:unclassified
昆虫、软体动物、原生动物、细菌、放线菌、真菌等都可以产生纤维素酶。通常真菌纤维素酶的产量大,组成复杂,大部分为胞外酶,分离纯化操作要求低。其中,最有代表性的为里氏木霉。所产的纤维素酶是完整的纤维素酶复合体系,含有内切葡聚糖酶Ⅰ、Ⅱ、Ⅲ,外切葡聚糖酶Ⅰ、Ⅱ,β-葡萄糖苷酶Ⅰ、Ⅱ[25]。国际著名的纤维素酶制剂生产公司Novozyme 和Genencor多以里氏木霉为主要产酶菌株[34]。但是不同霉菌的纤维素酶产量不同,活性也不相同,如斜卧青霉易分泌较多的β-葡萄糖苷酶,里氏木霉分泌较多的外切葡聚糖酶,酶组分比例并不合理,酶活性较低。而细菌培养基成分简单,生长周期短,表达蛋白的转化及分离纯化技术易于操作,其中大肠杆菌最具有代表性,将真菌中的纤维素酶在细菌中的大量表达是目前纤维素酶基因工程的一个研究方向。此外,酵母菌作为目前新型生物能源工业特别是生物乙醇生产中主要菌株,将纤维素酶基因重组到酵母菌中,可以实现从纤维素到葡萄糖再到酒精的完整发酵过程,极大地减少中间步骤,提高转化效率,成为了目前纤维素酶基因工程的另一个研究方向。表2是对当前纤维素酶基因工程的主要研究情况进行的综合。
半纤维素酶基因克隆研究起步较晚,其中xylanase作为半纤维素的主要成分——木聚糖降解的关键水解酶研究较多。早期研究认为xylanase具有的特殊密码子,N末端糖基化及要形成特定的二硫键,不易在大肠杆菌中功能性表达,后来探究发现糖基化对木聚糖酶酶活性可能影响不大,其后陆续有内切木聚糖酶和β-木聚糖酶于大肠杆菌中表达[44,45],如Jun等[46]利用噬菌体 T7成功将Trichoderma reesei Rut C-30β-木聚糖酶基因Xyn2(570 bp)在E.coli中表达,所产酶对于桦木木聚糖有60%的水解率,而对麦麸的水解率低于40%。Le等[47]则利用OmsY蛋白成功将一种取自Thermomyces lanuginosus的热稳定性高的xylanase于E.coli中表达,其融合蛋白具有可溶性,不需要IPTG诱导表达,在pH6.0和65℃获得最高活性。而在酵母菌中,Okada等[48]将两种Trichoderma reesei QM9414的xyn1和xyn2在Schizosaccharomyces pombe中表达,分别达到25 mg/mL和170 mg/mL。此外,将木聚糖酶于高产纤维素酶的丝状真菌表达,也是目前一种提高真菌酶解能力的方法,Rose等[49]通过对甘油醛-6-磷酸脱氢酶的控制,将Trichoderma reesei QM6a的xyn2和egⅠ于Aspergillus niger中表达,且两者在pH5.0和50℃下保持3 h后,仍有80%以上的酶活力。Beak等[50]分别用能表达T. aurantiacus EGI,T. reesei CBHII 和Aspergillus aculeatus BGLI 的3种酵母菌,按最佳酶配比EGI∶CBHII∶BGLI=6∶2∶1混合发酵产乙醇,达到2.1 g/L乙醇产量,不过其中缺少了半纤维酶,对生物质的利用并不完美。一般而言,半纤维素酶和纤维素酶的反应温度在45-60℃之间,只是pH要求不同,寻找pH相近且酶活较高的纤维素酶和木聚糖酶,配置合适的酶成分比例,于酵母工程菌中联合表达,提高对生物质转化的利用率,可能是一种较好的研究方向。
随着基因工程技术发展,其生物信息学和基因组学数据的完善,利用蛋白质家族或结构生物信息学对纤维素酶进行理性设计与进化改造,相较于过去基于DNA序列改组,具有更高的效率,同时可以有效地避免重组时的结构坍塌,利于快速筛选出稳定性或其他性能得到提高或改善的突变体。其中SCHEMA、ProSAR、ASR及ROSETTA是较为常见的蛋白质空间结构优化的理性设计算法[23],其中SCHMA法已成功的用于纤维素酶CBHⅠ和CBHⅡ,并分别获得Humicola insolens、Chaetomium thermophilum、T. aurantiacus、H. jecorina、Acremonium thermophilum及T. emersonii的高热稳定性变异菌株[51,52]。
4 结语
能源和环境的压力迫使我国急需将丰富的秸秆类生物质转化技术产业化,纤维素酶是目前已知对于该类转化过程中最好的处理方式之一。以纤维素转化过程中的两大问题为主,前者以预处理技术为手段,定性定量分析秸秆生物质结构对酶水解转化率的影响,细化出酶水解的每一步带来的生物质结构变化,同时要注意对反应后的废物下游技术的研究。例如,热水解后产生的大量废水,酸碱处理后水中的有毒物质的处理,后者通过对比不同秸秆中的结构成分特点,设计能对其产生最大水解效率的纤维素酶,同时优化选择出具有更高耐受性的工业生产的菌株,对纤维素酶工业应用进行的深入研究必将促进我国能源生物技术的发展与应用。
[1]娄玥芸, 张惠芳. 秸秆生物质能源的应用现状与前景[J]. 化学与生物工程, 2010, 27(9):73-76.
[2]谢敬. 纤维素酶的研究进展[J]. 化学工业与工程技术, 2010,31(5):46-48.
[3]王禄山, 高培基, 时东霞,张玉忠. 天然棉纤维表面超微结构及其变化的定量分析—用原子力显微镜测定超微结构的表面粗造度[J]. 山东大学学报:理学版, 2006, 41(6):132-139.
[4]Alvira P, Tomás-Pejó E,Ballesteros M, et al. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:a review[J]. Bioresource Technol, 2010,101(13):4851-4861.
[5]Heiss-Blanquet S, Zheng D, Ferreira NL, et al. Effect of pretreatment and enzymatic hydrolysis of wheat straw on cell wall composition,hydrophobicity and cellulase adsorption[J]. Bioresource Technol,2011, 102(10):5938-5946.
[6]Ogeda TL, Silva LB, Fidale LC, et al. Effect of cellulose physicalcharacteristics, espically the water sorption value, on the effciency of its hydrolysis catalyzed by free or immobilized cellulase[J]. J Biotechnol, 2012, 157(1):246-252.
[7]Meng XZ, Ragauskas AJ. Recent advances in understanding the role of cellulose accessibility in enzymatic hydrolysis of lignocellulosic substrates[J]. Curr Opin Biotech, 2014, 27:150-158.
[8]Ding SY, Liu YS, Zeng Y, et al. How does plant cell wall nanoscale architecture correlate with enzymatic digestibility?[J]. Science,2012, 338(6110):1055-1060.
[9]Kumar P, Barrett DM, Delwiche MJ, et al. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production[J]. Ind Eng Chem Res, 2009, 48(8):3713-3729.
[10]Oliveira FMV, Pinheiro IO, Souto-Maior AM, et al. Industrial-scale steam explosion pretreatment of sugarcane straw for enzymatic hydrolysis of cellulose for production of second generation ethanol and value-added products[J]. Bioresource Technol, 2013, 130:168-173.
[11]Sindhu R, Kuttiraja M, Preeti VE, et al. A novel surfactant-assisted ultrasound pretreatment of sugarcane tops for improved enzymatic release of sugars[J]. Bioresource Technol, 2013, 135:67-72.
[12]Binod P, Satyanagalakshmi K, Sindhu R, et al. Short duration microwave assisted pretreatment enhances the enzymatic saccharification and fermentable sugar yield from sugarcane bagasse[J]. Renew Energ, 2012, 37(1):109-116.
[13]Avci A, Saha BC, Dien BS, et al. Response surface optimization of corn stover retreatment using dilute phosphoric acid for enzymatic hydrolysis and ethanol production[J]. Bioresource Technol,2013, 130:603-612.
[14]Saha BC, Yoshida T, Cotta MA, et al. Hydrothermal pretreatment and enzymatic saccharification of corn stover for efficient ethanol production[J]. Ind Crop Prod, 2012, 44:367-342.
[15]Li HQ, Xu J. Optimization of microwave-assisted calcium chloride pretreatment of corn stover[J]. Bioresource Technol, 2013,127:112-118.
[16]You ZY, Wei TY, Cheng JJ. Improving anaerobic codigestion of corn stover using sodium hydroxide pretreatment[J]. Energ Fuel,2013, 28:549-554.
[17]Rajan K, Carrier DJ. Effect of dilute acid pretreatment conditions and washing on the production of inhibitors and on recovery of sugars during wheat straw enzymatic hydrolysis[J]. Biomass Bioenerg, 2014, 62:222-227.
[18]Wu JN, Upret Si, Ein-Mozaffari F. Ozone pretreatment of wheat straw for enhanced biohydrogen production[J]. Int J Hydrogen Energ, 2013, 38(25):10270-10276.
[19]Copur Y, Tozluoglu A, Ozyurek O. Sodium borohydrate(NaBH4)pretreatment for efficient enzymatic saccharification of wheat straw[J]. Bioresource Technol, 2012, 107:258-266.
[20]Kim I, Lee B, Park JY, et al. Effect of nitric acid on pretreatment and fermentation for enhancing ethanol production of rice straw[J]. Carbohyd Polym, 2014, 99:563-567.
[21]Amiri H, Karimi K, Zilouei H. Organosolv pretreatment of rice straw for efficient acetone, butanol, and ethanol production[J]. Bioresource Technol, 2014, 152:450-456.
[22]Poornejad N, Karimi K, Behzad T. Improvement of saccharification and ethanol production from rice straw by NMMO and[BMIM][OAc]pretreatments[J]. Ind Crop Prod, 2013, 41:408-413.
[23]张小梅, 李单单, 王禄山, 等. 纤维素酶家族及其催化结构域分子改造的新进展[J]. 生物工程学报, 2013, 29(4):422-433.
[24]冯飞, 王绍文, 王娟, 等. 里氏木霉GH61 家族糖苷酶的高效表达及酶学特性研究[J]. 微生物学报, 2014, 41(7):1261-1269.
[25]覃玲灵, 何钢, 陈介南. 里氏木霉及其纤维素酶高产菌株的研究进展[J]. 生物技术通报, 2011(5):43-49.
[26]Cao Y, Tan H. Study on crystal structures of enzyme-hydrolyzed cellulosic materials by X-ray diffaction[J]. Enzyme Microb Tech, 2005, 36(2-3):314-317.
[27]黄彬, 耿存亮, 潘龙强, 等. 持续性催化酶类机理研究及其分子动力学模拟[J]. 中国科学:生命科学, 2012, 42(8):603-612.
[28]阎伯旭, 齐飞, 张颖舒, 等. 纤维素酶分子结构和功能研究进展[J]. 生物化学与生物物理进展, 1999, 26(3):233-237.
[29]欧阳嘉, 李鑫, 王向明, 等. 纤维素结合域的研究进展[J].生物加工过程, 2008, 6(2):10-16.
[30] Costaouec TL, Pakarinen A, Varnai A, et al. The role of carbohydrate binding module(CBM)at high substrate consistency:Comparison of Trichoderma reesei and Thermoascus aurantiacus Cel7A(CBHI)and Cel5A(EGII)[J]. Bioresource Technol, 2013,143:196-203.
[31] Lou HM, Wang MX, Lai HR, et al. Reducing non-productiveadsorption of cellulase and enhancing enzymatic hydrolysis of lignocelluloses by noncovalent modification of lignin with lignosulfonate [J]. Bioresource Technol, 2013, 146:478-484.
[32] Ciolacu D, Chiriac AI, Pastor FIJ, et al. The influence of supramolecular structure of cellulose allomorphs on the interactions with cellulose-binding domain, CBD3b from Paenibacillus barcinonensis[J]. Bioresource Technol, 2014, 157:14-21.
[33] 杨忠华, 赵燕, 陈庚华, 等. 一种可分泌纤维素酶的菌株及其纤维素酶提取方法与应用:中国102807958[P]. 2012-12-15.
[34] 赵燕, 陈庚华, 周卫, 等. 纤维素酶及其基因研究[J]. 生物技术通报, 2013(2):35-40.
[35] Akcapinar GB, Gul O, Sezerman UO. From in silico to in vitro:Modelling and production of Trichoderma reesei endoglucanase 1 and its mutant in Pichia pastoris[J]. J Biotechnol, 2012, 159(1-2):61-68.
[36] Liu M, Yu HW. Cocktail production of an endo-β-xylanase and a β-glucosidase from Trichoderma reesei QM 9414 in Escherichia coli[J]. Biochem Eng J, 2012, 68:1-6.
[37] Li XH, Wang MX, Zhang P, et al. Heterologous expression characteristics of Trichoderma viride endoglucanase V in the silkworm, Bombyx mori L.[J]. Appl Biochem Biotechnol, 2011,165:728-736.
[38] Park CS, Kawaguchi T, Sumitani J, et al. Cloning and sequencing of an exoglucanase gene from Streptomyces sp. M 23, and its expression in Streptomyces lividans TK-24[J]. J Biosci Bioeng,2005, 99(4):434-436.
[39] Wei XM, Qin YQ, Qu YB. Molecular cloning and characterization of two major endoglucanases from Penicillium decumbens[J]. J Microbiol Biotechnol, 2010, 20(2):265-270.
[40] Dan S, Marton I, Dekel M, et al. Cloning, expression, characterization, and nucleophile identification of family 3, Aspergillus niger beta-glucosidase[J]. J Biol Chem, 2000, 275(7):4973-4980.
[41] Yao Q, Sun T, Chen G, et al. Heterologous expression and sitedirected mutagenesis of endoglucanase CelA from Clostridium thermocellum[J]. Biotechnol Lett, 2007, 29(8):1243-1247.
[42] Tokatlidis K, Dhurjati P, Millet J, et al. High activity of inclusion bodies formed in Escherichia coli overproducing Clostridium thermocellum endoglucanase D[J]. Febs Lett, 1991, 282(1):205-208.
[43] Lin M, Yu H. Co-production of a whole cellulase system in Escherichia coli[J]. Biochem Eng J, 2012, 69:204-210.
[44] Juturu V, Wu JC. Microbial xylanases:Engineering, production and industrial applications[J]. Biotechnol Adv, 2012, 30:1219-1230.
[45] 刘杰凤, 马超, 王春, 董宏坡. 海洋微生物纤维素酶及半纤维素酶基因克隆于表达研究进展[J]. 生物技术通报, 2012(6):36-42.
[46] Jun H, Bing Y, Keying Z, et al. Expression of a Trichoderma reesei b-xylanase gene in Escherichia coli and activity of the enzyme on fiber-bound substrates[J]. Protein Expres Purif, 2009, 9:1-6.
[47] Le Y, Wang H. High-level soluble expression of a thermostable xylanase from thermophilic fungus Thermomyces lanuginosus in Escherichia coli via fusion with OsmY protein[J]. Protein Expres Purif, 2014, 99:1-5.
[48] Okada H, Wakamatsu M, Takano Y, et al. Expression of two Trichoderma reesei xylanases in the fission yeast Schizosaccharomyces pombe[J]. J Biosci Bioeng, 1999, 88(5):563-566.
[49] Rose SH, van Zyl WH. Constitutive expression of the Trichoderma reesei β-1, 4-xylanase gene(xyn2)and the β-1, 4-endoglucanase gene(egI)in Aspergillus niger in molasses and defined glucose media[J]. Appl Microbiol Biot, 2002, 58:461-468.
[50] Baek JH, Kim S, Lee K, et al. Cellulosic ethanol production by combination of cellulase-displaying yeast cells[J]. Enzyme Microb Tech, 2012, 51:366-372.
[51] Heinzelman P, Snow CD, Smith MA, et al. SCHEMA recombination of a fungal cellulase uncovers a single mutation that contributes markedly to stability[J]. J Biol Chem, 2009, 284(39):26229-26233.
[52] Heinzelman P, Komor R, Kanaan A, et al. Efficient screening of fungal cellobiohydrolase class I enzymes for thermostabilizing sequence blocks by SCHEMA structure-guided recombination[J]. Protein Eng Des Sel, 2010, 2(11):871-880.
(责任编辑 狄艳红)
Advances in Research of Straw Degradation with Cellulase and Its Genetic Engineering
Zhang Senxiang Yin Xiaoyan Gong Zhiwei Yang Zhonghua Hou Yali Zhou Wei
(School of Chemical Engineering and Technology,Wuhan University of Science and Technology,Wuhan430081)
Energy shortage and environmental pollution have become the public focusing issue. Straw biomass with its rich resources,non-polluting and renewable feature, has great application prospect in solving the energy crisis. Converting straw biomass to fermentable sugars by hydrolysis with cellulase and combing with fermentation may produce ethanol, hydrogen and other materials of energy, which has been a mature technology route. The crucial steps of utilizingstraw biomass are the pretreatment of straw biomass and efficient obtaining of glycoside hydrolases. We summarize and analyze the current research from 3 aspects: the structural characteristics of straw and its biological pretreatment;the mechanism of cellulase in hydrolysis of straw biomass; and the gene engineering for cellulase. It has a guiding significance in the promotion of applying straw biomass for energy.
cellulose;cellulase;straw biomass;hydrolysis efficiency of cellulose;cellulase gene
10.13560/j.cnki.biotech.bull.1985.2015.05.004
2014-08-09
国家自然科学基金项目(21376184),湖北省教育厅科学研究项目(D20121108)
张森翔,男,硕士研究生,研究方向:纤维素酶应用;E-mail:zhangsenxiang421@163.com
杨忠华,博士,教授,研究方向:生物化工;E-mail:yangzh@wust.edu.cn

