适于双向电泳分析的酵母胞外蛋白提取方法
杜维朴永哲黄玮谷月赵长新
(1.大连工业大学生物工程学院,大连 116034;2.大连民族学院,大连 116600)
适于双向电泳分析的酵母胞外蛋白提取方法
杜维1朴永哲2黄玮1谷月1赵长新1
(1.大连工业大学生物工程学院,大连116034;2.大连民族学院,大连116600)
采用了无蛋白酵母培养基培养FFC2144酵母细胞,用硫铵沉淀法、超滤法、冻干酚提等方法提取酵母胞外蛋白,计算3种方法的提取率并分别用双向电泳的方法对提取到的蛋白样品进行分离,同时运用质谱鉴定分离后蛋白。其中冻干-平衡酚法提取后得到114个蛋白点,提取率为73.67%,图谱识别的蛋白点最多图谱最清晰,是研究分泌类蛋白质组学理想的分离方法。
酿酒酵母;胞外蛋白;双向电泳;提取方法
酵母作为首先完成基因组测序的低等真核生物因其遗传背景清楚、无毒且易培养等优点无论是用作基因工程的表达载体,还是在工业生产中都有着广泛的应用[1]。胞外蛋白是存在于培养介质中的酵母分泌蛋白质,起初在应用酵母进行酿造的过程中被人们所发现。最初的研究认为蛋白质作为一种能量物质是不会被微生物排出细胞外[2],后续的研究表明在培养介质中确实存在蛋白质等活性物质,胞外蛋白逐渐被人们所重视并加以研究。杨静等[3]对已公布的酿酒酵母6 700个蛋白质序列做N端分析后发现163个蛋白有潜在的信号肽酶切位点,是通过Sec-途径分泌的胞外蛋白。胞外蛋白在细胞生长、信号传导、细胞增殖、分化和调控方面起着重要的作用[4],胞外蛋白是酵母蛋白质组学中不可缺少的一部分。此外,在酿造工业中发酵液的蛋白质成分直接决定着产品的品质与不同批次产品之间的稳定性,即使在相同条件下酿酒酵母的胞外分泌产物的组成也不尽相同,所以对酵母胞外蛋白的研究在生产上也具有一定的实际意义。同时酵母已经成为基因工程表达的载体,分泌蛋白的研究对其高效表达分泌外源蛋白的效率有着指导意义。
胞外蛋白与胞内蛋白相比具有含量低、随机性大、样品易被修饰(糖基化、磷酸化)等易造成提取困难的特点[5]。根据上述特点胞外蛋白的提取包括浓缩和除杂这两个过程,且操作尽量在低温短时间内完成。双向电泳作为一种高通量的手段在蛋白质组学的研究中有着显著优势[6],同时又可以与蛋白质印迹、质谱等下游技术相结合对分离的蛋白质进行下一步分析。蛋白质组的双向电泳图谱的质量与所提蛋白的纯度密切相关,如何权衡提取方法与时间的关系成为得到高质量图谱的关键。本试验通过对3种酵母胞外蛋白提取方法的比较优化确立最适宜双向电泳的胞外蛋白提取条件,并选取5个点进行鉴定,旨为酵母胞外蛋白质组学的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种 Saccharomyces cerevisiae FFC 2144(大连工业大学菌种保藏中心)。
1.1.2 仪器 高速冷冻离心机H2050R-1(湘仪);双向电泳槽DYCZ-26B(北京六一);冷冻干燥机VFD2000(北京博医康);恒温摇床ZWYR-2101C(智城);三维摇床SK-D3309-Pro(大龙);超滤仪(Congent);台式四极杆-轨道阱高分辨质谱仪(Thermo Scientific)。
1.1.3 药品 载体两性电解质pH4-6.5 载体两性电解质 pH3-10(General Electric Company);过硫酸铵、丙酮、苯酚、尿素(科密欧,优级纯),甲醇(科密欧,色谱纯);ASB-14 硫脲、CHAPS、色氨酸、组氨酸、YNB、精氨酸、丙烯酰胺、SDS(阿拉丁)。
1.1.4 培养基 采用改良无蛋白质的全合成YNB培养基[7],葡萄糖2%,(NH4)2SO41%,YNB 0.67%,DL-苹果酸0.6%,酒石酸0.2%,色氨酸0.5‰,组氨酸0.5‰,精氨酸0.5‰。
1.2 方法
1.2.1 菌体生长曲线的绘制与培养基蛋白含量的测定 将活化后的酵母细胞接种到YNB培养基中振荡培养(接种后的细胞量为100 CFU/mL,28℃,160 r/min)。每24 h取样稀释涂平板测定发酵液菌体浓度并用Bradford法[8]测定蛋白质含量,根据测定结果确定胞外蛋白的最佳提取时间。
1.2.2 硫铵沉淀法提取蛋白 向离心过膜(0.22 μm)后的发酵液缓慢加入饱和(NH4)2SO4溶液,使发酵液中(NH4)2SO4终浓度达到80%。加入过程中保持冰水浴并缓慢搅拌,同时防止气泡生成。沉淀过程完成后将溶液在4℃下过夜,次日在10 000×g条件下离心10 min。采用截留分子量为5 kD的透析袋对沉淀进行透析除盐6 h,每2 h更换一次透析液。然后将透析后的蛋白质溶液冷冻干燥制成干粉(包括透析后仍不能溶解的沉淀),-80℃保存。
1.2.3 超滤法提取蛋白 采用截留分子量为5 kD的超滤膜对过膜后的发酵液进行冰水浴浓缩至上样浓度(100 μg/80 μL)后直接上样。
1.2.4 冻干/平衡酚-丙酮沉淀法提取蛋白 将过膜后的发酵液直接冻干浓缩至80 mL,加入等体积的Tris-平衡酚(1 mol/L,pH8.0)冰浴搅拌30 min后离心弃上清,保留酚相及中间层。加入3倍体积的浓度为100 mmol/L的乙酸铵-甲醇后与-20℃过夜,次日离心后的沉淀先用含有0.1%(W/V)DTT的冷丙酮清洗,再用冷丙酮清洗2次,每次10 min。清洗后的蛋白进行真空干燥除去残余丙酮,于-80℃保存。
1.2.5 蛋白样品的溶解及定量 取保存的蛋白质干粉溶于适量的裂解液中(7 mol/L尿素,2 mol/L硫脲,2% CHAPS,2% ASB-14,20 μL pH3-10两性电解质,0.1% DTT)4℃过夜并用Bradford法测定蛋白质含量,根据裂解液体积估算蛋白质提取率,并将裂解液稀释至上样所需浓度。
1.2.6 蛋白样品的双向电泳
1.2.6.1 等电聚焦 IEF胶条的制作 取540 μL H2O,200 μL 30%丙烯酰胺,0.6 g尿素,pH4-6载体两性电解质4.8 μL,pH3-10载体两性电解质24 μL,5 μL 10%过硫酸铵,4 μL TEMED混匀并缓缓注入到玻璃管中(12 cm),室温聚合。等电聚焦电压如表1所示。

表 1 等电聚焦程序和参数
1.2.6.2 胶条平衡 首先将等电聚焦后的胶条由玻璃管的一端挤出放入含有0.2 g/mL DTT的平衡液中平衡15 min,然后再置于0.2 g/mL碘乙酰胺中平衡17 min。平衡液:6 mol/L尿素,20%(V/V)甘油,2% SDS,50 mmol/L Tris-HCl(pH8.8,1.5 mol/L)。
1.2.6.3 SDS-PAGE 将平衡后的胶条转移到12%浓度的二维胶上进行恒流电泳,参数为20 mA/gel 15 min,40 mA/gel直至溴酚蓝移动到胶条的最低端。
1.2.7 蛋白染色 Neuhoff考染法[9]。
1.2.8 质谱分析 从最优的图谱中随机选取5个蛋白点,对其进行脱色、胰酶酶解、质谱鉴定、数据库比对。
1.2.9 信号肽预测 将质谱得出的结果导出,在NCBI上得到蛋白质序列,利用信号肽在线预测工具SignalP 4.1 Server(http://www.cbs.dtu.dk/services/ SignalP/)预测蛋白序列中是否含有Sec途径信号肽的剪切位点。
2 结果
2.1 菌体生长与培养基蛋白含量的关系
如图1所示,经过活化的酵母接种后直接进入对数生长期,在48 h达到稳定期,菌种浓度达到108CFU/mL。胞外蛋白在对数期时产生量很少,因为胞外蛋白属于次级代谢产物,在进入稳定期后含量逐渐增加。在培养120 h之后培养基中蛋白含量直线上升伴随着菌种数的下降。原因是有部分菌体发生自溶,细胞液释放到培养基中。从图1可以得出培养96 h可以作为胞外蛋白的最佳提取时间。同时取96 h的酵母细胞经扫描电镜分析结果,(图2)显示酵母呈椭圆状,形态均一且表面光滑,无细胞自溶和细胞质外泄等情况。
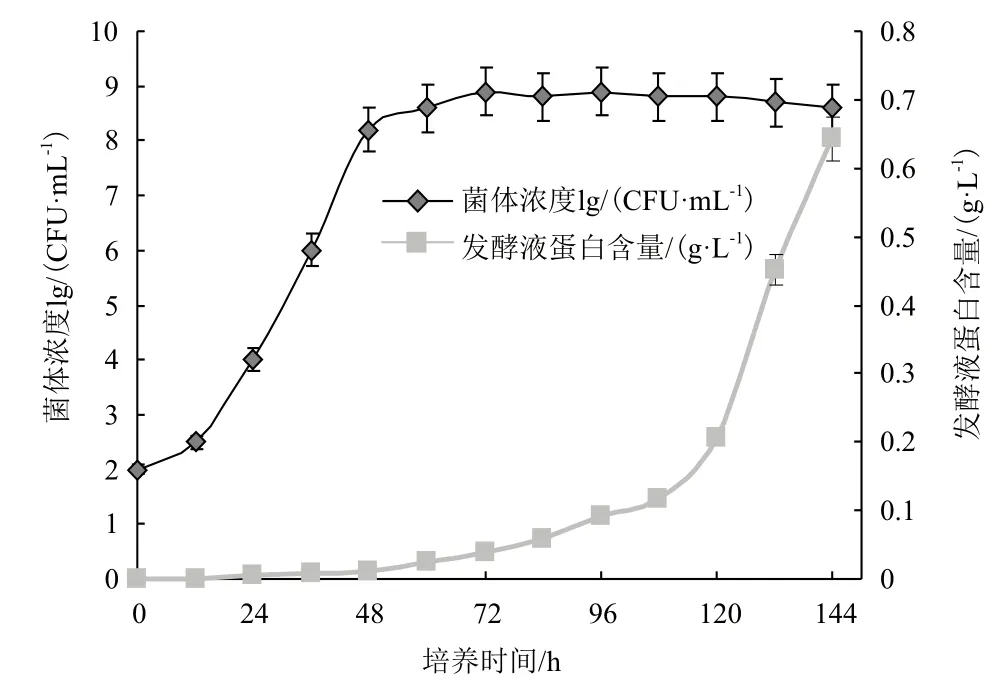
图1 不同培养时间下菌体浓度与发酵液蛋白质含量

图2 培养96 h酵母细胞扫描电镜图(1 000×)
2.2 三种方法提取率
经过多次平行试验,由蛋白质裂解液中蛋白质含量与发酵液中总蛋白的含量之比换算出蛋白质提取率。样品经双向电泳分离后用PDquest 8.0分析结果,如图3所示,硫铵沉淀法提取率低,提取的蛋白中主要为高丰度蛋白,得到的蛋白点少。冻干法的提取率较超滤法提高了30.78%,蛋白点数增加了83.87%。蛋白点数与蛋白质的提取率呈正相关,当提取率达到60%以上时低丰度蛋白才会在图谱上显现。
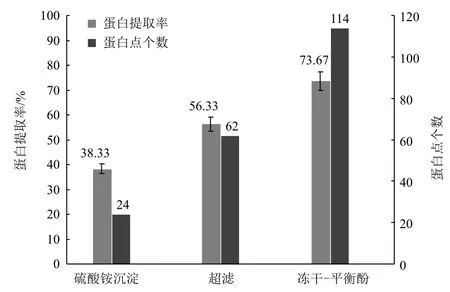
图3 不同提取方法的提取率与蛋白点个数
2.3 不同方法提取蛋白的双向电泳图谱
分别将3种方法得到的蛋白质样品溶于裂解液中,定量之后以3 g/L的浓度上样40 μL。经过IEF及SDS-PAGE分离,最后用考马斯染色液染色得到结果(图4)显示,冻干-平衡酚法蛋白点清晰,且拖尾的蛋白点较少,分离效果最好。硫酸铵沉淀法有大面积拖尾分离效果较差,而超滤法有部分蛋白未完全分离。

图4 硫酸铵沉淀(a)、超滤(b)、冻干-平衡酚(c)提取蛋白的双向电泳图谱
2.4 质谱分析结果
从最清晰的冻干法图谱中随机选取5个清晰的蛋白点作质谱分析,根据质谱结果(表2)显示检测匹配到4个蛋白点,剩余1个蛋白点未在数据库中匹配到。原因可能是蛋白发生修饰(糖基化、磷酸化)或降解导致分子结构或分子量发生变化,肽段不能得到匹配。这种修饰细胞内亦或是细胞外都有可能发生。检测到的蛋白点中有两个经SignalP 4.0 Server分析有信号肽剪切位点属于分泌蛋白,3-4根据其存在位置确定为膜蛋白。蛋白点3为蛋白质跨膜通道蛋白,其功能包括参与将特异性蛋白整合进细胞膜或者将其完全分泌细胞外。

表2 质谱分析与信号肽预测结果
3 讨论
在真核细胞中分泌蛋白合成于与内质网结合的核糖体上,核糖体合成出的多肽在内质网中得到修饰,最后被转运到细胞外。其中发生的修饰中最主要的为糖基化,对于某些蛋白质来说,只有经过糖基化修饰后蛋白质分子才能正确折叠。正是由于这些修饰的存在给蛋白质的分离分析带来难度。同时分泌类蛋白质本身在发酵液中含量很低,常规的分离方法很难达到后续分析的要求。本试验用3种不同的浓缩分离方法,以双向电泳图谱为依据确定了胞外蛋白的最适提取方式。
硫铵沉淀法是利用高浓度的盐离子破坏蛋白质表面的水化膜使蛋白质溶解度降低,从而使蛋白质在溶液中析出与水溶性杂质分离。此方法提取蛋白得到的电泳图谱斑点模糊,因为硫铵沉淀法对胞外蛋白的提取步骤多、周期长(1-2 d),在此过程中蛋白质很容易被修饰或者降解。其通过对发酵液总蛋白质以及裂解液中蛋白质进行定量分析得出提取率在48%-52%之间,在提取高丰度蛋白时宜使用此方法。酵母发酵液中多糖含量高,采用硫铵沉淀法提取蛋白过程中不能达到预期除糖效果,增加了蛋白质在提取过程中被修饰的可能。如果蛋白质经过不同程度的糖基化和磷酸化修饰,其不再能反映原有蛋白的等电点与分子量,在双向电泳图谱中会形成弥散的条带与大面积的拖尾。要想解决此问题可以对提取到的蛋白进行去糖基化和去磷酸化,但此过程中会带进新的杂质和提高提取成本。
超滤法提取蛋白操作简便,整个过程中不加入任何的试剂,不经过剧烈的相变化,条件最为温和。其提取率比硫铵沉淀法高,低丰度蛋白也被更好地保留下来。从图谱上可以看到大部分的蛋白点都能被很好地显示出来。但在A、B处出现了比较严重的拖尾,A、B处的拖尾在经过实验条件优化后仍不能被很好地除去,原因是蛋白质被不同程度地糖基化或磷酸化修饰。由于B处的蛋白点在超滤法中非常清晰,可以说明这种蛋白质修饰发生在提取的过程中。
冻干在操作过程中作为将发酵液浓缩的一种方式将发酵液浓缩至60 mL,在浓缩发酵液的同时溶液中含有大量的多糖也得到浓缩,导致发酵液的凝固点降低到-15℃以下,固体表面黏稠,严重影响冻干效率。冻干后的平衡酚—醋酸铵/甲醇沉淀操作是蛋白质损失的主要原因,平衡酚提取的原理是根据蛋白质在与有机试剂作用后变性不溶于水的特点,同时平衡酚也是提取核酸的方法。在分离过程中蛋白质停留在中间相及酚相中,多糖和核酸等易造成蛋白点拖尾的杂质存在于水相中。冻干法与超滤法的谱图类似,可以很好地相互识别。虽然在A处依然出现拖尾的条带,但在图上可以清晰地看到蛋白点说明冻干-平衡酚法能有效解决硫铵沉淀与超滤方法中蛋白点拖尾的问题。相比于前两种方法,冻干-酚提方法不但提取率高、识别的蛋白点多而且图谱质量最好,是分离制备分泌蛋白样品的理想方法。
质谱结果表明胞外环境中存在少量细胞壁上脱落的蛋白亦或是由酵母分泌小泡排出的非活性蛋白,这些蛋白是如何从酵母细胞上脱落的,以及是否还有其他新的分泌方式需要人们进一步解决验证。酵母胞外蛋白质组学的开展可以极大地丰富人们对细胞代谢通路的了解,也可以与生物信息学相结合为蛋白质组学的研究提供一个新的思路。
4 结论
本试验选取了硫铵沉淀、超滤、冻干-平衡酚等3种不同的浓缩除杂方法提取Saccraomyces cerevsiae FFC2144胞外蛋白。用双向电泳得出3种提取条件下胞外蛋白图谱,选取5个点做质谱鉴定。其中冻干-平衡酚-丙酮沉淀法具有提取率高、图谱清晰、较低丰度蛋白可以被保留等优点,可以很好地与双向电泳、LC-MS等下游技术相结合,适于作为胞外蛋白质组学研究中常用的提取方法。
[1] Den Haan R, Kroukamp H, Mert Mm, et al. Engineering Saccharomyces cerevisiae for next generation ethanol production[J]. Chem Technol Biotechnol, 2013, 88(6):983-991.
[2] Normann TC. Calcium-dependence of neurosecretion by exocytosis[J]. J Exp Biol, 1974, 61:401-409.
[3]杨静, 李成云, 王云月, 等. 酿酒酵母分泌蛋白组的计算机分析[J]. 中国农业科学, 2005, 38(3):516-522.
[4] Hathout Y. Approaches to the study of the cell secretome[J]. Expert Rev Proteomics, 2007, 4(2):239-248.
[5] Agrawal GK, Jwa NS, Lebrun MH, et al. Plant secretome:unlocking secrets of the secreted proteins[J]. Proteomics, 2010, 10(4):799-827.
[6] Cash P. Proteomics in medical microbiology[J]. Electrophoresis,2000, 21(6):1187-1201.
[7]Chen YP, Kirk N, Piper PW. Effects of medium compositionon MFα1 promoter-directed secretion of a small protease inhibitor in Saccharomyces cerevisiae batch fermentation[J]. Biotechnology Letters, 1993, 15(3):223-228.
[8]李海玲, 彭书明, 李凛, 等. 4种常用蛋白浓度测定方法的比较[J]. 中国生化药物杂志, 2008, 29(4):277-278.
[9]Neuhoff V, Arold N, Taube D, et al. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nano-gram sensitivity using Coomassie Brilliant Blue G-250 and R-250[J]. Electrophoresis, 1988, 9(6):255-262.
(责任编辑 李楠)
Procedure to Prepare Samples for Two-dimensional Electrophoresis of Secreted Proteins from Saccharomyces cerevisiae
Du Wei1Piao Yongzhe2Huang Wei1Gu Yue1Zhao Changxin1
(1. School of Biological Engineering,Dalian Polytechnic University,Dalian116034;2. Dalian Nationalities University,Dalian116600)
Saccraomyces cerevsiae FFC2144 was cultured in nitrogen base medium without protein. The secretory proteins of yeasts were extracted by ammonium sulfate precipitation, ultrafiltration and lyophilization-phenol extraction respectively. Extraction rates by 3 methods were calculated and the proteins were separated by two-dimensional electrophoresis. The proteins isolated were confirmed by MALDI-TOF-MS. The extraction rate by lyophilization-phenol method was 73.67% and 114 protein spots were obtained with the most protein spotsand clearest electrophoretogram. Lyophilization-phenol method could be an ideal separation method for studying secretory proteomics.
Saccharomyces cerevisiae;secretory protein;two-dimensional electrophoresis;extraction method
10.13560/j.cnki.biotech.bull.1985.2015.05.012
2014-09-12
杜维,男,硕士,研究方向:酵母蛋白质组学;E-mail:foredu119@hotmail.com
赵长新,男,教授,研究方向:啤酒酵母生理代谢、啤酒大麦制备工艺及生理;E-mail:zhaocx@dlpu.edu.cn

