沙冬青AmHsa32基因超表达提高转基因烟草抗热性
贺茜 王艳萍 陈玉珍 卢存福
(北京林业大学生物科学与技术学院 林木育种国家工程实验室,北京 100083)
沙冬青AmHsa32基因超表达提高转基因烟草抗热性
贺茜 王艳萍 陈玉珍 卢存福
(北京林业大学生物科学与技术学院林木育种国家工程实验室,北京100083)
Hsa32是一类新型的热激蛋白,主要发现于陆地植物中,对植物抗逆性的获得起关键作用。AmHsa32是Hsa32的同源蛋白之一,是从沙冬青(Ammopiptanthus mongolicus)克隆得到的耐热性相关基因。成功构建了Pcambia2300-35S-AmHsa32-OCS植物表达载体,经农杆菌介导转入到本生烟中。经PCR和Western boltting检测证明AmHsa32已经被转入到本生烟基因组中。对转基因和野生型本生烟在高温胁迫下种子的萌发率、幼苗生长耐热性进行检测发现,转基因植物的抗热得到了明显提高。研究结果表明,AmHsa32可作为植物耐热基因育种的重要基因资源。
沙冬青;AmHsa32;转基因;耐热性
温度是影响植物正常生长发育的主要环境因子之一。温度过高或过低均能抑制植物生长发育,限制植物分布,同时也会造成植株无法恢复的伤害,甚至会导致死亡。植物体可以响应非致死高低温,这使其能够抵御极端温度从而存活[1],高温能破坏植物的正常生理和代谢过程,如光系统Ⅱ活性[2]、花粉和种子发育[3]、乙炔还原[4]、内质网完整性[5]及叶生长[6]等。同样,非致死性高温也能使植物基因的表达模式发生改变。热胁迫使植物正常生长发育所需蛋白质合成受到抑制,同时诱导产生大量的热激蛋白,提高植物耐热性。热胁迫相关蛋白Hsa32(heat stress associated protein32,Hsa32)是一种小分子热激蛋白,分子量为32 kD,在植物抵御热胁迫及植物耐热性获得方面具有关键作用;另外,Hsa32也能够响应低温、干旱、盐等非生物胁迫[7,8]。目前,对Hsa32蛋白的研究主要集中在拟南芥、小麦、番茄等[9],还未见对木本植物Hsa32的报道。
沙冬青是我国西北荒漠地区的常绿灌木,是亚热带地区第三纪残遗物种[10,11],具有很强的抵抗干旱、寒冷、高温、盐碱等特性。与杨树等已测序木本植物相比[12],沙冬青抗逆基因功能研究比较滞后,目前主要集中在抗逆基因的挖掘和功能验证[13-26]。Chen等[26]克隆了沙冬青的CBL1,将其转入到烟草中,转基因烟草相较于对照组具有较强的抗逆性。李晓东等[27]将沙冬青脱水素基因AmDHN 转入到甜菜中,抗性实验表明转基因甜菜的抗旱性要高于非转基因。智冠华等[28]初步证明了沙冬青基因AmZFPG 能提高植物的耐寒性。因此,沙冬青是研究木本植物抗逆基因资源的理想材料[29]。
我们先前的研究[29]表明,沙冬青AmHsa32基因ORF区域为858 bp,共编码286个氨基酸,与拟南芥、玉米、水稻、番茄、小麦中Hsa32都有较高的同源性。在40℃胁迫下,AmHsa32 在沙冬青幼苗中表达量迅速提高,1 h后达到对照的25倍。除此以外,转入AmHsa32基因的大肠杆菌也具有一定的耐热性[13]。本研究构建Pcambia2300-35S-AmHsa32-OCS植物表达载体,经农杆菌介导转入到模式植物本生烟中,验证了AmHsa32具有提高植物耐热性的功能。
1 材料与方法
1.1 材料
含AmHsa32基因的菌液、真核表达载体Pcambia2300-35S-OCS、农杆菌LBA4404以及野生型本生烟(Nicotiana benthamiana)均由本实验室保存提供。内切酶Kpn I、BamH I、pMD-18T Vector、DNA marker均购自日本TaKaRa公司。
1.2 方法
1.2.1 真核表达载体构建 以AMSP(5'-AggTACCATgTCAgCATACAgATggAAAAgC-3',下划线为Kpn I酶切点)为上游引物,AMSR(5'-AggATCCATgCAACACCAgCTATgA gACAAC-3',下划线为BamH I酶切点)为下游引物,含有AmHsa32的菌液为模板,进行PCR扩增。PCR扩增参数:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,40 个循环;终延伸 72℃10 min。扩增产物进行1%琼脂糖凝胶电泳,将AmHsa32目的片段切胶回收后与pMD18-T载体16℃连接3 h,转入大肠杆菌感受态细胞。挑取阳性克隆测序验证。对正确序列的阳性克隆提质粒,用Kpn I和BamH I双酶切,同时双酶切载体Pcambia-2300,均37℃酶切3 h,产物回收后,用T4连接酶16℃连接3 h,获得重组载体,测序验证。提取重组载体质粒转化农杆菌LBA4404感受态细胞。
1.2.2 野生型烟草侵染,T1代转基因烟草鉴定 用农杆菌介导的叶盘侵染法将重组载体AmHsa32-2300转化到野生型烟草中,将T1代烟草种子播种在含150 mg/L卡那霉素的MS培养基上,筛选转基因阳性苗。选择转基因植株炼苗,之后转移至营养土中培养。用CTAB法提取T1代不同种系转基因烟草DNA,进行PCR验证。
1.2.3 Western boltting检测 AmHsa32抗血清是用我们先前获得的重组蛋白AmHsa32-N[30]注射免疫兔子得到。液氮研磨不同株系转基因烟草,将叶片粉末分装于无菌2 mL EP管,加入200 μL预冷过的磷酸缓冲液(pH>7.0),将Ep管置于4℃冰箱30 min溶解水溶性蛋白。12 000 r/min低温离心10 min,取5 mL上清并加入5 μL loading buffer,混匀后上样,进行SDS-PAGE电泳分离AmHsa32。随后利用水溶式电转移转膜,进行免疫印迹反应。
1.2.4 胁迫条件下转基因烟草种子的萌发率的测定 将AmHsa32转基因T1代烟草种子和野生型种子在MS培养基中培养12 h(25℃,16 h光照 /8 h黑暗)。热处理:37℃处理2 h,42℃再处理2 h后,转入正常培养条件,恢复培养10 d统计发芽率,实验重复3次。
1.2.5 转基因烟草T1代幼苗耐热性分析 将AmHsa32转基因烟草T1代种子及野生型烟草播种于MS培养基上,至幼苗长出4叶片时进行热胁迫处理。胁迫结束后,转入25℃控温箱(16 h光照 /8 h黑暗)培养15 d,观察转基因烟草及野生型株系的表型变化,统计存活率,实验重复3次。
分别将转基因烟草和野生型种子播种于营养钵中,培养6周。选择长势一致的植株进行热处理观察表型变化。热胁迫过程:将土培苗在37℃热驯化1 h后,室温恢复生长2 h,45℃再次热激3 h后,在25℃恒温培养箱中继续培养7 d,观察表型变化,统计植株存活率。实验重复3次。
2 结果
2.1 真核表达载体的构建
2.1.1 2300-Hsa 真核表达载体的构建 克隆沙冬青AmHsa32基因,与pMD18-T载体连接后测序。选择测序正确的单克隆菌液提质粒,与Pcambia-35s-ocs真核表达载体构建重组质粒,具体构建见图1。
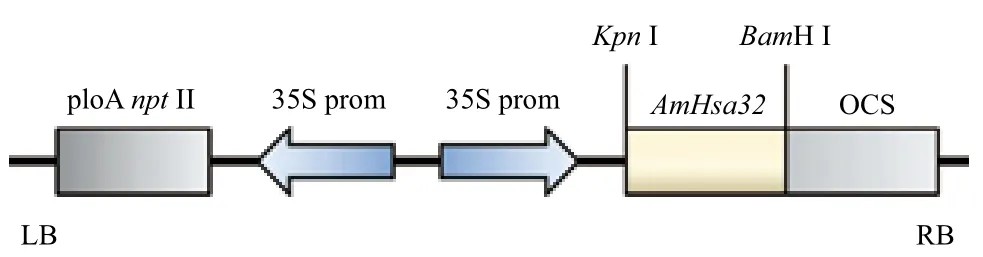
图1 2300-HAS 真核表达载体构建图
2.1.2 克隆AmHsa32基因片段 以含有测序正确的AmHsa32的菌液为模板,AMSP、AMSR为引物扩增目的基因编码序列。PCR产物经1%琼脂糖凝胶电泳后,获得大小约为850 bp的目的条带(图2)。将目的条带切胶回收后,与pMD18-T载体16℃连接5 h,将连接产物转化大肠杆菌JM109感受态细胞。将上述连接产物涂在氨苄霉素抗性LB平板上筛选,挑取菌落,37℃震荡培养后,PCR鉴定阳性克隆。

图2 PCR扩增AmHsa32电泳检测图
2.2 侵染本生烟及转基因植株T1代的鉴定
在25℃恒温(16 h光照/8 h黑暗)条件下,培养野生型烟草6周后,用农杆菌介导的叶盘侵染法将重组载体AmHsa32-2300转化野生型烟草。在诱导分化培养基中暗培养侵染叶片5 d,转入分化及抑菌培养基形成愈伤组织,培养愈伤组织4-5周后形成不定芽,将不定芽转移至抑菌生根培养基中,得到T0代转基因烟草。
将灭菌后的T1代转基因株系种子播种到MS培养基(含卡那霉素)中进行抗性筛选。培养4周后,转基因种子正常生长,叶片较绿,根系较为发达,无抗性的种子叶片发黄,根系短小,最终叶片白化死亡。在T1代种子中出现卡那霉素抗性分离,抗性苗与白化苗分离比约为3∶1。选择生长6周大小的组培苗进行炼苗,3 d后转移至营养土中生长2周,提取T1代转基因烟草叶片DNA进行PCR检验,条带位置在850 bp,即T1代转基因株系与阳性对照在相同位置存在目的条带(图3)。证明AmHsa32已整合到烟草基因组中,获得含卡那霉素抗性的T1代转基因烟草。
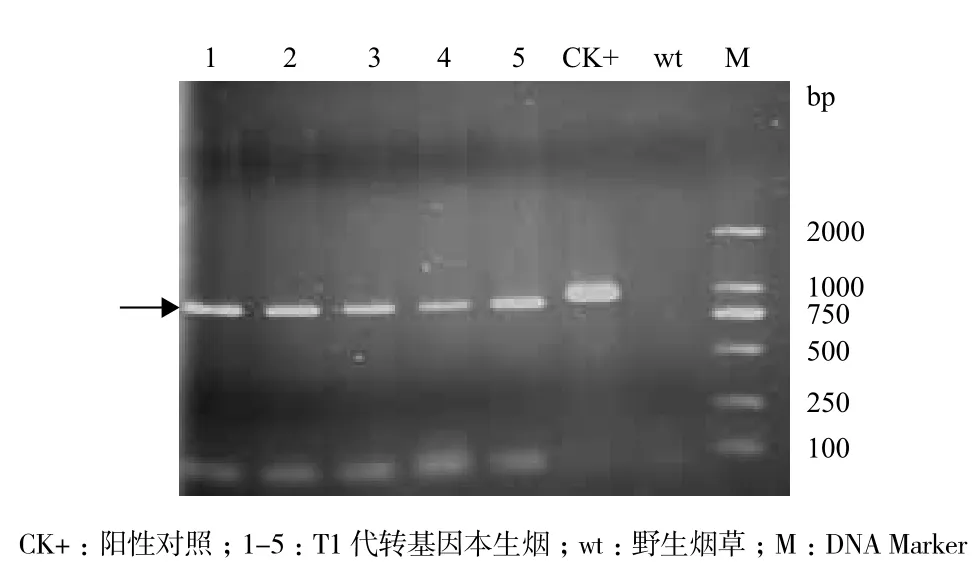
图3 T1代转基因本生烟的PCR检测
2.3 Western blotting检测
为研究转基因烟草中AmHsa32的表达情况,分别提取T1代不同株系转基因烟草叶片中的可溶性蛋白,以野生型烟草可溶性蛋白作为对照,进行Western blotting。结果(图4)显示,T1代不同转基因株系(H1-1,H2-1,H3-1)均有免疫印迹信号,而野生型烟草无信号,证明AmHsa32基因已在转基因株系中表达。

图4 转AmHsa32的Western blotting检测
2.4 热胁迫下烟草萌发率
将野生型烟草种子及AmHsa32转基因株系T1代种子,分别播种于MS培养基,在25℃控温培养箱(16 h光照/8 h黑暗)中培养12 h,分组进行热胁迫。热胁迫37℃处理2 h后,42℃处理2 h转入25℃控温培养箱,10 d后统计发芽率。结果(图5)显示,AmHsa32转基因株系98%全部萌发,野生型仅有36%萌发,结果表明,转AmHsa32基因烟草高温胁迫抗性明显提高。

图5 转AmHsa32和野生型本生烟种子在不同温度处理下的萌发率
2.5 T1代转基因烟草幼苗的耐热性
将野生型烟草播种在MS培养基,T1代转基因烟草播种在含抗生素的MS培养基中,25℃控温培养箱(16 h光照/8 h黑暗)培养幼苗长出4叶片时,进行热胁迫处理,具体处理条件如表1。37℃处理幼苗1 h,42℃处理3 h,转入25℃控温培养箱回复培养15 d,观察转基因株系及野生型表型,野生型烟草约有20%叶片发白干枯,而转基因株系正常生长。37℃处理幼苗1 h,42℃处理3 h,45℃进一步处理3 h,转入25℃控温培养箱,恢复培养15 d,观察表型,野生型烟草幼苗全部死亡(图6-A),而AmHsa32转基因幼苗约有60%存活(图6-B)。

表1 转基因和野生型本生烟幼苗对热胁迫反应的比较

图6 转基因及野生型本生烟热处理后恢复15 d后的表型
培养钵中生长6周后的幼苗,经42℃处理后,恒温箱25℃恢复培养7 d,转基因烟草与野生型植株的表型变化差异明显。经过热胁迫,与转基因植株相比,野生型株系叶片变黄,逐渐白化,受害明显(图7-D),转基因株系80%叶片保持绿色(图7-C),表明AmHsa32的表达能够有效减轻热胁迫对植株的伤害。
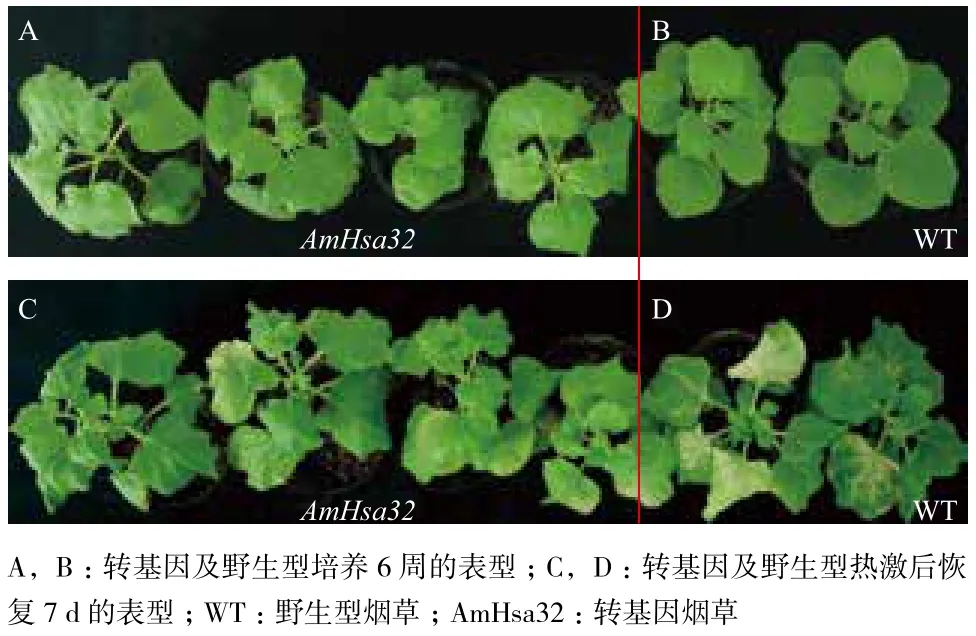
图7 转基因及野生型本生烟的表型
3 讨论
已有的研究表明热胁迫相关蛋白Hsa32对植物耐热性的获得具有关键作用。Liu等[30]对Hsa32耐热性方面的研究表明,缺少Hsa32基因的拟南芥在高温处理下较野生型更为敏感。生物信息学分析发现Hsa32的氨基酸序列与2-磷酸3-磺基乳酸合成酶(参与硫脂合成)相似,但是实验结果表明拟南芥Hsa32突变体对高温的敏感性与硫脂的含量并无关联,Hsa32也不参与硫脂的合成。Charng等[7]用插入突变的方法在Hsa32基因中插入T-DNA,该基因的突变并不影响植物在正常温度下的生长和发育。耐热性获得实验发现,突变株和野生型植株在经受高温处理后,需要一段时间的恢复,再次经历高温时,野生型长势良好,突变株则相反;但是如果恢复时间不够,则突变株和野生型都会死亡。这说明Hsa32在植物中起作用不仅需要诱导,Hsa32在热胁迫后起作用也需要一段时间的恢复期。Wu等[31]为了探索Hsa32无效突变株仅存在短暂的耐热性,但不具备长期的耐热性这一现象的内在机制,采用正向遗传筛选的两个错义隐性等位基因(编码热激蛋白分子伴侣HSP101)的突变体,免疫印记和异位表达等的实验结果都表明了HSP101 和HSA32在蛋白水平上互相调控,是一种正反馈机制,通过这种新型的机制能够延长植物热驯化的效力。
我们前期的研究表明,转AmHsa32大肠杆菌(BL21)经50℃热胁迫后存活率较野生型明显提高。AmHsa32有可能结合了其他蛋白,共同维持大肠杆菌在逆境下的正常生存[29]。本研究中转基因烟草种子在热及低温胁迫条件下仍能全部萌发,而野生型烟草种子在热胁迫后仅有35%的萌发率,这说明AmHsa32提高了转基因烟草的抗热能力。幼苗的耐热分析结果表明,AmHsa32转基因植株抵御长时间的高温胁迫后仍有60%存活,而野生型烟草全部死亡。在模式植物拟南芥的研究中也有类似报道,Hsa32突变体与野生型受到同样的热胁迫(44℃)处理60 min后,前者死亡[7],这表明Hsa32的表达对植物响应热胁迫有重要作用。
4 结论
构建沙冬青AmHsa32基因cDNA真核表达载体,侵染野生型烟草,经过PCR及Western blotting鉴定后,证实目的基因已转入烟草。对转基因烟草在高温胁迫下的萌发率及幼苗生长分析证明,AmHsa32使转基因植株的耐热性明显提高。
[1] Yarwood CE. Acquired tolerance of leaves to heat[J]. Science,1961, 134(3483):941-942.
[2] Havaux M, Greppin H, Strasser RJ. Functioning of photosystems I and II in pea leaves exposed to heat stress in the presence or absence of light:Analysis using in-vivo fluorescence, absorbance, oxygen and photoacoustic measurements[J]. Planta, 1991, 186(1):88-98.
[3] Cheikh N, Jones RJ. Disruption of maize kernel growth and development by heat stress(role of cytokinin/abscisic acid balance)[J]. Plant Physiol, 1994, 106(1):45-51.
[4] Michiels J, Verreth C, Vanderleyden J. Effects of temperature stress on bean-nodulating Rhizobium strains[J]. Appl Environ Microbiol, 1994, 60(4):1206-1212.
[5] Grindstaff KK, Fielding LA, Brodl MR. Effect of gibberellin and heat shock on the lipid composition of endoplasmic reticulum in barley aleurone layers[J]. Plant Physiol, 1996, 110(2):571-581.
[6] Beator J, Potter E, Kloppstech K. The effect of heat shock on morphogenesis in barley:coordinated circadian regulation of mRNA levels for light-regulated genes and of the capacity for accumulation of chlorophyll protein complexes[J]. Plant Physiol, 1992, 100(4):1780-1786.
[7] Charng YY, Liu HC, Liu NY, et al. Arabidopsis Hsa32, a novel heat shock protein, is essential for acquired thermotolerance during long recovery after acclimation[J]. Plant Physiol, 2006, 140(4):1297-1305.
[8] Charng YY, Liu HC, Liu NY, et al. A heat-inducible transcription factor, HsfA2, is required for extension of acquired thermotolerance in Arabidopsis[J]. Plant Physiol, 2007, 143(1):251-262.
[9] Moseley PL. Heat shock proteins and heat adaptation of the whole organism[J]. J Appl Physiol(1985), 1997, 83(5):1413-1417.
[10] Shi J, Liu M, Shi J, et al. Reference gene selection for qPCR in Ammopiptanthus mongolicus under abiotic stresses and expression analysis of seven ROS-scavenging enzyme genes[J]. Plant Cell Reports, 2012, 31(7):1245-1249.
[11] Zhou Y, Gao F, Liu R, et al. De novo sequencing and analysis of root transcriptome using 454 pyrosequencing to discover putativegenes associated with drought tolerance in Ammopiptanthus mongolicus[J]. BMC Genomics, 2012, 13:266.
[12] Wullschleger SD, Weston DJ, Difazio SP, et al. Revisiting the sequencing of the first tree genome:Populus trichocarpa[J]. Tree Physiol, 2013, 33(4):357-364.
[13]史军娜, 刘美芹, 师静, 等. 沙冬青GATA型锌指蛋白基因序列及表达分析[J]. 北京林业大学学报, 2011(3):21-25.
[14]刘佳杰, 林清芳, 李连国, 等. 蒙古沙冬青冷冻胁迫SMART cDNA文库的构建及序列分析[J]. 植物遗传资源学报, 2011(5):770-774.
[15]张锋, 王学峰, 董博, 等. 沙冬青AmDREB3基因的克隆及植物表达载体构建[J]. 内蒙古农业大学学报:自然科学版,2012(Z1):133-134.
[16]王学峰, 李记园, 李连国, 等. 蒙古沙冬青胰蛋白酶抑制剂基因AmTI的克隆及其功能分析[J]. 内蒙古农业大学学报:自然科学版, 2012(2):103-108.
[20] Pang T, Ye CY, Xia X, et al. De novo sequencing and transcriptome analysis of the desert shrub, Ammopiptanthus mongolicus, during cold acclimation using Illumina/Solexa[J]. BMC Genomics,2013, 14(1):488.
[21] Gu L, Cheng H. Isolation, molecular cloning and characterization of a cold-responsive gene, AmDUF1517, from Ammopiptanthus mongolicus[J]. Plant Cell, Tissue and Organ Culture(PCTOC). 2014,117(2):201-211.
[22] Liu M, Lu C, Shen X, et al. Characterization and function analysis of a cold-induced AmCIP gene encoding a dehydrin-like protein in Ammopiptanthus mongolicus[J]. DNA Seq, 2006, 17(5):342-349.
[23] Guo L, Yu Y, Xia X, et al. Identification and functional characterisation of the promoter of the calcium sensor gene CBL1 from the xerophyte Ammopiptanthus mongolicus[J]. BMC Plant Biology,2010, 10(1):1.
[24] Liu R, Liu M, Liu J, et al. Heterologous expression of a Ammopiptanthus mongolicuslate embryogenesis abundant protein gene(Am-LEA)enhances Escherichia coli viability under cold and heat stress[J]. Plant Growth Regulation, 2010, 60(2):163-168.
[25] Wei Q, Guo Y, Cao H, et al. Cloning and characterization of an AtNHX2-like Na+/H+antiporter gene from Ammopiptanthus mongolicus<(Leguminosae)and its ectopic expression enhanced drought and salt tolerance in Arabidopsis thaliana[J]. Plant Cell, Tissue and Organ Culture, 2011, 105(3):309-306.
[26] Chen J, Sun Y, Sun F, et al. Tobacco plants ectopically expressing the Ammopiptanthus mongolicus AmCBL1gene display enhanced tolerance to multiple abiotic stresses[J]. Plant Growth Regulation, 2011, 63(3):259-269.
[27]李晓东. 强旱生植物沙冬青AmDHN、AmERF基因克隆及转化甜菜的研究[D]. 呼和浩特:内蒙古农业大学, 2010.
[28]智冠华, 史军娜, 赵晓鑫, 等. 转沙冬青锌指蛋白基因AmZFPG烟草非生物胁迫抗性分析[J]. 园艺学报, 2013, 40(4):713-743.
[29]王艳萍, 刘美芹, 师静, 等. 沙冬青热胁迫相关蛋白基因AmHsa32超表达提高大肠杆菌的抗热性[J]. 北京林业大学学报, 2012(5):37-43.
[30] Liu NY, Hsieh WJ, Liu HC, et al. Hsa32, a phosphosulfolactate synthase-related heatshock protein, is not involved in sulfolipid biosynthesis in Arabidopsis[J]. Botanical Studies, 2006(47):389-395.
[31] Wu TY, Juan YT, Hsu YH, et al. Interplay between heat shock proteins HSP101 and HSA32 prolongs heat acclimation memory posttranscriptionally in Arabidopsis[J]. Plant Physiol, 2013, 161(4):2075-2084.
(责任编辑 李楠)
Ectopic-overexpression of AmHsa32 from Ammopiptanthus mongolicus Promoted Heat Tolerance in Nicotiana benthamiana
He Qian Wang Yanping Chen Yuzhen Lu Cunfu
(College of Biological Sciences and Biotechnology,National Engineering Laboratory for Tree Breeding,Beijing Forestry University,Beijing100083)
Hsa32 is a novel heat-shock protein(Hsp)and mainly found in land plants and essential for acquired thermo-tolerance. AmHsa32 as one orthologue of the Hsa32 gene, was isolated from a desert plant, Ammopiptanthus mongolicus(Leguminosae). In order to verify the function of AmHsa32, we constructed the plant expression vector Pcambia2300-35S-AmHsa32-OCS, and transferred it into Nicotiana benthamiana through the medium of Agrobacterium strain. PCR and Western blotting demonstrated that AmHsa32 had been integrated into the genome of Nicotiana benthamiana. Seed germination and seedling growth analysis indicated that overexpressing AmHsa32 resulted in enhanced tolerance to heat stresse in transgenic Nicotiana benthamiana. Our work suggests that AmHsa32 might be a valuable gene for plant resistant breeding with transgene technology.
Ammopiptanthus mongolicus;AmHsa32;transgene;thermotolerance
10.13560/j.cnki.biotech.bull.1985.2015.05.016
2014-11-09
国家自然科学基金项目(31270737),高等学校学科创新引智计划资助项目(B13007),长江学者和创新团队发展计划资助项目(IRT13047),北京市自然科学基金项目(6112016)
贺茜,男,硕士,研究方向:植物分子生物学;E-mail:tree.hq@163.com
卢存福,男,博士,教授,研究方向:植物分子细胞生物学;E-mail :lucunfu@bjfu.edu.cn
——致坚守奋斗的你

