小花棘豆Embellisia内生真菌原生质体的制备与再生研究
呼吉雅 卢萍 牛艳芳
(内蒙古师范大学生命科学与技术学院,呼和浩特 010022)
小花棘豆Embellisia内生真菌原生质体的制备与再生研究
呼吉雅 卢萍 牛艳芳
(内蒙古师范大学生命科学与技术学院,呼和浩特010022)
旨在获得数目多且活力高的小花棘豆Embellisia内生真菌的原生质体,分析和探讨该内生真菌原生质体制备与再生的最佳条件,为后续外源基因转化奠定基础。利用酶解法对制备小花棘豆Embellisia内生真菌菌丝的原生质体,研究酶解液成分、pH、温度、渗透压稳定剂、酶解时间及菌龄对原生质体制备和再生的影响;原生质体在TB3培养基上再生后,研究酶解时间对原生质体再生的影响。结果显示,2.5%(W/V)lysing enzymes、2%(W/V)纤维素酶和3%(W/V)蜗牛酶3种混合酶处理,菌龄为10 d,当酶解温度为30℃、pH5.8、1.2 mol/L MgSO4为渗透压稳定剂,在80 r/min水平摇床酶解8 h时,原生质体浓度较高,达4.42×105个/mL;酶解时间6 h时再生率最高,达46.7%。
小花棘豆;内生真菌;原生质体;原生质体制备与再生
小花棘豆(Oxytropis glabra)属于豆科棘豆属的多年生有毒草本植物,主要分布于我国内蒙古、甘肃、新疆、陕西、青海、宁夏等地区的荒漠化草原及山地。小花棘豆生命力旺盛、适应性很强,已成为我国西部荒漠化草原优势种群。但是牲畜采食后会引起慢性中毒,给草原畜牧业造成严重损失[1,2]。其有毒成分为苦马豆素,同属的其他植物,如甘肃棘豆、黄花棘豆中的主要有毒成分也是苦马豆素[3,4],它可抑制动物细胞内α-甘露糖苷酶活性,使糖代谢受阻,致使神经细胞功能紊乱,出现中毒症状,毒素积累到一定程度可引起死亡。苦马豆素具有抗肿瘤活性,可抑制肿瘤细胞N-连接寡糖的合成,从而抑制其生长及扩散[5,6]。卢萍等[7-9]研究发现,小花棘豆毒性与其感染Embellisia内生真菌密切相关,该内生真菌在分类上属于子囊菌门、腔菌纲、格孢腔菌目、格孢腔菌科、埃里砖格孢属的丝状真菌,体外培养该内生真菌会产生苦马豆素。小花棘豆中的营养成分及含量与其他豆科植物和禾本科牧草相当,是一种具有潜在利用价值的牧草[10,11]。因此,深入研究该内生真菌,对于小花棘豆的治理利用、苦马豆素微生物工业化生产等方面都有重要意义。
原生质体是外源DNA转化、质粒转移、病毒转染的良好受体,再生后可表达外源基因。真菌原生质体转化技术已得到广泛应用[12-14]。丝状真菌有多组分复杂细胞壁结构,与细菌、酵母、放线菌的细胞壁结构相比更加复杂,相近丝状真菌物种间的细胞壁多糖组分和比例也不同[15-17],丝状真菌原生质体制备难度较高。原生质体的高效制备是完成外源基因转化的前提,探索其制备与再生条件非常必要。分离原生质体的方法有酶解法和机械法等,其中酶解法简便高效,因而被广泛使用。本研究拟探索小花棘豆Embellisia内生真菌的原生质体制备与再生的最适条件,旨在为外源基因转化和分析基因在真菌苦马豆素代谢中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验菌株 小花棘豆Embellisia内生真菌OW7.8菌株,菌种于本实验室保存。
1.1.2 试剂及培养基 1.2 mol/L渗透压稳定剂:KCl,MgSO4,山梨醇,蔗糖(pH由磷酸缓冲液调制)。PDA培养基(g/L):马铃薯 200、蔗糖 20、琼脂粉20;PDB培养基(g/L):马铃薯200、葡萄糖20、蛋白胨10;原生质体保存液(STC buffer)[18]:1 mol/L山梨醇、100 mmol/L Tris-HCl(pH8.0)、100 mmol/L CaCl2;TB3原生质体再生培养基:20%蔗糖、0.3%酵母提取物、0.3%酸水解酪蛋白;双层再生培养基:TOP培养基:TB3再生培养基中加入0.6%琼脂;Bottom培养基:TB3再生培养基中加入1.5%琼脂。1.1.3 酶的种类 蜗牛酶(Snailase),纤维素酶(Cellulase)购自内蒙古鸿之惠商贸有限公司;溶壁酶(Lysing enzymes)购自Sigma公司。纤维素酶4 000 r/min 离心2 min,取上清。酶溶液用1.2 mol/L渗透压稳定剂配制,用0.22 μm微孔滤膜过滤除菌,现用现配。
1.2 方法
1.2.1 真菌原生质体制备 在PDA平板上接种OW7.8菌株,培养15 d,用灭菌牙签刮下菌丝体,置于50 mL PDB液体培养基中,于25℃、200 r/min震荡培养14 d后,用宽口枪头取出适量菌丝团置于10 mL离心管中,4 000 r/min离心5 min,弃上清,用超纯水洗去残留培养基,用渗透压稳定剂冲洗一次。称量得到白色菌丝团鲜重,按每克菌丝加20 mL酶液添加进行酶解反应,每隔30 min检测原生质体释放情况。酶解结束后,用血球计数板计数原生质体,6次重复,计算原生质体释放率。用4层擦镜纸过滤菌丝体酶解液,去掉残余菌丝体,用渗透压稳定剂冲洗一次,于4℃、6 000 r/min离心10 min,弃上清,加入0.5 mL STC buffer,再次离心后弃上清,加适量STC buffer混匀,收集纯化的原生质体,用血球计数板进行计数,6次重复,得到原生质体浓度值。
1.2.1.1 酶组合及其浓度 用溶壁酶(含几丁质酶、葡聚糖酶、纤维素酶和蛋白酶)、蜗牛酶(含葡聚糖酶、昆布多糖酶、纤维素酶和多聚半乳糖酶等20多种酶)和纤维素酶(含外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶),设计单酶、不同酶组合及酶浓度梯度实验(表1)。其他条件为菌龄12 d,pH6.0,30℃,以MgSO4为渗透压稳定剂,酶解6 h,计算原生质体释放率,确定最佳酶浓度及酶组合。
1.2.1.2 酶解反应pH值 酶组合及浓度确定后,用磷酸缓冲液分别配制pH分别为5.5、5.8、6.1、6.4、6.7和7.0的MgSO4溶液,其他条件不变,进行酶解反应,分别计算原生质体释放率。
1.2.1.3 酶解温度 采用上述实验确定的酶组合和MgSO4浓度的条件,设置酶解温度分别为20℃、25℃、30℃和35℃,其他条件不变,进行酶解反应,分别计算原生质体释放率。

表1 不同酶组合及浓度实验设计
1.2.1.4 渗透压稳定剂 采用上述实验确定的酶组合、MgSO4浓度和温度条件,分别以MgSO4、KCl、山梨醇和蔗糖为渗透压稳定剂,进行酶解反应,分别计算原生质体释放率。
1.2.1.5 酶解时间 将酶解反应时间设置在2、4、6、8和10 h,分别计算原生质体释放率。收集原生质体,在TB3培养基上再生,于25℃恒温培养5 d,分别计算酶解反应时间在2、4、6、8和10 h时的原生质体再生率。
1.2.1.6 菌龄 将菌丝接种到PDB培养基上,在恒温振荡器上以80 r/min分别震荡培养8、10、12、14和16 d后,制备原生质体,计算原生质体释放率。1.2.2 真菌原生质体的释放形式 在酶解过程中,每隔30 min取样制片,在显微镜下观察原生质体的释放。
1.2.3 原生质体再生 将收集纯化的原生质体接种到双层平板中。先在培养皿底部铺一层Bottom培养基,待其凝固,将收集纯化并用STC buffer适当稀释的原生质体与冷却至40℃左右的TOP培养基轻轻混匀,倒入上述平板中,于25℃恒温培养5 d,计数再生菌落数。收集原生质体时会有酶解不完全的菌丝,为消除其对计算原生质体再生率带来的误差,将相同量原生质体收集液用去离子水稀释,室温放置20 min,使原生质体充分胀破,也以上述再生方式培养,进行计菌落数。
原生质体再生率(%)=(STC buffer稀释生长的菌落数-去离子水稀释生长的菌落数)/原生质体总数×100%
2 结果
2.1 影响小花棘豆Embellisia内生真菌原生质体制备的因素
2.1.1 酶组分及浓度 制备小花棘豆Embellisia内生真菌的原生质体时,3种酶的混合酶解效果明显优于单酶及双酶混合的效果,原生质体产量起初随着溶壁酶浓度的增加而明显提高,但增至3%时,原生质体产量增加不再显著(表2)。综合考虑酶浓度与产量比,后续实验选择2.5%溶壁酶、3%蜗牛酶和2%纤维素酶三种酶的混合进行酶解反应。

表2 酶的不同组合及浓度对原生质体产量的影响
2.1.2 pH值 原生质体产量随pH增高而增多,pH5.8时原生质体产量最高,达3.33×105个/mL,之后随pH值升高,原生质体产量下降(图1)。
2.1.3 酶解反应温度 原生质体产量随着酶解反应温度的提高而增加,当反应温度为30℃时,原生质体产量最高,为3.75×105个/mL,之后随反应温度的提高,原生质体产量下降(图2)。
2.1.4 不同渗透压稳定剂 用4种缓冲液均可形成一定数量的原生质体,其中山梨醇和蔗糖缓冲液中的原生质体数量较少,而MgSO4渗透压稳定剂缓冲液中的原生质体数量明显增多,达3.83×105个/mL(表3)。
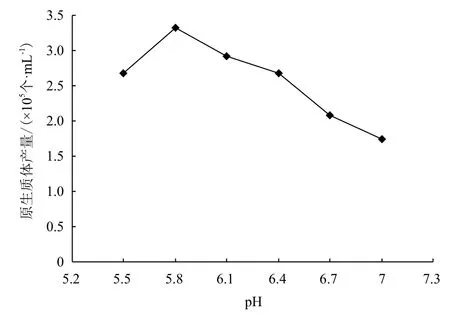
图1 酶解pH对原生质体产量的影响
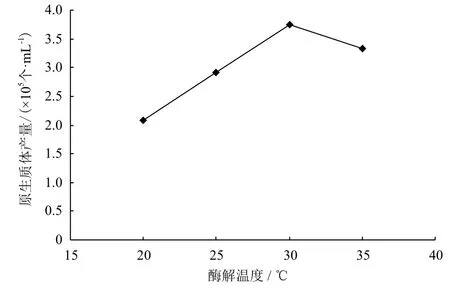
图2 酶解温度对原生质体产量的影响

表3 不同渗透压稳定剂对原生质体产量的影响
2.1.5 酶解时间 酶解2 h到3 h,菌丝断裂并膨胀,只有少数原生质体产生,之后原生质体产量随酶解时间延长而增加,直到酶解10 h时,原生质体产量达4.5×105个/mL(图3)。但因酶解8 h时有些许原生质体已开始破裂,故酶解10 h后不继续检测。
2.1.6 菌龄 菌丝团随培养时间的延长逐渐变得致密,14 d有黑色素生成。起初原生质体产量随着菌龄延长而增加,10 d时原生质体产量最多,达4.42×105个/mL。然而继续延长菌龄,原生质体产量急剧下降(图4)。

图3 酶解时间对原生质体产量的影响

图4 菌龄对原生质体产量的影响
2.2 原生质体释放方式
小花棘豆Embellisia内生真菌释放原生质体的方式有顶端释放、侧位释放和原位释放3种(图5)。顶端释放和侧位释放多发生在酶解反应初期,在菌丝体细胞壁较薄处出现孔洞,原生质体从此溢出。原位释放发生在酶解后期,菌丝段整个在原位形成球状体,单个或数个呈串珠状排列。
2.3 原生质体的再生
小花棘豆Embellisia内生真菌的原生质体在TB3再生培养基上生长良好。原生质体再生率与酶解反应时间的关系,见图6。酶解2 h时原生质体产量甚少,随酶解反应时间延长,再生率明显提高,酶解6 h时再生率最高,达46.7.3%,继续延长酶解反应时间,再生率下降。

图5 原生质体释放方式及收集纯化的原生质体

图6 酶解时间对原生质体再生率的影响
3 讨论
研究发现制备丝状真菌的原生质体时,混合酶的使用效果明显好于单一酶[19-21],本研究结果也支持该结论,小花棘豆Embellisia原生质体产量在一定范围内与酶浓度成正比,超过该浓度后,产量增加不明显,过高酶浓度则影响后续转化及再生[22,23]。
一些研究认为,制备原生质体的酶解反应时间超过3 h,原生质体产量开始下降,再生率降低[15,21]。然而本研究的酶解反应达10 h,原生质体数量依然增加,但酶解反应8 h后,一些原生质体已开始破裂,再生率下降;培养的内生真菌的菌龄超过一定时间后,其原生质体产量也明显下降,可能因为幼龄菌丝细胞壁成分及结构较简单,随菌龄增加,则细胞壁结构变得复杂化,且细胞开始分泌色素及其他次生代谢物质,影响了酶解反应效果,也可能降低了酶活性,从而使原生质体数量减少[24,25]。
原生质体再生率随原生质体浓度增加而提高,有些原生质体无再生能力,其原因一方面可能是在形成过程中内部物质分配不均匀,导致出现缺乏细胞核或其他细胞质物质,使原生质体无法再生;另一方面可能是原生质体酶解过于彻底,丧失了再生基础或原生质体在酶解过程中受到损伤[26,27]。
内生真菌如果培养在PDA液体菌丝培养基中,则获得的菌丝紧密抱团,不利于酶解反应进行和释放原生质体,且菌丝生长也比较缓慢。而在PDB培养基中真菌生长旺盛且菌丝团松散,菌丝体量足,即便不对菌丝体进行预处理也能获得数目较多的原生质体。本研究结果为后续外源基因的转化于表达奠定了良好的基础。在本次对该菌原生质体制备与再生条件优化基础上可进一步进行外源基因转化研究。
4 结论
不同酶解液成分、pH、温度、渗透压稳定剂、酶解时间及菌龄对小花棘豆Embellisia内生真菌原生质体产量有显著影响,各影响因子的最优条件组合可获得数目较多的原生质体。酶解时间显著影响原生质体再生率,酶解8 h时,获得的原生质体数量及其再生率均较高,故确定最佳酶解时间为8 h。
[1]赵一之, 刘丽. 内蒙古棘豆属Oxytropis植物区系生态地理分布特征[J]. 内蒙古大学学报:自然科学版, 1997, 28(2):199-211.
[2]史志诚. 动物毒物学[M]. 北京:中国农业出版社, 2001:1-429.
[3]王凯. 黄花棘豆对山羊的毒性研究[J]. 畜牧兽医学报, 1990,21(1):80-86.
[4]童德文, 曹光荣, 李绍军, 等. 甘肃棘豆中苦马豆素的分离与鉴定[J]. 西北农林科技大学学报, 2001, 29(3):62-68.
[5]杨鸣琦, 曹光荣. 苦马豆素的毒性、代谢与用途[J]. 动物医学进展, 1997, 18(4):20-25.
[6] 路浩, 王建军, 孙莉莎, 等. 苦马豆素抗肿瘤作用研究进展[J].动物医学进展, 2009, 30(9):87-90.
[7]卢萍. 内蒙古三种棘豆属植物中苦马豆素相关因子的研究[M].呼和浩特:内蒙古人民出社, 2008:1-164.
[8]卢萍, Child D, 赵萌莉, 等. 小花棘豆(Oxytropis glabra DC. )内生真菌的培养和鉴定[J]. 生态学报, 2009, 29(1):53:58.
[9]霍红雁. 小花棘豆内生真菌的培养、鉴定及其苦马豆素含量测定的分析[D]. 呼和浩特:内蒙古师范大学, 2010:1-43.
[10]王帅, 胡建军, 阿力木别克, 等. 南疆地区小花棘豆的营养成分分析[J]. 草业科学, 2010, 27(5):136-139.
[11] 米克热木·沙伊不扎提, 斯坎达尔·买合木提, 高超. 新疆小花棘豆营养成分的研究[J]. 草食家畜, 2013, 4:65-69.
[12] Atkins SD, Mauchline TH, Kerry BR, et al. Development of a transformation system for the nematophagous fungus Pochonia chiamydosporia[J]. Mycological Research, 2004, 108(6):654-661.
[13]张莉滟, 陈林, 张德纯. 保加利亚乳杆菌原生质体的制备与回复研究[J]. 中国微生态学杂志, 2004, 16(2):73-74.
[14]Mukherjee S, Dawe AL, Creamer R. Potential role for saccharopine reductase in swainsonine metabolism in endophytic fungus,undifilum oxytropis[J]. Fungal Biology, 2012, 116(8):902-909.
[15]刘士旺, 尤玉如, 黄俊, 等. 聚乙二醇介导木霉的原生质体转化[J]. 中国酿造, 2009, 202(1):35-38.
[16]宋庆涛, 张国珍, 董金皋. 玉米大斑病原菌原生质体的制备与再生[J]. 微生物学通报, 2003, 30(2):41-44.
[17]张萍, 马宗孚. 几种丝状真菌原生质体的形成与再生[J]. 云南大学学报:自然科学版, 1990, 1(3):255-261.
[18]Mukherjee S, Dawe AL, Creamer R, et al. Development of a transformation system in the swainsonine producing, slow growing endophytic fungus, Undifilum oxytropis[J]. Journal of Microbiological Methods, 2010, 81(2):160-165.
[19]伏建国, 强胜, 朱云枝. 链格孢菌原生质体的制备与限制性内切酶介导整合(REMI)转化的致病性诱变[J]. 菌物学报,2005, 24(3):407-413.
[20]陈清霞, 江贤章, 刘锦清, 等. 卷枝毛霉孢子原生质体的制备与再生[J]. 生物加工过程, 2011, 9(2):49-52.
[21]吕天晓, 徐凤花, 李世贵, 等. 生防木霉菌原生质体的制备及再生研究[J]. 生物技术通报, 2009(4):130-134.
[22]赵培宝, 周庆新, 郭芳先, 等. 限制性内切酶介导的串珠镰刀菌插入突变和致病性突变体的分离[J]. 植物病理学报,2007, 37(5):545-548.
[23]徐德峰, 赵海锋, 赵谋明. 曲霉原生质体的制备与非对称灭活[J]. 华南理工大学学报:自然科学版, 2010, 38(9):132-147.
[24]张志光, 李东屏, 方芳, 等. 丝状真菌原生质体技术研究[J].湖南师范大学自然科学学报, 1998, 21(1):60-65.
[25]赵竟男, 江梅, 苏晓庆. 灭蚊真菌贵阳腐霉原生质体的制备和再生研究[J]. 贵阳医学院学报, 2008, 33(2):111-114.
[26]陈飞, 关艳丽, 吴红艳, 等. 链霉菌11371原生质体的制备与再生[J]. 微生物学杂志, 2011, 31(5):54-58.
[27] 马恒德, 郭成金. 啤酒酵母原生质体制备与再生条件的筛选[J]. 中国酿造, 2012, 31(2):140-143.
(责任编辑李楠)
Preparation and Regeneration of Protoplasts Isolated from Embellisia Fungal Endophyte of Oxytropis glabra
Hu Jiya Lu Ping Niu Yanfang
(College of Life Science and Technology,Inner Mongolia Normal University,Hohhot010022)
The aim of this research is to obtain more active and larger amount of protoplasts of Embellisia fungal endophyte from Oxytropis glabra, investigate the optimal conditions of protoplast preparation and regeneration, and lay foundation for setting up later exogenous gene transformation system. The protoplasts are made by enzymes, and the influences on protoplast yield regarding different combined enzymes and their concentration, pH, temperatures, osmotic solutions, enzymolysis time and hyphal culture time were discussed. The protoplasts regenerated on TB3 medium were analyzed for understanding the impacts of different enzymolysis time on the regeneration. The protoplast concentration reached to 4.42×105/mL when medium mass was hydrolyzed by enzymes consisting of 2.5%(W/V)lysing enzymes, 2%(W/V)cellulose and 3%(W/V)helicase, the culture time was 10 days, the enzymolysis temperature was set to 30℃, the pH was 5.8, the 1.2 mol/L MgSO4solution was selected as osmotic stabilizer and the cultures were incubated in a flat shaker(80 r/min)for 8 h. The protoplast regeneration rate reached to 46.7% when enzymolysis time was 6 h.
Oxytropis glabra;fungal endophytes;protoplast;preparation and regeneration
10.13560/j.cnki.biotech.bull.1985.2015.05.021
2014-11-24
国家自然科学基金项目(30860049,31460235)
呼吉雅,女,硕士研究生,研究方向:植物及真菌分子生物学;E-mail:hujiya@yeah.net
卢萍,女,博士,教授,研究方向:植物及真菌分子生物学;E-mail:luping@imnu.edu.cn

