梁山慈竹(Dendrocalamus farinosus)竹秆水溶性多糖的分离提取及结构分析
姚 曦,岳永德,汤 锋(国际竹藤中心,北京100102)
梁山慈竹(Dendrocalamus farinosus)竹秆水溶性多糖的分离提取及结构分析
姚曦,岳永德,汤锋*
(国际竹藤中心,北京100102)
采用高效离子色谱法、凝胶色谱法分析了梁山慈竹竹秆多糖组成及分子量分布,结合傅立叶红外光谱、核磁波谱和热稳定性分析探讨了该多糖结构及性质。结果表明:水解后竹秆多糖组成是葡萄糖、阿拉伯糖、木糖、半乳糖和甘露糖,相对含量分别为40.57%、21.88%、19.89%、17.5%和0.15%。多糖的重均相对分子量Mw为16900 u,多分散性系数D(Mw/Mn)为1.33。该多糖具有典型多糖特征吸收峰,为吡喃型酸性多糖。热稳定性分析表明BCP在240℃开始发生降解,500℃基本结束。
梁山慈竹,竹秆,多糖,结构分析
现代研究表明,竹提取物具有良好的抗菌、抗氧化、抗衰老等功效,竹类资源的研究和利用正方兴未艾。在众多活性组分中,竹多糖是竹子中除黄酮类物质外一类重要地具有较好生物活性的大分子物质。从20世纪60年代起日本有学者就对竹叶多糖开展了相关研究,证实了竹叶多糖药用功效[1]。近年来,研究者们在竹多糖的提取分离[2-5]、多糖纯化[6-7]、组分分析[8-9]等方面取得了不少进展,在生物活性方面,竹多糖在增强机体免疫功能及抗肿瘤作用[10-11]、抗氧化功效[12-13]、抗疲劳作用[14]、降血糖作用[15]、保肝护肝[16]等方面也显示出良好的活性。在其他类植物多糖结构研究中应用较多的红外光谱(IR)[17]、核磁共振波谱(NMR)[18]等技术手段未见在竹叶多糖研究中有应用报道,关于竹多糖的结构分析仍处于空白,这也是与其他植物性多糖研究差距较大的地方。因此本文以梁山慈竹竹秆多糖(Bamboo culm polysacchride,BCP)为原料,分析其多糖组成、相对分子量及分布情况,结合红外光谱(FT-IR)和核磁共振(NMR)等手段对其进行结构表征,并考察BCP的热稳定性,为加强竹多糖的基础研究以及产品开发提供参考。
1 材料与方法
1.1材料与仪器
梁山慈竹(D.farinosus)竹秆样品于2010年5月采自于四川宜宾世纪竹种园。将采集的竹材,自然条件下于通风处室内阴干。将各竹秆切成约3 cm×2 cm长小块,用电动粉碎机加工成粉末,过60目筛,收集备用;单糖对照品(L-阿拉伯糖、L-葡萄糖、L-半乳糖、D-甘露糖、D-木糖)美国Sigma公司;其他试剂均为分析纯。
BP-221S电子天平(d=0.1 mg)德国Sartorius公司;EYELAN-1000旋转蒸发仪日本EYELA公司;LABCONCO Free Zone冷冻干燥仪美国LABCONCO公司;ICS3000高离子色谱仪配备脉冲安培检测器(PAD)及糖分析专用离子交换分析柱(PA-1,4× 250 mm),美国Dionex公司;Q500热重分析仪美国TA公司;Nexus傅立叶红外光谱仪美国Nicolet公司;Bruker AV300核磁共振波谱仪德国Bruker公司。
1.2实验方法
1.2.1竹秆多糖制备
1.2.1.1竹秆多糖的提取准确称取10 g竹秆粉末于具塞三角瓶中,以料液比1∶25,加入250 mL蒸馏水,于80℃下搅拌3 h。浸提液抽滤后浓缩滤液至100 mL。用80%乙醇沉淀过夜,4倍体积的Sevag试剂除蛋白,摇匀后以5000 r/min转速离心5 min,将沉淀冻干即得到竹秆多糖BCP。
1.2.1.2竹秆多糖的水解[19]取0.005 g多糖固体于棕色小瓶中,加入0.125 mL 72%H2SO4,1.35 mL超纯水;置于105℃烘箱中2.5 h(每30 min摇晃一次)。冷却,将样品溶液稀释50倍后,过0.22 μm亲水性滤头,滤除不溶物,再取1.5 mL于进样瓶中,待分析。
1.2.2分子量测定BCP的分子量测定采用高效凝胶色谱法(HPGPC)[20]。具体分析条件如下:Aguagel-OH(300 mm×7.5 mm,8 μm)色谱柱,示差检测器(RID),淋洗液为含有0.02 mol/L氯化钠的5 mmol/L磷酸钠缓冲液,pH为7.5,流速为0.5 mL/min,温度为30℃,样品浓度为0.1%,以已知分子量多糖标准品的保留时间做标准曲线来计算多糖样品的分子量水平。
1.2.3单糖组成分析采用高效凝胶渗透色谱法(HPGPC)[21]分析。淋洗液浓度为18 mmol/L NaOH并柱后加碱0.3 mol/L NaOH,流速为0.5 mL/min,分析时间为45 min,然后用0.2 mol/L NaOH冲洗色谱柱10 min,再用18 mmol/L NaOH以相同流速平衡色谱柱10 min。得到的色谱图与标准单糖的保留时间进行定性,外标法计算糖含量。
1.2.4红外光谱(FT-IR)分析[22]将BCP样品以1∶100比例同溴化钾混合后,在玛瑙研钵中磨至约200目粉末,在红外压片机上制成透明薄片,采用红外光谱仪配备DTGS(氘化硫三肽)热电检测器分析。扫描波长范围为4000~400 cm-1,共扫描64次,分辨率为2 cm-1。以纯溴化钾得到的红外光谱图作为背景。
1.2.5核磁共振波谱(NMR)分析[23]BCP样品用1 mL重水(D2O)溶解后在核磁共振仪上进行1H-NMR和13C-NMR分析,以四甲基硅烷(TMS)为内标物。核磁条件为氢谱(1H-NMR):脉冲程序(PULPROG):zg;驰豫延迟(D1):2.00000000 sec;采样通道1H高功率90°脉宽(P1):4.00 usec。碳谱(13C-NMR):脉冲程序(PULPROG):zgdc;驰豫延迟(D1):2.00000000 sec;采样通道1H高功率90°脉宽(P1):3.00 usec。
1.2.6热稳定性分析[22]BCP样品的热重(TGA)分析采用同步热分析仪测定。将10 mg样品置于铝坩锅中,在氮气的环境下,以10℃/min的加热速度从室温加热到600℃,连续记录样品的质量变化和放热数据而获得样品的热稳定性数据。
2 结果与分析
2.1得率及性状
经醇沉、离心冷冻干燥后,最终得到粗多糖98 mg,即梁山慈竹BCP含量为9.8 mg/g。其基本性状为:深红褐色,易溶于水、酸、碱等无机溶液;难溶于无水乙醇、丙酮等有机溶剂。其溶液呈中性,pH=7.0。
2.2分子量大小及分布
多糖样品的分子量由凝胶色谱仪在水相中测定。由结果知BCP样品的重均相对分子量Mw为16900 u,数均相对分子量Mn为12700 u,峰位分子量Mp为5503.5 u,多分散度D(Mw/Mn)为1.33。

图1 梁山慈竹BCP的分子量分布图Fig.1 Molecular weights distribution curves of D.farinosus’culm polysaccharides
2.3单糖组成分析
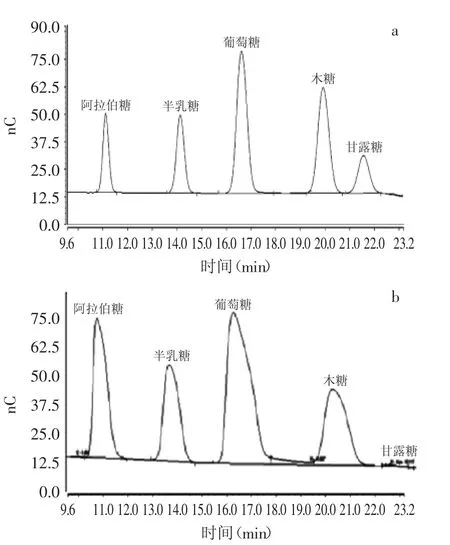
图2HPGPC分析图谱Fig.2 HPGPC analysis
图2(a)为5种单糖标准品色谱图,图2(b)为梁山慈竹BCP水解后离子色谱图。根据相应单糖标准样品的相对保留时间进行定性,根据面积归一化法计算各种单糖的含量占样品中总多糖量的百分比来定量,峰面积之比=质量比。由图2可知,梁山慈竹竹秆水溶性多糖由5种主要单糖组成的杂多糖,依次为阿拉伯糖(Ara)21.88%、半乳糖(Gal)17.5%、葡萄糖(Glu)40.57%、木糖(Xyl)19.89%以及极少量的甘露糖(Man)0.15%。
2.4红外光谱(FT-IR)分析
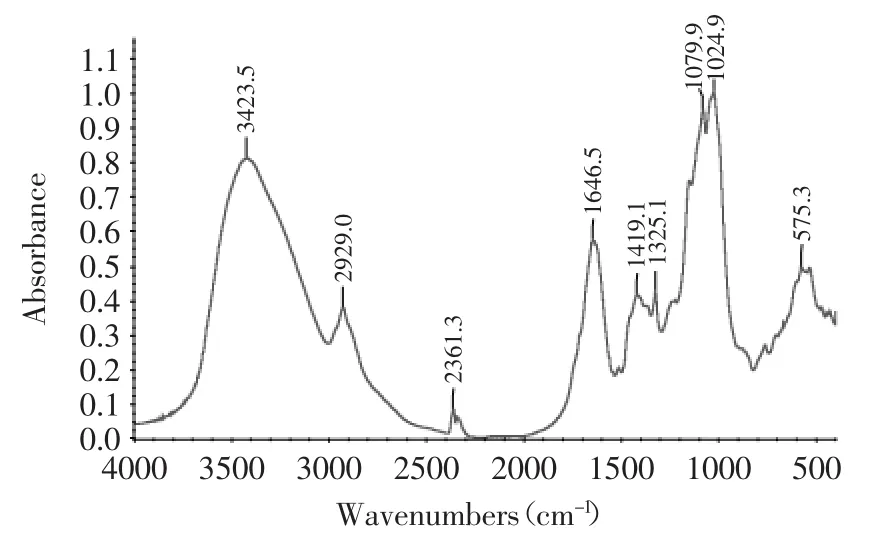
图3 梁山慈竹BCP的红外光谱图Fig.3 Infrared spectrum of D.farinosus’s polysaccharides
从红外光谱图上看(图3),BCP组分中含有的结构和基团及其特征吸收有:3423.5 cm-1处出现一个宽峰,是多糖羟基(O-H)的伸缩振动峰,表明多糖存在分子内的氢键;2929.0 cm-1处为一个弱的糖类亚甲基(C-H)的伸缩振动峰,也是糖类的特征峰;2361.3 cm-1处所形成的峰可能为结晶水结构形成的峰;1646.5 cm-1和1079.9 cm-1处的吸收峰则说明有羧酸的存在,可能为C=O的非对称伸缩振动;1419.1 cm-1和1325.1 cm-1处是由多糖C-H的变角振动引起的;1200~1100 cm-1的吸收峰为吡喃糖特征吸收峰,醚键(C-O-C)和羟基的吸收峰;1024.9 cm-1处的强吸收则是葡萄糖的特征吸收。950~1250 cm-1有强吸收峰,说明多糖组成是吡喃型,且含羧基,证明为酸性多糖。在460~670 cm-1间有一特征峰为对称环伸缩振动引起的。1700~1750 cm-1处没有特征吸收峰的存在证明样品中不含糖醛酸。红外光谱未见1616 cm-1的-NH2和-NH3的特征吸收峰,说明了不含蛋白多糖。在(817±70)cm-1处无吸收峰,表明不含酮糖[23]。
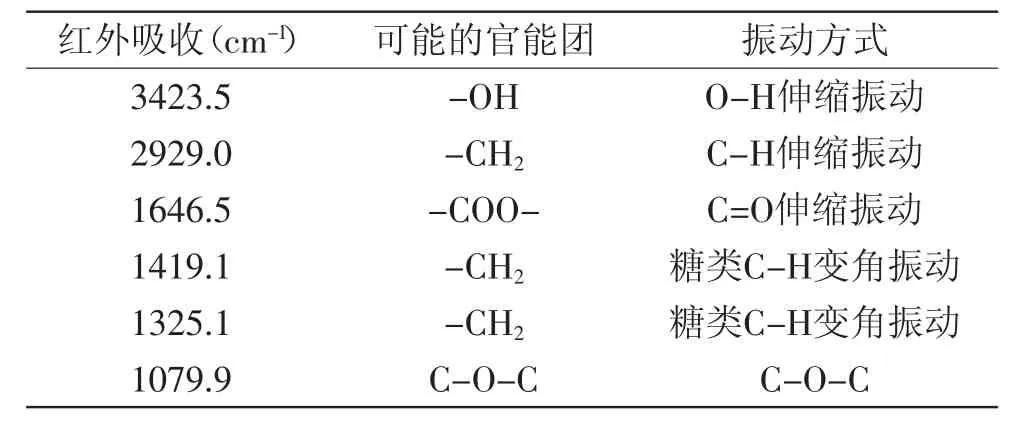
表1 梁山慈竹BCP的红外光谱解析Table 1 Results of IR absorption spectrum of polysaccharide
2.5核磁共振波谱分析
在BCP组分的13C核磁共振谱图如图4所示。从其碳谱可以看出,五个主信号δ102.08(C-1),δ75.98(C-4)、δ74.52(C-3)、δ73.06(C-2)和δ63.21 ppm(C-5)来自(1→4)木聚糖主链上的吡喃木糖基单元,另外一些较弱的信号δ86.37 ppm、δ78.40 ppm、δ73.48 ppm、δ72.25 ppm、δ59.68 ppm来源于阿拉伯糖单元。
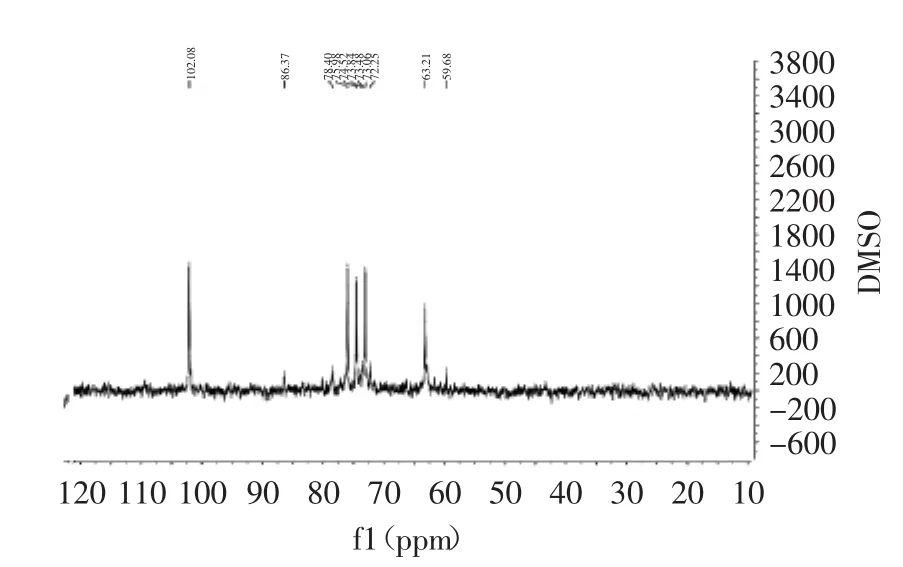
图4 梁山慈竹BCP的13C NMR谱图Fig.4 13C NMR spectra of D.farinosus’s polysaccharides
δ18 ppm附近未出现碳信号,说明该多糖中不含鼠李糖,与2.3中单糖组成分析一致。1HNMR谱可用于确定多糖中糖残基的糖苷键构型。一般来说,呋喃型阿拉伯糖单元特征峰在δ5.2~5.4 ppm区间出现,而吡喃型木糖单元特征峰在δ4.4~4.7 ppm出现。BCP组分的1H核磁共振谱图被记录并显示如图5所示。在δ5.1有一较弱信号,而在C1上的质子H1的强吸收峰在δ4.61,说明竹秆多糖符合吡喃型木糖单元特征,也与红外分析结果一致。主要信号分别为δ4.15、δ3.79、δ3.48、δ3.22、δ3.09、δ3.00 ppm来自未取代的(1→4)-β-D-木糖单元。
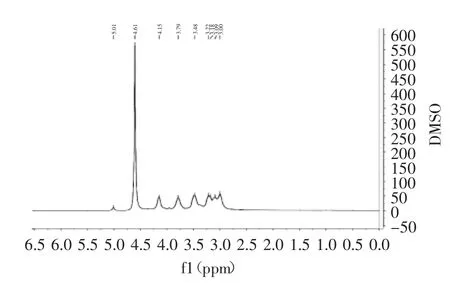
图5 梁山慈竹BCP的1H NMR谱图Fig.5 1H NMR spectra of D.farinosus’s polysaccharides
2.6热稳定性分析
研究表明,大部分植物多糖在220℃左右开始降解,最快降解速度多发生260~320℃之间。从热重分析曲线上可以看出(图6),降解过程主要分为4个阶段:从室温到240℃的第一阶段,共失重约5%,可能是水分或其他易挥发物的损失;第二阶段是大分子聚合物的降解,在240~340℃温度区间,积分结果显示,梁山慈竹BCP在274℃前后降解速度最快,此阶段BCP的质量损失大约为65%;第三阶段当温度达到500℃时,BCP的质量缓慢地损失至73%;此后随着温度的升高,BCP样品最终成了碳化结构。

图6 梁山慈竹BCP的热重分析曲线Fig.6 The TGA curves of the polysaccharide isolated from the D.farinosus
3 结论
高效离子色谱法(HPIC)测定了梁山慈竹竹秆多糖中各单糖的种类及构成比例,该多糖中葡萄糖含量最高(相对含量为40.57%),其次是由阿拉伯糖、木糖、半乳糖和甘露糖(21.88%、19.89%、17.5%和0.15%)等5种单糖组成。高效凝胶色谱法(HPGPC)测定出纯化后的该多糖的重均相对分子量Mw为16900 u,多分散度D(Mw/Mn)为1.33,多分散度越接近1,表明该多糖的高聚物分子量分布范围较窄,纯度较高[24]。红外光谱和核磁波谱鉴定表明其具有多糖的特征吸收峰,并具有吡喃型酸性多糖特征。热稳定性分析表明该多糖在240℃开始发生降解,500℃基本结束。上述结果为竹多糖的进一步深入研究奠定基础。
[1]Kazumori K,Sakakibara A.Studies on the anti-tumor effect of polysaccharides from bamboo grass(Sasa kurilensis)[J].Plant physiology and biochemistry,1977,34(2):305-325.
[2]李胜华,郁建平.竹叶多糖的提取工艺[J].吉首大学学报:自然科学版,2006,27(1):118-121.
[3]王晋,杜华,王鲁石.淡竹叶多糖的超声提取及含量测定[J].中成药,2004,26(12):1067-1068.
[4]周跃斌,王伟,李适,等.竹叶多糖提取条件的优化[J].湖南农业大学学报:自然科学版,2006,32(2):206-209.
[5]晁红娟,高荫榆,丁红秀,等.酶法中试提取毛竹叶、柄中多糖和类黄酮的研究[J].食品科学,2007,28(12):208-211.
[6]周跃斌,周向荣,王伟.毛竹竹叶多糖分离与纯化技术研究[J].食品科学,2008,29(7):156-159.
[7]李志洲.淡竹叶多糖的提取及体外抗氧化活性研究[J].中成药,2008,30(3):434-437.
[8]丁玉强,陈春英,Elmahadi E A,等.箬叶水溶性多糖的色谱研究[J].色谱,1996,14(6):470-472.
[9]唐莉莉,丁霄霖.竹叶多糖的分离提取及其生物活性研究[J].食品研究与开发,2000,21(1):8-10.
[10]周跃斌,周向荣,王伟.毛竹叶水溶性多糖BPS1_1的色谱研究[J].食品科学,2008,29(8):184-187.
[11]Mulloy B,Mourao P A,Gray E.Structure/function studies of anticoagulant sulphated polysaccharides using NMR[J].Journal of Biotechnology,2000,77(1):123-135.
[12]Chen Chunying,Ding Yuqiang,Elmahadi E,et al.International symposium on natural antioxidants[C].Molecular mechanism and health effects,Beijing,1995:265.
[13]丁红秀,高荫榆,晁红娟,等.毛竹叶多糖体内抗氧化作用研究[J].食品科学,2008,29(5):427-430.
[14]丁红秀,高荫榆,晁红娟,等.毛竹叶多糖抗疲劳作用研究[J].食品科学,2008,29(4):389-391.
[15]丁红秀,高荫榆,晁红娟,等.毛竹叶柄多糖降血糖作用研究[J].食品科学,2007,28(12):446-449.
[16]Elmahadl E A,Chen Chunying,Ding Yuqiang,et al. Internationalsymposiumonnaturalantioxidants.Molecular mechanism and health effects[C].Beijing,1995:302.
[17]Nicola V.Milligram-scale preparation and purification of oligosaccharides of defined length possessing the structure of chondroitin from defructosylated capsularpolysaccharideK4[J]. Glycobiology,2003,13(9):635-640.
[18]Mulloy B,Mourao P A,Gary E.Structure/function studies of anticoagulant sulphated polysaccharides using NMR[J].Journal of Bio-technology,2000,77(1):123-135.
[19]王堃.木质生物质预处理、组分分离及酶降糖化研究[D].北京:北京林业大学,2011.
[20]张志花,方积年.云芝糖肽在高效液相凝胶柱上色谱行为的研究[J].色谱,1997,15(2):150-152.
[21]Sun Yuanli,Tang Jian,Gu Xiaohong,et al.Water-soluble polysaccharides from Angelica sinensis(Oliv.)Diels:Preparation,characterizationandbioactivity[J].InternationalJournalof Biological Macromolecules,2005,36:283-289.
[22]王坤.多花黄精多糖的分离制备及其结构研究[M].北京:中国林业科学研究院,2013.
[23]谢晶曦,常俊标,王绪明.红外光谱在有机化学和药物化学中的应用[M].北京:科学出版社,2001:457.
[24]骆传环,黄荣清,肖炳坤,等.香姑多糖的分子量测定[J].科学技术与工程,2006,6(8):1058-1060.
Extraction and structure analysis on polysaccharide of Dendrocalamus farinosus culm
YAO Xi,YUE Yong-de,TANG Feng*
(International Centre for Bamboo and Rattan,Beijing 100102,China)
The polysacchride was extracted from Dendrocalamus farinosus culms with hot water,and precipitated by ethanol.The polysacchride was composed of glucose,arabinose,xylose,galactose and mannose with the contents of 40.57%,21.88%,19.89%,17.5%and 0.15%respectively by high performance ion chromatography(HPIC).The average molecular weights(Mw)of the polysacchride was 16900 u and the polydispersity was 1.33. Infrared spectrogram showed that the polysacchride had the characteristic absorption peak of polysaccharides.1HNMR and13CNMR indicated that its main chains were composed of β-pyranglycoside linkage.Thermal analysis showed that the polysacchride fraction began to degrade at 240℃ and the degradation ended at 500℃.
Dendrocalamus farinosus;bamboo culm;polysaccharides;structural analysis
TS207.3
A
1002-0306(2015)20-0120-04
10.13386/j.issn1002-0306.2015.20.016
2015-03-09
姚曦(1981-),男,博士,助理研究员,研究方向:植物化学、食品分析,E-mail:yaoxi@icbr.ac.cn。
汤锋(1969-),男,博士,教授,研究方向:植物化学、生物农药,E-mail:fengtang@icbr.ac.cn。
“十二五”国家科技支撑计划项目(2012BAD23B03)。

