荔枝果肉苯丙氨酸解氨酶特性的研究
薛楚然,刘树文,*,卜 潇,严 俊,徐向文(.西北农林科技大学葡萄酒学院,陕西杨凌700;.广东为多生物科技有限公司,广东茂名55000)
荔枝果肉苯丙氨酸解氨酶特性的研究
薛楚然1,刘树文1,*,卜潇1,严俊1,徐向文2
(1.西北农林科技大学葡萄酒学院,陕西杨凌712100;2.广东为多生物科技有限公司,广东茂名525000)
研究了荔枝果肉中苯丙氨酸解氨酶(L-phenylalanine ammonia-lyase,PAL)的酶学特性。荔枝PAL动力学曲线并不遵循米氏方程,其最适底物浓度为2 mmol/L。在硼砂-硼酸缓冲液中,荔枝PAL的最适反应pH为8.7。PAL不耐酸碱,尤其不耐酸。荔枝PAL的最适反应温度为45℃,高于75℃则易于钝化,具有较强的耐热性。L-酪氨酸和L-半胱氨酸对荔枝PAL均有明显的抑制作用;金属离子中,Fe2+和Fe3+对荔枝PAL活性具有明显的促进作用,而Ca2+、Cu2+、Co2+、Ag+离子则对其活性有明显的抑制作用。
荔枝,苯丙氨酸解氨酶(PAL),酶学特性
荔枝(Litchi chinensis Sonn.)为我国亚热带地区的特有水果,因其具有丰富的营养价值和独特而优雅的风味,独享“果中之王”的称号。然而,荔枝在储藏和加工过程中极易出现褐变现象,使得产品的品质和营养成分受到损失。导致荔枝及其产品褐变的主要原因是参与氧化反应的各类酶,如多酚氧化酶、过氧化物酶、苯丙氨酸解氨酶等[1-2]。目前已有许多探究荔枝果肉多酚氧化酶、过氧化物酶的酶学性质的研究[3-4],然而荔枝果肉中苯丙氨酸解氨酶的性质研究仍是空白。
苯丙氨酸解氨酶(L-phenylalanine ammonialyase,PAL;EC 4.3.1.5)催化直接脱掉L-苯丙氨酸上的氨而生成反式肉桂酸,是植物体内苯丙烷类代谢的关键酶,也是苯丙烷类代谢途径中研究最多的酶。PAL与一些重要的次生物质如木质素、黄酮类物质的合成有关,为多种酚类及类黄酮终产物提供前体[5-6]。由于苯丙氨酸解氨酶与酚类物质的合成紧密相关,因而也是影响荔枝及其加工产品酶促褐变的重要因素。本文通过对荔枝果肉苯丙氨酸解氨酶(PAL)进行提取并研究其相关酶学性质,为荔枝酶促褐变机理研究提供一定的理论基础。
1 材料与方法
1.1材料与仪器
荔枝2014年6月采摘于广东省茂名市,品种黑叶;L-苯丙氨酸梯希爱(上海)化成工业发展有限公司,HPLC 98%;EDTA-Na2上海正极生物科技有限公司,分析纯;β-巯基乙醇行知生物科技有限公司;硼砂、硼酸上海江莱生物科技有限公司,分析纯;L-酪氨酸、L-半胱氨酸北京达科为生物技术有限公司HPLC 98%。
UV-2450 SPECTROPHOTOMETER型紫外分光光度计日本SHIMADZU公司;Sorvall RC5C Plus型冷冻高速离心机美国Thermo Scientific公司;AUY220型电子分析天平日本SHIMADZU公司;
1.2实验方法
1.2.1原料预处理取成熟度适中,果实饱满且无病害的荔枝果实为原料。将果实去皮、去核,于-20℃下冷冻保存。
1.2.2荔枝PAL酶液的提取参照Koukol等[7]的方法加以修改。取50 g冷冻保存的荔枝果肉,分两次加入共50 mL预冷的硼砂-硼酸缓冲液(0.2 mol/L硼酸根,pH8.7,含1 mmol/L EDTA,20 mmol/L β-巯基乙醇),加入石英砂,冰浴研磨。将研磨而成的匀浆经4层纱布过滤,滤液4℃,12000 r/min离心20 min,上清液即为酶粗提液,4℃下保存备用。
1.2.3荔枝PAL活性的测定参照Koukol[7]和Solecka等[8]的方法,略加修改。在10 mL反应体系中,包含pH8.7硼砂-硼酸缓冲液、底物L-苯丙氨酸和PAL粗酶液(各成分的具体体积因不同实验因素而异,见下文),并平均分为两份。一份在加入PAL酶液后立即以200 μL HC1溶液(6 mol/L)终止反应,另一份于45℃保温60 min后,以200μL HC1溶液(6 mol/L)终止反应,分别测定两份反应溶液在290 nm处光吸收值,即A290nm。以不加L-苯丙氨酸的反应体系(以蒸馏水替代)为参比,并以加入酶液煮沸后来验证反应是由酶液引起的。以每小时生成的肉桂酸的量来表示酶活性。以反应体系每小时A290nm增加0.01为一个酶活性单位(U),PAL活性按以下公式计算后,单位为U·g-1·h-1:
在这种社会中,个体显然无法凭自己的才智和机会满足需求、实现价值。然而,追求满足的本能冲动之火永不熄灭,只好随波逐流,处心积虑构建自己的关系网、人际圈。整个社会因此陷入一种恶性循环,成为一种可怕的“大染缸”、“大酱缸”。[17]在当下中国,如果“熟人社会”任其过分发育和延伸,必然导致对法制社会的腐蚀、市场经济的摧残、和谐社会的瓦解。所以,我们应当而且必须要实现从“熟人社会”向“陌生人社会”的转型。
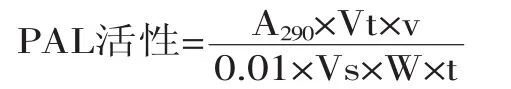
式中,Vt:酶液总体积(mL);W:样品鲜重(g);Vs:测定时取酶液的量(mL);v:反应液总体积(mL);t:反应时间(h)。
1.2.4底物浓度对荔枝PAL活性的影响10 mL反应体系中,分别加入硼砂-硼酸缓冲液(pH8.7)8.95、8.9、8.8、8.6、8.2、7.4、5.8 mL,各加PAL酶液1 mL,再分别加L-苯丙氨酸溶液(0.1 mol/L)0.05、0.1、0.2、0.4、0.8、1.6、3.2 mL,使底物终浓度分别为0.5、1、2、4、8、16、32 mmol/L。将反应体系置于45℃保温60 min,测定290 nm处光吸收值。
1.2.5酶液体积分数对荔枝PAL活性的影响10 mL反应体系中,分别加入硼砂-硼酸缓冲液(pH8.7)8.8、8.4、8.0、7.6、7.2、6.8、6.4、6.0、5.6 mL,各加L-苯丙氨酸溶液(0.1 mol/L)1 mL,再依次加入PAL酶液0.2、0.6、1.0、1.4、1.8、2.2、2.6、3.0、3.4 mL,使体系中酶液体积分数分别为2%、6%、10%、14%、18%、22%、26%、30%、34%。将反应体系置于45℃保温60 min,测定290 nm处光吸收值。
1.2.6pH对荔枝PAL活性的影响取pH为7.4、7.6、7.8、8.0、8.2、8.4、8.7、9.0的硼砂-硼酸缓冲液8.9 mL,各加入L-苯丙氨酸溶液(0.1 mol/L)0.1 mL和PAL酶液1 mL,45℃保温60 min,测定290 nm处光吸收值。另外将酶液置于pH4.0(磷酸氢二钠-柠檬酸缓冲液)、pH6.0(磷酸缓冲液)、pH10.0(硼砂-氢氧化钠缓冲液)缓冲体系中保温5、10、20、30、60 min后,按照1.2.3所述方法测定PAL活性。
1.2.7温度对荔枝PAL活性的影响将反应体系(pH8.7硼砂-硼酸缓冲液8.9 mL,L-苯丙氨酸溶液0.1 mL,PAL酶液1 mL)分别置于25、35、45、55、65、75、85、100℃温度下保温60 min,测定290 nm处光吸收值。将酶液分别置于25、35、45、55、65、75、85、100℃温度下分别保温5、10、20、30 min后取出,按照1.2.3所述方法测定PAL活性。
1.2.8氨基酸和金属离子对荔枝PAL活性的影响将反应体系(pH8.7硼砂-硼酸缓冲液8.9 mL,L-苯丙氨酸溶液0.1 mL,PAL酶液1 mL)中分别加入不同浓度的L-酪氨酸、L-半胱氨酸,或分别加入2 mmol/L的金属离子(Na+,Mg2+,Ca2+,Cu2+,Fe3+,Fe2+,Co2+,Mn2+,Ag+,Zn2+等),45℃保温60 min,测定290 nm处光吸收值。1.2.9数据处理本文中所有实验均进行三次重复,实验结果利用SPSS 19.0软件进行分析;利用Origin 8.5作图软件进行作图。
2 结果与分析
如图1所示,随着底物浓度的升高,荔枝PAL活性呈先上升后下降的趋势,并在底物浓度为2 mmol/L时达到最大值。有研究表明,大多数生物的PAL动力学曲线并不遵循米氏方程,但也有个别生物如粘红酵母的L-PAL在底物为NH4+时的酶促反应符合经典的米氏方程[9-10]。本研究表明,荔枝PAL动力学曲线同样不遵循米氏方程,当底物浓度高于2 mmol/L时将抑制酶活性,这与江力等[11]对山药PAL性质的研究结果相似。目前已纯化分离的多数植物中PAL的Km值在0.3×10-4~1.5×10-2mol/L[12],有一些植物则具有两个Km值,如小麦和油菜等[13-14]。
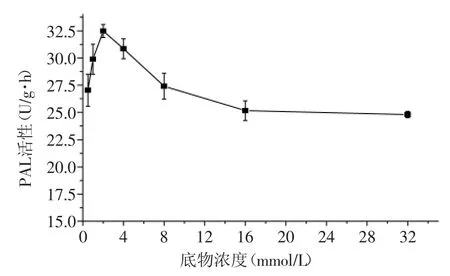
图1 底物浓度对荔枝PAL活性的影响Fig.1 The effect of substrate concentration on the activity of Litchi PAL
2.2酶液体积分数荔枝PAL活性的影响
本研究中,以10 mL反应体系中所含荔枝PAL酶提取液的体积分数表示酶浓度。如图2所示,随着反应体系中PAL酶液体积分数的增加,PAL活性也随之上升。当体积分数小于26%时,其活性增加的速度较快,而当大于26%后,则活性增加的趋势渐缓。这主要是由于底物含量一定的情况下,酶量增大到一定值后活性便不再升高。

图2 酶液体积分数对荔枝PAL活性的影响Fig.2 The effect of enzyme volume fraction on the activity of Litchi PAL
2.3荔枝PAL最适pH及pH适应性
由图3可以看出,从pH7.4~8.2,荔枝PAL的活性处于上升趋势,并于pH8.2时达到第一个最大值。pH8.4时,PAL活性降低,并在pH8.7时达到第二个最大值。这种趋势可能是由于在荔枝果肉中存在苯丙氨酸解氨酶的同工酶。不同来源的PAL最适pH在8.0~9.5之间,如红酵母和鹰嘴豆的最适pH分别为8.5[13]和9.4[15],而小麦和水稻的最适pH分别为8.8和9.2[12]。
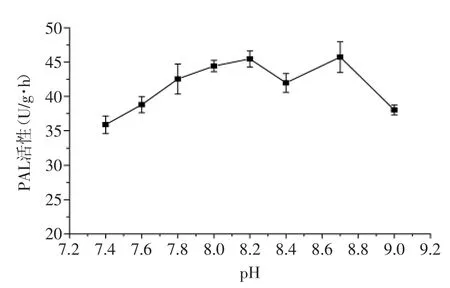
图3 荔枝PAL的最适反应pHFig.3 The optimum pH value for Litchi PAL
如图4所示,荔枝果肉PAL不耐酸碱。在pH4.0时,水浴5 min后PAL活性则降低至45%,而水浴60 min后几乎丧失全部活性;pH6.0时,水浴5 min后PAL活性仍保持67%左右,30 min后活性降低至27%,而60 min后活性低于20%;在碱性条件下(pH10.0),荔枝PAL活性始终高于酸性条件,在水浴10min后仍具有66%的活性,但60 min后活性降低至15%左右,与pH6.0下水浴60 min后得到的活性相近。pH对PAL有两方面的影响:一方面过酸或过碱改变酶的空间构象,使酶失活;另一方面pH改变底物的解离状态,影响它与酶的结合,从而影响酶催化的效率。从图4可知,荔枝PAL在pH4.0、6.0、10.0的条件下水浴保温5 min后,即使将反应pH恢复至最适值,酶活性均有所降低。说明酸碱环境可使荔枝PAL的空间构象改变,导致酶失活。因此,在荔枝产品的保藏保鲜过程中,可以通过添加食用酸等食品添加剂来改变环境pH,抑制PAL活性,从而减少褐变的产生。
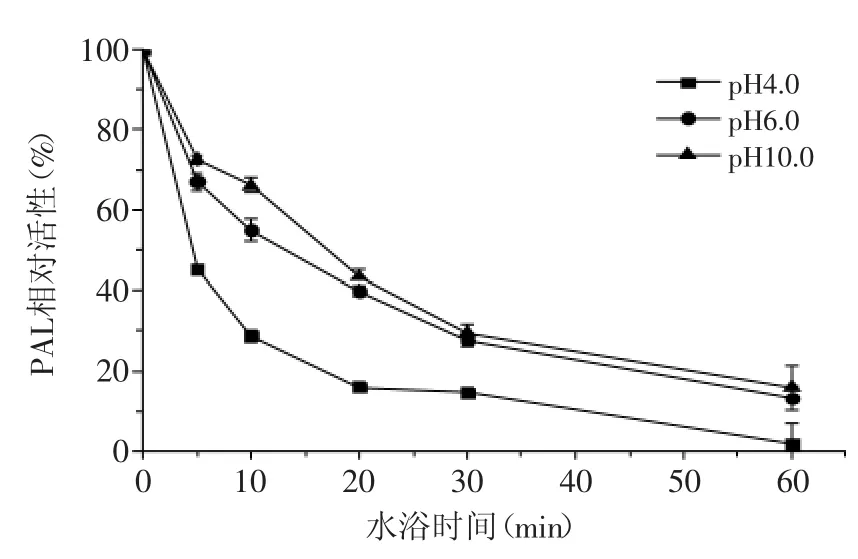
图4 荔枝PAL对pH的稳定性Fig.4 The stability of Litchi PAL on different pH values
2.4荔枝PAL最适反应温度及温度适应性
如图5所示,在25~100℃的温度范围内,荔枝PAL的最适反应温度为45℃,高于或低于该温度均可使酶活降低。图6显示了荔枝PAL对不同温度的适应性。可以看出,在25~55℃的温度范围内,PAL活性基本没有受到抑制,在55℃下水浴30 min后,其活性仍保持在80%左右。而从65℃开始,荔枝PAL活性受到明显抑制,在65~100℃水浴30 min后,酶活性分别剩余53%、30%、13%和6%。荔枝PAL在高温下仍保留了一定的活性,说明其具有较强的耐热性,但温度高于75℃时荔枝PAL容易钝化。有研究表明,百合鳞茎PAL在80℃水浴5 min后仍有大于80%的活性[16],甘蓝型油菜PAL在70℃保温5 min后仍有70%左右的活性[14]。而本研究中,在85℃和100℃水浴5 min后,荔枝PAL残余活性分别为43%和30%,耐热性较高。
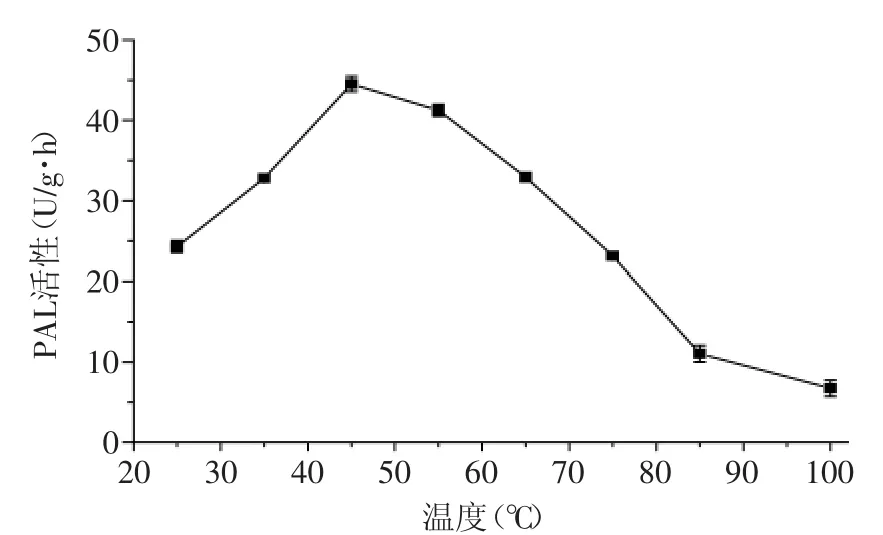
图5 荔枝PAL的最适反应温度Fig.5 The optimum temperature for Litchi PAL

图6 荔枝PAL对温度的稳定性Fig.6 The stability of Litchi PAL on different temperature
2.5氨基酸和金属离子对荔枝PAL活性的影响
L-酪氨酸和L-半胱氨酸均对荔枝PAL的活性具有明显的抑制作用,且抑制作用随氨基酸浓度增大而增强(图7和图8)。在供试范围内,L-酪氨酸和L-半胱氨酸分别在浓度为1.0 mmol/L和12 mmol/L时,对荔枝PAL活性具有最强的抑制效果。有报道指出,L-酪氨酸和L-半胱氨酸分别是苯丙氨酸解氨酶的竞争性抑制剂和硫氢基类抑制剂。前者的抑制作用机理是与底物竞争苯丙氨酸解氨酶的结合能力[17],而后者的作用机理可能是对脱氢丙氨酰残基的修饰,这种抑制作用与酶活性部位脱氢丙氨酰基的丧失和减少相伴随。
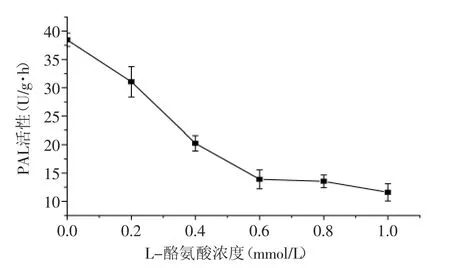
图7 L-酪氨酸对荔枝PAL活性的影响Fig.7 The effect of L-Tyrosine on the activity of Litchi PAL
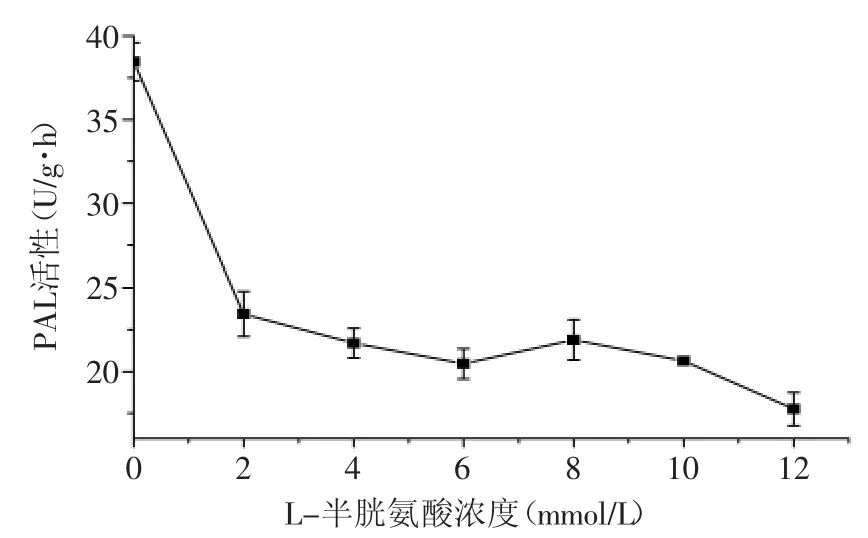
图8 L-半胱氨酸对荔枝PAL活性的影响Fig.8 The effect of L-Cysteine on the activity of Litchi PAL
固定浓度下(2 mmol/L),金属离子对荔枝PAL活性的影响差异明显(图9)。Na+、Fe2+和Fe3+促进了酶的活性,其中Fe3+离子的促进效果最明显(159.43%)。其余金属离子均对荔枝PAL有抑制作用,其中Ag+离子的抑制效果最强(PAL相对活性9.32%)。Mg2+离子对于荔枝PAL的活性有微弱的抑制作用,但对于红酵母却有一定的促进作用[13]。
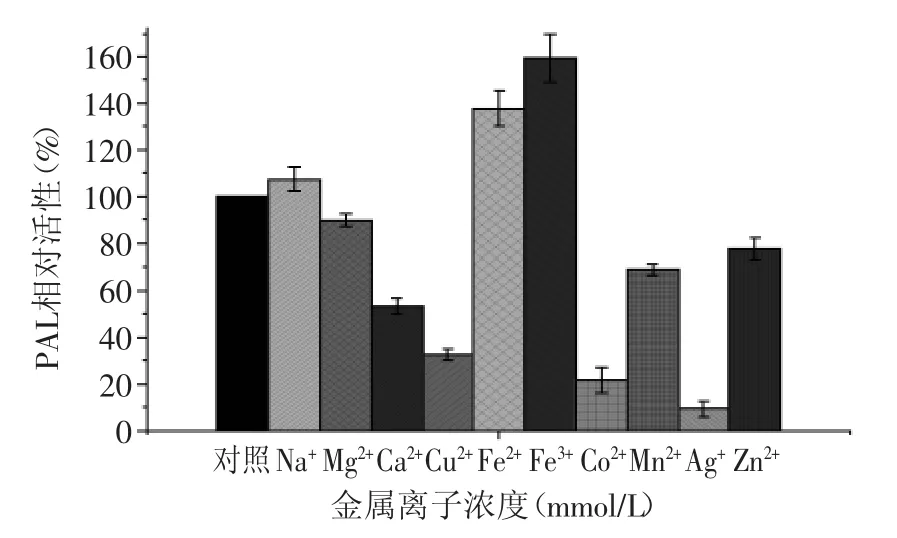
图9 金属离子对荔枝PAL活性的影响Fig.9 The effect of different ion on the activity of Litchi PAL
3 结论
荔枝果肉苯丙氨酸解氨酶(PAL)最适底物浓度为2 mmol/L,荔枝PAL活性随着反应体系中酶液体积分数的增加而呈线性增大。荔枝PAL的最适反应pH为8.7,且pH为8.2时其活性也处于高峰。荔枝PAL不耐酸碱,尤其不耐酸。荔枝PAL的最适反应温度为45℃,在25~55℃温度范围内活性稳定,超过75℃则容易钝化。L-酪氨酸和L-半胱氨酸对于荔枝PAL活性均有明显的抑制作用,在本研究中,二者分别在浓度为1 mmol/L和12 mmol/L时抑制作用最强。金属离子中,Fe2+和Fe3+对荔枝PAL活性具有明显的促进作用,而Ca2+、Cu2+、Co2+、Ag+离子则对其活性有明显的抑制作用。
[1]陈瑞琴,刘宝华,王果,等.不同荔枝品种采后果皮褐变与多酚氧化酶关系的研究[J].热带作物学报,2012,33(7):1261-1266.
[2]冯卫华,林丽棉,秦艳,等.荔枝与荔枝酒褐变控制[J].食品科学,2011,32(4):246-250.
[3]刘春丽.荔枝果肉过氧化物酶酶学性质研究[J].西南农业学报,2012,25(2):424-428.
[4]刘春丽,杨跃寰,陈欲云,等.荔枝果肉多酚氧化酶酶学性质研究[J].安徽农业科学,2011,39(2):646-648.
[5]阳光察,薛应龙.植物苯丙烷类代谢的生理意义及其调控[J].植物生理学通讯,1988,24(3):9-16.
[6]Ritter H,Schulz GE.Structural basis for the entrance into the phenylpropanoidmetabolismcatalyzedbyphenylalanine ammonia-lyase[J].The Plant Cell,2004,16(12):3426-3436.
[7]Koukol J,Conn E E.The metabolism of aromatic compounds in higher plants.Ⅳ.Purification and properties of the phenylalanine deaminase of Herdeum vulagare[J].Journal of Biology and Chemistry,1961,236:2692-2698.
[8]Solecka D,Kacperska A.Phenylpropanoid deficiency affects the course of plant acclimation to cold[J].Physiologia Plantarum,2003,119:253-262.
[9]张宽朝,金青,蔡永萍,等.苯丙氨酸解氨酶与其在重要次生代谢产物调控中的作用研究进展[J].中国农学通报,2008,24(12):59-62.
[10]Bolwell G P,Bell J N,Cramer C L,et al.L-phenylalanine Ammonia-lyase from Phaseolus vulgaris[J].European Journal of Biochemistry,1985,149:11.
[11]江力,袁怀波,张世杰,等.山药苯丙氨酸解氨酶特性的研究[J].食品科学,2006,27(10):36-40.
[12]江柯,卢涛,赵德立,等.红酵母苯丙氨酸解氨酶的分离纯化及性质研究[J].四川大学学报:自然科学版,2004,41(4):865-868.
[13]欧阳光察,应初衍,沃绍根,等.植物苯丙氨酸解氨酶的研究.Ⅵ.水稻、小麦PAL的纯化及基本特性[J].植物生理学报,1985,11(2):204-214.
[14]姜红林,梁颖.甘蓝型油菜苯丙氨酸解氨酶的分离纯化与性质研究[J].中国农学通报,2006,22(7):282-286.
[15]孟延发,辛嘉英.植物苯丙氨酸解氨酶的研究:1.鹰嘴豆PAL的纯化及其基本性质[J].兰州大学学报:自然科学版,1990,26(3):109-113.
[16]孙红梅,赵爽,王春夏,等.百合鳞茎苯丙氨酸解氨酶的分离纯化及酶学性质研究[J].园艺学报,2008,35(11):1653-1660.
[17]程水源,陈昆松,刘卫红,等.植物苯丙氨酸解氨酶基因的表达调控与研究展望[J].果树学报,2003,20(5):351-357.
Study on enzymology properties of L-phenylalanine ammonia-lyase(PAL)in litchi fruit
XUE Chu-ran1,LIU Shu-wen1,*,BU Xiao1,YAN Jun1,XU Xiang-wen2
(1.College of Enology,Northwest A&F University,Yangling 712100,China;2.Guangdong Weiduo Biotechnology Co.,Ltd.,Maoming 525000,China)
The enzymology properties of L-phenylalanine ammonia-lyase(PAL)was investigated in this study. Litchi PAL dynamic curve did not follow the Michaelis-Menten equation.The optimum substrate concentration was 2 mmol/L.In the borax-boric acid buffer,the optimum reaction pH value was 8.7.Litchi PAL did not resistant to acid and alkali,especially to acid.The optimum reaction temperature was 45℃,and if the temperature was higher than 75℃,Litchi PAL was easily passivated.Litchi PAL had strong heat resistance.L-tyrosine and L-cysteine had significant inhibitory effect on Litchi PAL.Among the metal irons,Fe2+and Fe3+had significant promoting effect on PAL,while Ca2+,Cu2+,Co2+and Ag+had significant inhibitory effect on Litchi PAL.
Litchi;L-phenylalanine ammonia-lyase(PAL);enzymology characteristics
TS201.1
A
1002-0306(2015)20-0206-05
10.13386/j.issn1002-0306.2015.20.035
2015-03-01
薛楚然(1989-),女,硕士研究生,研究方向:荔枝与荔枝酒褐变机理及其控制,E-mail:xuechuran@hotmail.com。
刘树文(1965-),男,博士,教授,研究方向:葡萄酒酿造工艺、葡萄酿酒微生物,E-mail:liushuwen@nwsuaf.edu.cn。
广东省教育部产学研结合项目资助资金(2011A01003);茂名市重大科技专项资助资金(2009B090300133)。

