腺病毒介导IL-24基因诱导皮肤鳞状细胞癌细胞COLO 16的凋亡
马欣欣 张孟丽 李玲君 曹玉萍 吴秋菊 马鹏程
腺病毒介导IL-24基因诱导皮肤鳞状细胞癌细胞COLO 16的凋亡
马欣欣 张孟丽 李玲君 曹玉萍 吴秋菊 马鹏程
目的 探讨腺病毒介导IL-24基因表达载体(Ad-IL-24)对皮肤鳞状细胞癌(鳞癌)细胞COLO 16的凋亡的影响,并探讨其作用机制。方法 将构建的Ad-IL-24腺病毒感染COLO 16细胞,qPCR法检测IL-24基因的表达,MTT法检测IL-24过表达对细胞生长的影响,流式细胞仪检测IL-24过表达对COLO 16细胞凋亡的影响,激光扫描共聚焦显微镜观察在IL-24过表达后COLO 16细胞凋亡的形态变化,Western印迹检测Bax,Bcl-2以及活化的caspase 3蛋白水平,qPCR法检测Bax、Bcl-2基因mRNA的表达,免疫荧光方法,检测IL-24过表达后Bax,Bcl-2的表达情况。结果 MTT结果显示,Ad-IL-24组的细胞从第4天开始出现明显抑制,第6天差异最明显(P<0.05),并呈现时间依赖性,而Ad-GFP组与对照组比较,差异无统计学意义(P>0.05)。流式细胞仪显示,Ad-IL-24组的COLO 16细胞凋亡率(13.10±0.92)%,显著高于对照组(3.69±0.36)%(P<0.05)和空载体组(3.39±1.06)%(P<0.05),后两组间比较,差异无统计学意义(P>0.05)。激光扫描共聚焦显微镜显示,Ad-IL-24组细胞加速凋亡。免疫荧光、Western印迹法和QPCR法结果显示,IL-24过表达后Bax在细胞中的表达明显升高,而Bcl-2在细胞中的表达却明显下降。Western印迹法和qPCR法显示,Ad-IL-24组的Bax、Bcl-2的蛋白及mRNA水平分别与对照组和空载组比较,出现了明显的上升和下降,在蛋白水平上产生与抗cleaved caspase 3抗体结合的特异性条带。结论 Ad-IL-24可诱导鳞癌细胞COLO 16细胞凋亡,其机制可能与上调Bax基因、下调Bcl-2基因表达,并活化caspase 3有关。
肿瘤,鳞状细胞;白细胞介素24;细胞凋亡;半胱氨酸天冬氨酸蛋白酶3;COLO-16
皮肤鳞状细胞癌(简称鳞癌)是起源于表皮或附属器角质形成细胞的一种恶性肿瘤,发生转移的风险为2%~3%,是最常见的非黑素瘤皮肤癌。关于鳞癌的发病机制普遍认为与紫外线及化学药物等有关,但关于其发病的分子机制尚不清楚[1]。IL-24又称黑素分化相关基因7(MDA-7),主要由黑素瘤细胞和巨核细胞产生,是Jiang等[2]于1995年发现,由于其染色体定位在IL-10家族的基因族[3];IL-24具有抑制多种肿瘤细胞生长和肿瘤新血管形成并诱导凋亡功能[4-7],但不会影响正常细胞[4]。本实验用腺病毒介导IL-24基因表达载体,研究其对人鳞癌细胞COLO 16的生长抑制和致凋亡作用,并探讨Ad-IL-24对鳞癌作用的分子机制,为鳞癌的基因治疗提供实验依据。
资料与方法
一、资料
人鳞癌细胞COLO 16为本实验室保存。由汉恒生物科技(上海)有限公司提供携带白介素24(IL-24)的腺病毒表达载体(Ad-IL-24)、以及腺病毒Ad-GFP体(Ad-GFP)。噻唑蓝(MTT)[西格玛奥德里奇(上海)贸易有限公司]。引物设计及合成[英潍捷基(上海)贸易有限公司](表1)。FastStart Universal SYBRGreenMaster(美国Roche公司),碘化丙锭(PI)染色试剂盒(美国Southern Biothech公司),FITC-annexinV染色试剂盒(上海吉凯基因化学技术有限公司),AlexaFluor594荧光染料(美国Lifetechnologies公司),cleavedcaspase3一抗(美国CellSignalling公司,Bcl-2和Bax一抗(美国Abcam公司)。
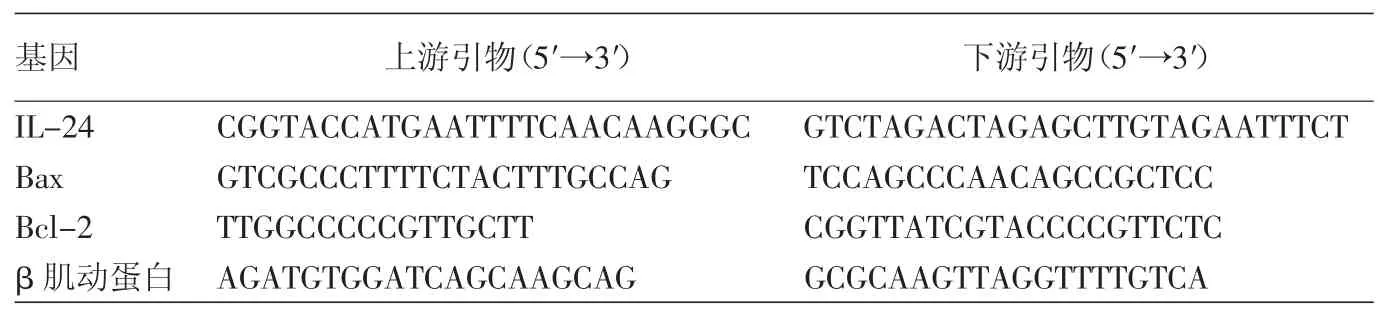
表1 PCR引物序列
二、方法
1.细胞培养以及腺病毒感染:COLO 16细胞的培养基为含10%小牛血清的DMEM完全培养基,细胞置于含5%CO2的细胞培养箱中,在37℃、相对饱和湿度95%条件下培养。实验分3组:①Ad-IL-24组:将细胞接种于96孔板,当细胞融合率达到50%时,换液,再加入携带IL-24的腺病毒表达载体Ad-IL-24后培养2 h,换液后供使用;②Ad-GFP组:将细胞接种于96孔板,当细胞汇合率达到50%时,细胞换液,再加入腺病毒Ad-GFP体Ad-GFP后培养2 h,换液后供本实验使用;③空白组:未做任何处理的COLO 16细胞。参照汉恒生物公司腺病毒感染手册,贴壁细胞加入的病毒范围在MOI=20~ 50内,经预实验摸索,本实验每组均加入病毒量为MOI=40。
2.qPCR法检测:上述3组细胞于37℃、5%CO2条件下继续培养72 h后,在倒置荧光显微镜下观察细胞形态变化。收集感染72 h后的COLO 16细胞,PBS洗涤3次,按RNA抽提试剂盒说明书提取细胞总RNA,吸去培养基,PBS洗细胞1次,加入RNAiso Plus裂解细胞,并按照提取步骤提取细胞总RNA,逆转录试剂盒逆转录生成cDNA,进行实时PCR反应,步骤参照FastStart Universal SYBR Green Master说明书。
3.MTT法检测:将对数生长期的COLO 16细胞按1×104/孔的密度接种于96孔板,实验分组及处理方法同上。分别于0、1~6 d加MTT每孔10 μl,继续孵育4 h后加入溶解剂DMSO 150 μl,在微量振荡仪上适度振荡8 min,用酶标仪测定490 nm波长处的吸光度,绘制生长曲线。
4.流式细胞仪检测:实验分组及处理方法同2。培养72 h后,收集细胞悬液,PB洗涤3次,70%冷乙醇固定后,加入PI等试剂,流式细胞仪检测细胞凋亡及细胞周期变化。
5.激光扫描共聚焦显微镜观察:实验分组及处理方法同2。PI染色:培养72 h后,收集细胞悬液,PBS洗涤3次,4%甲醛固定,按照FITC-Annexin V细胞凋亡检测试剂盒说明操作,每孔加入binding buffer 100 μl和Annexin V 2 μl,室温下孵育10 min。DAPI染色:细胞培养72 h后,将一定浓度的DAPI加入培养基中与细胞共同孵育过夜,再用PBS缓冲液漂洗6次。在激光扫描共聚焦显微镜下观察细胞凋亡的形态改变以检测细胞的早期和晚期凋亡。
6.Western印迹检测:实验分组及处理方法同2。培养72 h后,收集细胞,加细胞裂解液进行充分裂解,离心,取总蛋白上清,进行聚丙烯酰胺凝胶电泳;然后将凝胶蛋白转移到硝酸纤维膜上,经5%脱脂奶粉37℃封闭1 h;加入兔抗人Bax、Bcl-2、cleaved caspase 3,37℃孵育1 h,TBST洗涤;再加山羊抗兔IgG二抗,37℃孵育1 h,TBST洗涤后将NC膜与发光工作液充分接触,室温孵育3 rain,暗室进行压片、曝光、显影和定影。
7.qPCR法检测:实验分组及处理方法同2。培养72 h后,按试剂盒说明步骤抽提细胞总RNA,经反转录获得cDNA。进行实时PCR,具体步骤参照FastStart Universal SYBR Green Master试剂说明书。
8.免疫荧光方法检测:实验分组及处理方法同2。培养72 h后,PBS洗涤3次,4%甲醛固定10 min,透化液处理30 min,加入兔抗人Bax、Bcl-2,4℃孵育过夜,CONTROL洗涤;再加山羊抗兔IgG二抗,室温孵育1 h,封片,留待镜下观察。
三、统计学处理
结果
一、IL-24腺病毒转染效率的验证
将Ad-IL-24、Ad-GFP感染COLO 16细胞,72 h收细胞进行定量PCR试验,检测病毒效价(图1)。感染了Ad-IL-24的细胞中,IL-24基因的表达较感染Ad-GFP以及空白组有明显上升(P<0.05)。

图1 各组COLO 16细胞中IL-24基因的表达情况 a:与空白组比较,P>0.05;b:与空白组比较,P<0.05
二、Ad-IL-24对COLO 16细胞增殖的影响
图2 可见,第1~3天,3个组间的细胞增殖差异无统计学意义;第4天开始,Ad-IL-24组的细胞增殖显著低于Ad-GFP组和空白组(P<0.05),第6天差异最大,并在4 d后Ad-GFP组细胞呈现时间依赖性抑制;而Ad-GFP组与空白组间的差异无统计学意义(P>0.05)。

图2 MTT法检测Ad-IL-24对COLO 16细胞生长的抑制 第1~3天,3个组间的细胞增殖差异无统计学意义;第4天开始,Ad-IL-24组的细胞增殖显著低于Ad-GFP组和空白组(P<0.05),第6天差异最大,并在4 d后Ad-GFP组细胞呈现时间依赖性抑制;而Ad-GFP组与空白组间的差异无统计学意义(P>0.05)
三、Ad-IL-24对COLO 16细胞的凋亡的影响
经流式细胞仪检测(图3)发现,Ad-IL-24组COLO 16细胞凋亡率(13.10±0.92)%,显著高于空白组凋亡率(3.69±0.36)%(P<0.05)和Ad-GFP组凋亡率(3.39±1.06)%(P<0.05),而空白组与Ad-GFP组比较,差异无统计学意义(P>0.05)。图3显示,Ad-IL-24组的细胞早期凋亡(右下方)与空白组和Ad-GFP组有一定差异,而晚期凋亡(右上方)更明显。
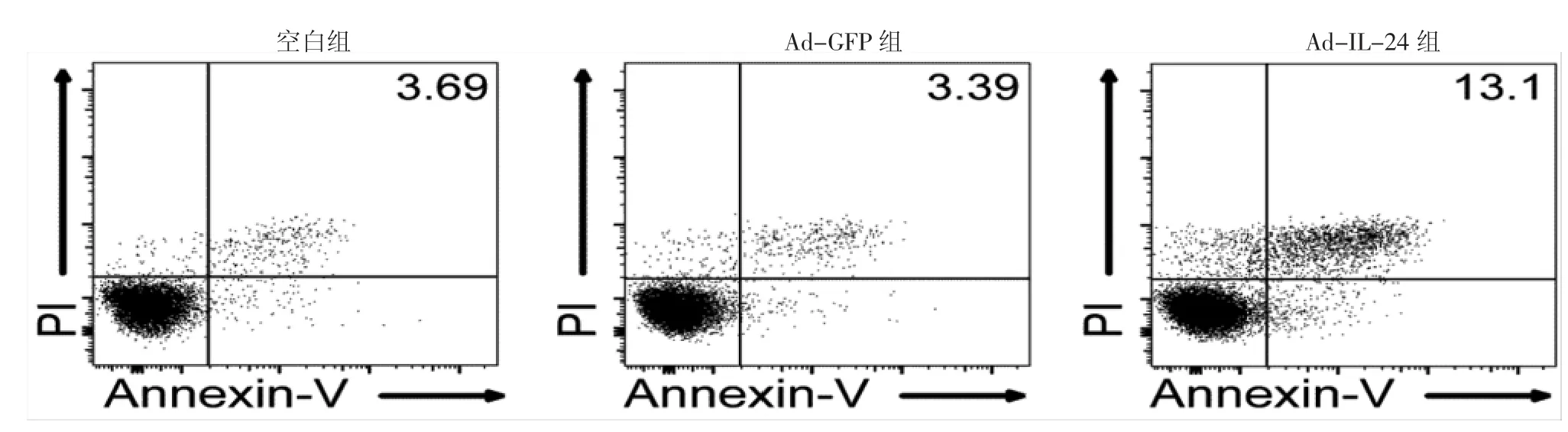
图3 Ad-IL-24对COLO 16细胞凋亡的影响 Ad-IL-24组细胞凋亡率(13.1±0.92)%,显著高于空白组凋亡率(3.69±O.36)%(P<0.05)和Ad-GFP组凋亡率(3.39±1.06)%(P<0.05),Ad-IL-24组的细胞早期凋亡(右下方)与空白组和Ad-GFP组有一定差异,而晚期凋亡(右上方)更明显
四、Ad-IL-24病毒感染人鳞癌细胞COLO 16后的细胞形态学变化
感染Ad-IL-24病毒的COLO 16细胞,72 h后可出现明显的细胞毒性(图4A),细胞变圆,聚集成团,部分细胞漂浮,数量明显减少,Ad-GFP组和空白组COLO 16细胞呈贴壁生长,状态良好,形态完整。分别对空白组、Ad-GFP组、Ad-IL-24组COLO 16细胞行DAPI染色及PI染色后,在激光共聚焦显微镜下观察到 Ad-IL-24组COLO 16细胞有明显的早期凋亡信号(图4B)并出现细胞体积缩小、核浓缩、边集、碎裂并形成凋亡小体(图4C),而空白组和Ad-GFP处理的COLO 16细胞的细胞核均呈弥散均匀的荧光。

图4 Ad-IL-24感染后COLO 16细胞的形态学变化(×400) 4A:未做任何处理的细胞组普通显微镜观察;4B:PI染色,Ad-IL-24组细胞荧光染色明显,说明有明显的早期凋亡信号;4C:DAPI染色,通过蓝色荧光可见Ad-IL-24组细胞体积缩小、核浓缩、边集、碎裂并形成凋亡小体
五、Ad-IL-24对人COLO 16细胞凋亡相关基因的影响
免疫荧光结果(图5)显示,IL-24过表达后Bax在细胞中的表达明显增加,而Bcl-2在细胞中的表达却明显减少。Western印迹(图6)结果显示,Ad-IL-24组Bax、Bcl-2的蛋白水平分别相对于空白组和Ad-GFP组出现了明显的上升和下降。Ad-IL-24组产生了相对分子质量为17 000和19 000并能与抗活化的caspase 3抗体结合的特异性条带,而空白组和Ad-GFP组则在相应位置均未出现上述条带。
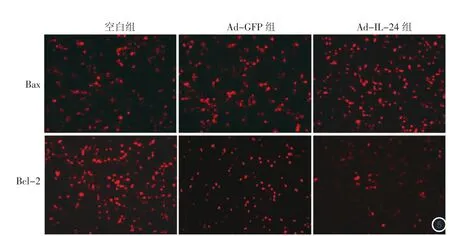
图5 免疫荧光(×200) 荧光明显为表达升高,可见Ad-IL-24组中,Bax在细胞中的表达明显升高,Bcl-2在细胞中的表达明显下降
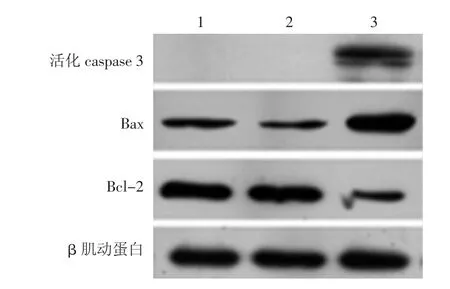
图6 COLO 16细胞Bax、Bcl-2蛋白和活化caspase 3的蛋白表达水平 1:空白组;2:Ad-GFP组;3:Ad-IL-24组;Ad-IL-24组产生了相对分子质量为17 000和19 000并能与抗cleaved caspase 3抗体结合的特异性条带,而空白组和Ad-GFP组则在相应位置均未出现上述条带
讨论
IL-24基因是一个既能够抑制肿瘤细胞的生长、诱导期的凋亡、调控肿瘤细胞的分化,又能抑制血管生成,刺激免疫细胞表达细胞因子的抑癌基因[8-9],还能增强放疗敏感性和免疫调节作用[10],而对正常细胞和组织无毒副作用。已有文献报道,IL-24基因可以明显抑制胃癌、乳腺癌等多种肿瘤细胞的生长,但对鳞癌细胞生长的影响未见报道。
本研究以人鳞癌皮损培养获得的皮肤鳞癌细胞COLO 16[11]为模型,将腺病毒载体介导的Ad-IL-24感染该细胞后,IL-24蛋白在COLO 16细胞内可高表达,感染4 d后能明显抑制细胞增殖且呈现时间依赖性抑制。同时,IL-24能明显诱导COLO 16细胞凋亡,在激光共聚焦显微镜下也能观察到明显的早期凋亡信号和凋亡小体。流式细胞仪检测结果表明,Ad-IL-24组的COLO 16细胞凋亡率显著高于空白组和Ad-GFP组(P<0.05),而图3显示Ad-IL-24组的细胞晚期凋亡比早期凋亡更明显,说明IL-24主要诱导COLO 16细胞的晚期凋亡。
Bcl-2是抗细胞凋亡家族中的基本成员,与其相关的Bax则具有促进细胞凋亡的作用,两者形成Bax/Bcl-2异源二聚体,一般认为Bax/Bcl-2的比值决定细胞是否凋亡[12]。Bax的过表达可促进细胞色素C从线粒体释放,或直接与凋亡蛋白酶激活因子、caspase 9结合成3元复合物,并激活后者,激活的 caspase 9进一步酶切并活化 caspase 3,而caspase 3是一种促凋亡因子,caspase级联放大效应是诱导细胞凋亡的主要机制之一[13-14]。本实验结果表明,Ad-IL-24可以使COLO 16细胞中的Bax基因的蛋白和mRNA表达水平明显上调,而使Bcl-2基因的蛋白和mRNA表达明显下调,Bax/Bcl-2比值显著增高;并且感染Ad-IL-24的COLO 16细胞中出现了活化的cleaved caspase 3特异性条带。结果提示,Ad-IL-24感染导致COLO 16细胞凋亡,与提高Bax/Bcl-2比值、激活easpase-3等级联反应机制有关。
[1]Verburg M,Lang M,Muhlstadt M,et al.Cutaneous squamous cell carcinoma with perineural invasion:report on eight cases and review of the literature[J].Dermatology,2015,230(2):135-142.
[2]Jiang H,Lin JJ,Su ZZ,et al.Subtraction hybridization identifies a novel melanoma differentiation associated gene,mda-7,modulated during human melanoma differentiation,growth and progression[J].Oncogene,1995,11(12):2477-2486.
[3]Caudell EG,Mumm JB,Poindexter N,et al.The protein product of the tumor suppressor gene,melanoma differentiation-associated gene 7,exhibits immunostimulatory activity and is designated IL-24[J].J Immunol,2002,168(12):6041-6046.
[4]Dent P,Yacoub A,Hamed HA,et al.MDA-7/IL-24 as a cancer therapeutic:from bench to bedside[J].Anticancer Drugs,2010,21(8):725-731.
[5]潘巍巍,曹利仙,徐营,等.IL-24基因重组腺病毒载体转染的树突状细胞促进宫颈癌CaSki细胞凋亡[J].中国病理生理杂志, 2014,30(1):41-47.
[6]王睿,王郡甫,刘娣,等.白细胞介素-24对喉癌细胞的增殖抑制效应及机制[J].临床耳鼻咽喉头颈外科杂志,2014,28(12): 902-907.
[7]农卫霞,潘歆,魏娟,等.白细胞介素24对急性白血病骨髓单个核细胞生长的影响[J].实用医学杂志,2014,30(11):1760-1763.
[8]Conti P,Kempuraj D,Frydas S,et al.IL-10 subfamily members: IL-19,IL-20,IL-22,IL-24 and IL-26[J].Immunol Lett,2003,88(3):171-174.
[9]Zheng M,Bocangel D,Doneske B,et al.Human interleukin 24(MDA-7/IL-24)protein kills breast cancer cells via the IL-20 receptor and is antagonized by IL-10[J].Cancer Immunol Immunother,2007,56(2):205-215.
[10]Wang Z,Lv J,Zhang T.Combination of IL-24 and cisplatin inhibits angiogenesis and lymphangiogenesis of cervical cancer xenografts in a nude mouse model by inhibiting VEGF,VEGF-C and PDGF-B[J].Oncol Rep,2015,33(5):2468-2476.
[11]Moore GE,Merrick SB,Woods LK,et al.A human squamous cell carcinoma cell line[J].Cancer Res,1975,35(10):2684-2688.
[12]Yang E,Korsmeyer SJ.Molercular thanatopsis:a discourse on the Bcl-2 family and cell death[J].Blood,1996,88(2):386-401.
[13]Pan G,0′Rourke K,Dixit VM.Caspase-9,Bcl-XL,and Apaf-1 form a termary complex[J].J Biol Chem,1998,273(10):5841-5845.
[14]Shalini S,Dorstyn L,Dawar S,et al.Old,new and emerging functions of caspases[J].Cell Death Differ,2015,22(4):526-539.
Adenovirus-mediated IL-24 gene expression induces apoptosis in a human squamous cell carcinoma cell line COLO 16
Ma Xinxin,Zhang Mengli,Li Lingjun,Cao Yuping,Wu Qiuju,Ma Pengcheng.Institute of Dermatology, Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
< class="emphasis_italic">Corresponding author:Ma Pengcheng,Email:mpc815@163.com
Ma Pengcheng,Email:mpc815@163.com
ObjectiveTo investigate the effect of adenovirus-mediated IL-24(Ad-IL-24)gene expression on the apoptosis in a human squamous cell carcinoma cell line COLO 16,and to explore the underlying molecular mechanism.MethodsCultured COLO 16 cells were divided into two groups to be transfected with an adenovirus vector carrying the IL-24 gene(Ad-IL-24 group)or green fluorescent protein(Ad-GFP group),while those receiving no treatment served as the control group.After culture for different durations,qPCR was performed to quantify IL-24 gene expression,methyl thiazolyl tetrazolium (MTT)assay to evaluate the proliferative activity of COLO 16 cells,flow cytometry to detect the apoptosis of COLO 16 cells,laser scanning confocal microscopy(LSCM)to observe the morphological changes of COLO 16 cells,Western blot to determine the levels of Bax and Bcl-2 proteins and to evaluate the activation of caspase-3,qPCR to determine the levels of Bax and Bcl-2 mRNAs,an immunofluorescence assay to observe the expression of Bax and Bcl-2 proteins.Statistical analysis was carried out by a two-samplet-test with the SPSS 19.0 software.ResultsMTT assay showed that the proliferation of COLO 16 cells in the Ad-IL-24 group was significantly inhibited as early as 4 days after the transfection;thereafter,the inhibitory effect increased in a timedependent manner,and peaked on day 6(P<0.05).However,there was no significant difference in cellular proliferative activity between the Ad-GFP group and control group(P>0.05).Flow cytometry revealed that the apoptosis rate was significantly higher in the Ad-IL-24 group(13.10%±0.92%)than in the control group(3.69%±0.36%,P<0.05)and Ad-GFP group(3.39%±1.06%,P<0.05),but no significant difference was observed between the control group and Ad-GFP group(P>0.05).LSCM demonstrated that the apoptosis of COLO 16 cells was accelerated in the Ad-IL-24 group. The immunofluorescence assay,Western blot and qPCR all showed that the mRNA and protein expressions of Bax were increased,but those of Bcl-2 were decreased in the Ad-IL-24 group compared with the Ad-GFP group and control group. Moreover,Western blot showed a protein band that could specifically bind to the anti-cleaved caspase-3 antibody in the Ad-IL-24 group,but not in the Ad-GFP group or control group.ConclusionsAd-IL-24 can induce apoptosis in humanCOLO 16 squamous cell carcinoma cells,probably by up-regulating Bax expression,down-regulating Bcl-2 expression,and activating caspase 3.
Neoplasms,squamous cell;Interleukin-24;Apoptosis;Caspase 3;COLO 16 cell
10.3760/cma.j.issn.0412-4030.2015.09.004
江苏省临床医学科技专项(BL2012003)
210042南京,中国医学科学院北京协和医学院皮肤病研究所
马鹏程,Email:mpc815@163.com
2015-04-29)
(本文编辑:吴晓初)

