弓形虫gra14基因真核表达载体的构建及其免疫保护性研究*
陈晓恒 郑 斌 丁建祖 楼 涤 童群波 孔庆明 陈 睿 陆绍红
(浙江省医学科学院寄生虫病研究所, 杭州 310013)
刚地弓形虫Toxoplasmagondii是一种分布广泛的专性细胞内寄生原虫,可寄生于包括人在内的几乎所有温血动物的有核细胞内,引起人畜共患弓形虫病(Lehmannetal.,2003; Hilletal.,2005)。虽然免疫功能正常患者多无明显症状,但免疫功能低下或受损者如恶性肿瘤或HⅣ病人,却可以导致严重的健康问题(Rormanetal.,2006; Innesetal.,2010)。弓形虫感染人体后可以入侵多种脏器和组织,孕期女性感染弓形虫可通过母婴传播影响胎儿的发育,造成胎儿畸形,引起流产、早产甚至死胎(Kravetzetal.,2005)。弓形虫病也给畜牧业生产带来极大的经济损失,感染后的家畜又会成为感染人的另一条重要途径(Tenteretal.,2000;Dubeyetal.,2005)。弓形虫病已经日益引起人们的高度重视。但迄今没有理想的治疗药物,研制弓形虫疫苗对保护人体健康和减少畜牧业经济损失具有重要的意义。
由于弓形虫生活史复杂,具有多样化的特异性抗原和高度变异性,以及多种入侵途径和逃避宿主免疫攻击的机制(Zhengetal.,2012),致使弓形虫疫苗的研究难度较大。但随着基因工程技术的不断发展,弓形虫疫苗的研制也有了较大突破,其中DNA疫苗因其在预防弓形虫感染中能够产生高效、持久的体液免疫和细胞免疫等优点而受到广泛关注(Tanetal.,2011;Yanetal.,2012)。
致密颗粒蛋白(Dense granule proteins, GRAs)是弓形虫入侵宿主细胞后由致密颗粒释放入纳虫泡(Parasitophorous vacuble, PV)的一类分泌代谢抗原,具有调节和维持纳虫泡和纳虫泡膜结构的作用(Romeetal.,2008),以保证虫体在宿主细胞内的生存,部分GRAs还参与虫体在宿主细胞内的生长与转录(Mercieretal.,2005;Romeetal.,2008)。由于此类分泌蛋白一般具有较强的免疫原性,有些已被证实可以诱导宿主细胞产生保护性免疫(Jongertetal.,2007;Sunetal.,2011;Quanetal.,2012),因此GRAs在弓形虫的诊断及免疫预防中备受关注。
弓形虫GRA14作为致密颗粒蛋白家族中的一员最初由Rome等(2008)发现,GRA14与GRAs中的GRA3,GRA7共同定位在纳虫泡膜上,在弓形虫感染宿主细胞的过程中,GRA14可以在纳虫泡间转移,并且GRA14有较好的保守性,有4个B细胞抗原表位,表明弓形虫GRA14可以作为弓形虫病新型诊断和疫苗制剂的候选抗原(Romeetal.,2008;Chenetal.,2013)。
对GRA14免疫保护性目前还未见相关研究,因此本实验首次以gra14为目的抗原基因,构建gra14基因的重组真核质粒pVAX1-gra14免疫BALB/c小鼠,研究弓形虫gra14基因疫苗对抗弓形虫感染的免疫保护作用,为研究有效的弓形虫疫苗奠定基础。
1 材料与方法
1.1 实验材料
1.1.1虫株与实验动物:刚地弓形虫RH强毒株由本实验室传代培养。BALB/c小鼠60只(批号:2008001654042,清洁级,雄性,7周龄)由浙江省医科院实验动物中心提供。
1.1.2菌株和质粒细胞:大肠杆菌EscherichiacoliDH5α菌株购于宝赛生物杭州股份有限公司,pVAX1 质粒和HEK293细胞由本实验室保存和保种。
1.1.3主要实验试剂:Trizol试剂(Invitrogen),DMEM高糖培养基(Gibco),5% BSA(Gibco),限制性内切酶HindⅢ、EcoRⅠ和T4 DNA连接酶(Takara);质粒小提试剂盒(Tiangen),1× PBS, PVDF膜(millipore),吐温-20(Sigma),刀豆素A(Sigma),兔抗弓形虫血清,辣根过氧化物酶(HRP)标记羊抗兔IgG(Sigma),HRP标记羊抗鼠IgG(Abcam);其他试剂为国产分析纯。
1.2 实验方法
1.2.1虫体培养:用含5%胎牛血清的DMEM培养基培养人包皮成纤维细胞(HFF),传代6 h后接种弓形虫速殖子,4 d后收集纯化弓形虫用于提取弓形虫总RNA。
1.2.2重组质粒的构建:根据GenBank中弓形虫gra14基因序列设计引物,并在上下游引物的5′分别引入HindⅢ、EcoRⅠ酶切位点。上游引物:5′-A A G C T T A T G C A G G C G A T A G C G C G G GG-3′;下游引物:5′-G A A T T C C T A T T C G C T T G G T C T C T G GT-3′(下划线处是酶切位点),引物由上海生工公司合成。提取弓形虫RH虫株RNA,经RT-PCR制备cDNA作为扩增模板。gra14基因片段通过HindⅢ、EcoRⅠ限制性内切酶连接到pVAX1质粒上,构建pVAX1-TgGRA14重组质粒,并转化入EscherichiacoliDH5α感受态细胞进行扩增。通过酶切、PCR鉴定和DNA测序鉴定,挑选阳性克隆。
1.2.3重组质粒的表达与鉴定:使用质粒抽提试剂盒提取pVAX1-gra14质粒,NanoDrop2000测量DNA浓度。使用Invitiogen公司的Lipo2000将重组质粒转染至HEK293细胞进行表达。培养2 d后裂解细胞,分离纯化细胞总蛋白,并通过Western blot检测分析。将细胞裂解纯化后的总蛋白通过聚丙烯酰氨凝胶电泳分离,并转移到PVDF膜上进行蛋白印迹分析。采用的一抗是1∶100稀释的兔抗弓形虫血清,二抗是1∶5 000稀释的HRP标记羊抗兔IgG抗体。
1.2.4小鼠免疫流程:将60只7周龄的BALB/c小鼠随机分成4组,每组15只。每只实验组小鼠肌肉注射100 μg pVAX1-gra14质粒,对照组分别注射PBS(100 μL/只)和pVAX1空质粒(100 μg/只),空白对照不作处理,也作为对照组。每组小鼠免疫3次,每次间隔14 d。在第0、14和28 d每次免疫前,通过小鼠尾静脉取血,最后一次加强免疫14 d后取血标记为第42 d血样。所取的血液样本离心分离血清保存于-20℃备用,免疫前血清作为阴性对照。
1.2.5免疫后抗体水平检测: 在96孔板中用可溶性抗原(STAg)包板(1μg/孔)4℃孵育过夜,PBST洗板3次,用含10%BSA的PBS封闭非特异性位点,然后加入稀释度为1∶100的小鼠血清37℃孵育1 h。PBST洗板3次,加入稀释度为1∶10 000的辣根过氧化物酶标记的羊抗鼠IgG、 IgG1和IgG2a抗体。加入TMB显色液在450 nm测量吸光度值。每份血清样本做2个复孔检测。
1.2.6脾细胞增殖检测:末次加强免疫14 d后,每组各取5只小鼠获取脾脏,制备脾细胞悬浮液。在96孔细胞培养板中用80% DMEM和20% BSA调整脾细胞浓度至5×105细胞/孔。分别在培养基中加入10 μg/mL的可溶性抗原(STAg)、5 μg/mL的刀豆素(ConA)作为阳性对照和只加培养基的作为阴性对照。将培养板置于37℃、5%CO2环境中培养68 h后,采用MTT法检测脾细胞的增殖情况,计算脾细胞刺激指数(Stimulation index, SI)。
1.2.7细胞因子检测: 按照检测脾细胞增殖的方法制备脾细胞悬液,分别离心收集24、72和96 h的细胞培养上清液对IL-2、IL-4、IL-10和IFN-进行细胞因子的测定。细胞因子的浓度通过ELISA试 剂盒检测,每份样本做3个复孔检测。
1.2.8免疫保护率测定:末次免疫14 d后,所有小鼠进行弓形虫强毒株的攻击实验。每只小鼠腹腔注射约100个弓形虫速殖子,密切观察小鼠状态,记录小鼠的死亡和存活时间,绘制生存曲线。
1.2.9统计分析:使用SPSS软件对脾细胞增殖和细胞因子检测的数据通过单因素方差分析进行统计分析。生存曲线通过Kaplan-Meier法分析DNA疫苗的免疫保护性。各组别之间的统计结果P值小于0.05为有显著性差异。
2 结果
2.1 基因扩增及重组质粒的表达
PCR成功扩增gra14基因,大小为1 227 bp,如图1-A所示。双酶切连接到pVAX1载体后转入E.coliDH5α中扩增。Western blot检测结果显示转入HEK293细胞的pVAX1-gra14成功表达目的蛋白,结果如图1-B所示,分子量约为45 kDa,与预测的蛋白分子量相同。重组 pVAX1-gra14质粒在HEK293细胞中成功表达目标抗原。

图1 gra14基因克隆和蛋白表达Fig.1 Gene cloning and protein expression of gra14A:M:DNA marker 2 000~750 bp;1:阴性对照;2:加入模板的扩增产物;3:阳性参照. B:M:蛋白marker 55~35 kDa;1:空质粒转入HEK293后的提取物;2:pVAX1-gra14转入HEK293后的细胞表达产物;3:原核表达的重组rGRA14。A: M: DNA marker 2 000~750 bp; 1: Negative control; 2: Amplification products adding template; 3: Positive control. B: M: Protein marker 55~35 kDa; 1: The lysate of HEK293 transformed with empty pVAX1 vector; 2: The lysate of HEK293 transformed with pVAX1-gra14; 3 Purified rTgGRA14 of T. gondii expressed in E. coli.
2.2 总IgG抗体及IgG抗体亚型的检测
通过ELISA间接法检测免疫后小鼠血清中的特异性抗弓形虫抗体。结果显示如图2-A,实验组小鼠免疫接种14 d后可以检测到特异性抗弓形虫GRA14的抗体。实验组小鼠特异性抗体的产量随着后续免疫次数的增加而不断升高,末次免疫后,实验组小鼠血清IgG水平显著高于三组对照组,比较差异均有统计学意义(P<0.05)。而三组对照组的小鼠体内特异性抗体水平无明显升高。
末次加强免疫14 d后,通过ELISA检测IgG抗体亚型。图2-B中所示,实验组小鼠血清中IgG1和IgG2a亚型抗体均高于三组对照组小鼠的抗体效价(P<0.05),并且IgG2a型抗体的产量要相对高于IgG1型抗体。对照组中IgG抗体亚型的检测结果没有显著差异(P>0.05)。

图2 特异性IgG抗体和IgG亚型抗体的检测Fig.2 Detection of specific IgG antibodies and IgG subclass antibodiesA:BALB/c小鼠血清中特异性抗弓形虫GRA14抗体的检测,血清样本取样于第0、14、28、42 d免疫后。B:末次免疫14 d后BALB/c小鼠血清中特异性抗弓形虫GRA14亚型抗体的检测,检测结果以450 nm下的吸光度值和标准差(n=10)来表示;统计学显著性差异(P<0.05)以星号标注。A: Determination of specific anti-TgGRA14 antibodies in the sera of BALB/c mice. Serum samples were collected at 0, 14, 28 and 42 days post-primary immunization. B: Determination of the specific anti-TgGRA14 IgG subclass profile in the sera of immunized BALB/c mice 14days after the last immunization. Results are expressed as means of the OD450 value and the standard deviation (n=10); statistically significant differences (P < 0.05) are indicated by an asterisk (*).
2.3 脾细胞的体外增殖反应
第3次免疫结束14 d后,每组取5只小鼠各取脾脏细胞评估其增殖反应的情况。结果如表1所示,接种pVAX1-gra14的实验组小鼠的脾细胞刺激因子(SI)为1.37±0.23,显著高于三组对照组(P<0.05),表明脾细胞经可溶性抗原刺激后有较为强烈的增殖反应。而经PBS、pVAX1免疫和空白对照组小鼠的SI值分别是:0.62±0.01,0.55±0.02和0.64±0.05,比较差异无统计学意义(P>0.05)。
2.4 细胞因子检测
各组小鼠脾细胞悬浮液经可溶性抗原刺激后,分别在不同时间段提取上清液测量所产生的γ-干扰素(IFN-)、白细胞介素2(IL-2)、白细胞介素4(IL-4)和白细胞介素10(IL-10)。表1所示,经pVAX1-gra14免疫后的实验组小鼠分泌大量的细胞因子,与三组对照组的细胞因子有显著性差异(P<0.05)。对照组之间的细胞因子没有显著差异(P>0.05)。实验组Th1型细胞因子(IFN-,IL-2)和Th2型细胞因子(IL-4,IL-10)均有产生,表明小鼠接种pVAX1-gra14免疫后产生Th1/Th2混合型的免疫反应,这和IgG抗体亚型的分析结果相一致。
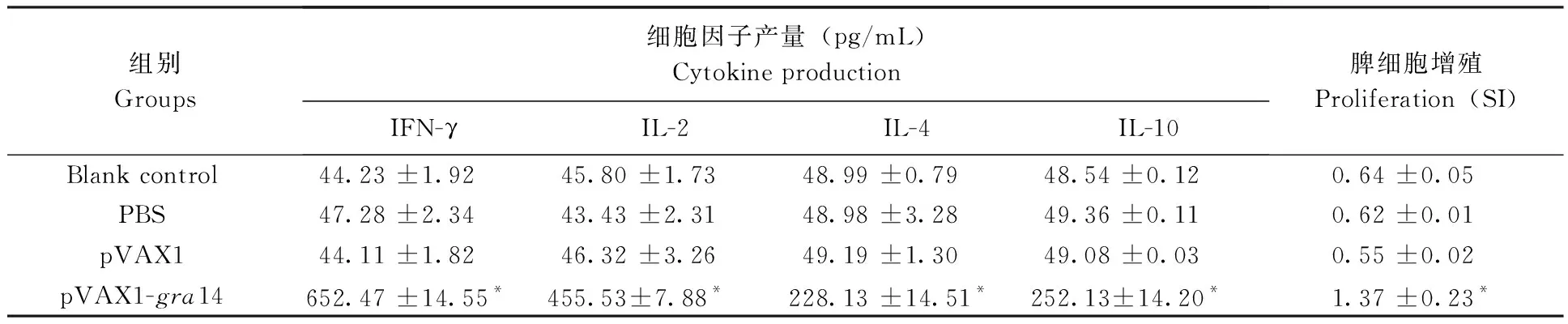
表1 经pVAX1-gra14免疫后小鼠的细胞因子产量和脾细胞增殖结果Tab.1 Cytokine production and the proliferative response of splenocytes from BALB/c mice immunized with pVAX1-gra14
差异有统计学意义,P<0.05。SI指脾细胞刺激指数。
* Significant difference,P< 0.05. SI: Splenocytes stimulation index.
2.5 DNA疫苗的免疫保护性
为检测pVAX1-gra14免疫对抵抗弓形虫感染的免疫保护能力,在末次加强免疫14 d后对小鼠进行弓形虫强毒株攻击实验,腹腔注射100个弓形虫速殖子,观察和记录各组小鼠的生存时间。结果显示,三组对照组小鼠的生存时间没有显著性差别,小鼠均在弓形虫感染后第5 d开始死亡,至第7 d三组对照组的小鼠全部死亡。但经pVAX1-gra14免疫后的实验组小鼠在攻击实验后直到第12 d才出现死亡,到第15 d全部死亡,平均生存时间为14.1±1.3 d。实验组小鼠的生存时间比三组对照组显著延长(P<0.05)。各组小鼠在攻击感染后的生存曲线如图3所示。

图3 攻击后的小鼠生存曲线Fig.3 Survival curves of BALB/c mice after challenge末次免疫14 d后各组小鼠接受100只速殖子攻击实验的生存曲线。每组10只小鼠。统计学显著性差异用星号标注。Survival curves of BALB/c mice injected with PBS, pVAX1, pVAX1-gra14 and the blank group, challenged with 100 tachyzoites of T. gondii RH strain 14 days after the last immunization. Each group comprised 10 mice. Statistically significant differences (P<0.05) are showed by an asterisk.
3 讨论
近年来,弓形虫疫苗研究已有较多的进展,但不同实验中所选用的弓形虫抗原基因在免疫保护力上存在较大的差异。寻找具有更强免疫原性的抗原基因以提高弓形虫疫苗的免疫保护效果,将是今后弓形虫疫苗研究的重要方向之一。
致密颗粒蛋白在弓形虫入侵宿主细胞后从致密颗粒释放入纳虫泡,定位于纳虫泡膜上,是组成纳虫泡膜的组成部分(Huangetal.,2013),同时GRAs蛋白又多具有较强的免疫原性(Zhangetal.,2014;Huetal.,2015)。致密颗粒蛋白家族中的GRA14主要有6个α-螺旋、3个β折叠,经过3次跨膜,可以在纳虫泡之间穿梭,进入到宿主细胞内,并且在不同虫株之间有高达99%以上的保守性,具有4个B细胞的抗原表位(Romeetal.,2008;Chenetal.,2013)。这都表明GRA14是一个潜在的保护性抗原。
在本研究中,构建的重组质粒pVAX1-gra14接种小鼠免疫后,血清中特异性IgG抗体的水平随着接种次数的增加而显著增高,而对照组相应血清中IgG水平无明显变化。在抗体亚型的检测中,同时检测到IgG2a和IgG1,实验组的抗体亚型产量明显高于对照组(P<0.05),并且IgG2a的表达量要略高于IgG1。表明pVAX1-gra14诱导小鼠产生Th1/Th2混合型的免疫反应。实验组小鼠的细胞因子(IFN-γ、IL-2、IL-4、IL-10)水平明显高于对照组(P<0.05),而其中又以IFN-γ和IL-2最为显著,这与之前的研究认为IFN-γ是抵抗弓形虫感染中的重要细胞因子(Dautuetal.,2007)的研究相一致。以上结果表明,弓形虫GRA14可以诱导小鼠体内产生高效的体液免疫和细胞免疫来共同抵抗弓形虫的感染。
攻击感染后的存活率是候选疫苗抵抗弓形虫感染保护力的重要指标。本研究中,我们通过对免疫后小鼠经行弓形虫强毒株的攻击实验来评估GRA14的免疫保护性。攻击实验后,pVAX1-gra14免疫组小鼠的生存时间显著延长并高于对照组(P<0.05),平均生存时间为14.1±1.3 d,表明TgGRA14有潜力成为新型DNA疫苗的候选之一。
本研究评估了pVAX1-gra14作为DNA候选疫苗的免疫原性和免疫保护效力,显示其能诱导产生混合型Th1/Th2免疫反应,同时产生高水平的IFN-γ、IL-2、IL-4、IL-10细胞因子,并且在攻击实验后,免疫小鼠生存时间显著延长。弓形虫GRA14是一个有效的候选疫苗分子,在后续的研究中我们将寻找合适的免疫佐剂来共同免疫(Yuanetal.,2011)或是与其他有效的DNA疫苗联合成多价核酸疫苗(Dziadeketal.,2011;Quanetal.,2012)来进一步增强免疫保护力。

