蚊虫RNAi显微注射方法的建立*
吴 群 李春晓 廖承红 韩 谦** 赵彤言**
(1.海南大学农学院,海口 570228;2.军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071)
随着生物技术的快速发展,已有越来越多生物技术应用到昆虫基因功能研究中,其中RNAi技术已成为研究蚊虫基因功能主要生物技术之一(Zhuetal.,2013; Lietal.,2014)。RNA干扰是指外源性或内源性的dsRNA(Double-stranded RNA,dsRNA)特异性地引发基因表达沉默的现象(王翔,2013)。如何有效将外源性dsRNA导入蚊虫体内是实现RNA干扰成功的关键步骤。将线虫浸泡在dsRNA溶液中,或者喂食线虫表达dsRNA的细菌以及向线虫体腔注射dsRNA都能引起RNAi效应(Burandetal.,2013),而对于昆虫RNAi主要通过微量注射将外源dsRNA导入昆虫血淋巴中或者喂食表达dsRNA细菌,其中微量注射法已经越来越多应用到完全变态昆虫的所有生命阶段(Scottetal.,2013)。Drake(2015)和Li(2014)等利用RNAi研究埃及伊蚊通道蛋白基因和致倦库蚊Culexpipiensquinquefasciatus抗药性相关G蛋白偶联受体基因功能时都是通过微量注射法将dsRNA导入蚊虫体内。然而在大量应用RNAi技术的文献中并未对蚊虫微量注射进行详细阐述,在Garver(2007)和Luna(2007)公布的冈比亚按蚊和埃及伊蚊微量注射视频中也只能看到大致构建步骤。此外,对于致倦库蚊微量注射详细构建步骤报道甚少。如能详细阐述构建蚊虫微量注射方法,将更有利于研究者构建微量注射体系,更好地利用RNAi等生物技术开展基因功能研究。本文以致倦库蚊为注射对象来构建蚊虫微量注射最佳方案,为后续研究致倦库蚊基因功能提供技术支持和理论依据。
1 材料与方法
1.1 实验材料
供试蚊种:致倦库蚊敏感株来源于军事医学科学院微生物流行病研究所媒介生物学和防治研究室,蚊虫养殖条件为:温度(26±1)℃、相对湿度60%±5%、光照:黑暗=14 h:10 h,成蚊喂食8%糖水,羽化3~5 d的蚊虫用于实验。
蚊虫图像采集:体视显微镜(型号:M165C,Leica公司),数码图像采集仪及软件(型号:Automontage-pro,SYNCROS 公司)
1.2 方法
1.2.1蚊虫的麻醉:用吸蚊器吸取羽化3~5 d并中断糖水4 h的致倦库蚊,吸5次,每个吸蚊器收集盒吸取蚊虫数量控制在300只左右,将吸蚊器收集盒放入-30℃冰箱中,冰冻时间分别为3、4、5、7和10 min;将每个收集盒内蚊虫平均倒入放置于冰上的3个培养皿中,冰上放置1 h后将培养皿中蚊虫放置蚊笼中回暖(养虫室条件:温度(26±1)℃、相对湿度60%±5%)并喂食8%糖水,统计冰冻不同时间造成的死亡率。
用吸蚊器吸取羽化3~5 d并中断糖水4 h的致倦库蚊,吸5次,每个吸蚊器收集盒吸取蚊虫数量控制在300只左右,向吸蚊器收集盒充CO2气体,分别持续时间为0.5、1.0、2.0、4.0和10.0 min;将每个收集盒内蚊虫倒入放冰上的3个培养皿中,培养皿放置于冰上,1 h后将培养皿中蚊虫放置蚊笼中回暖(养虫室条件同上)并喂食8%糖水,统计CO2充气不同时长蚊虫的死亡率。
1.2.2蚊虫液体注射剂量及注射部位的选取:本研究采用油压式手动微量注射仪(CellTram oil,Eppendorf 公司)对蚊虫进行注射;利用最佳麻醉方式对蚊虫进行麻醉,从蚊虫正对胸部腹面和胸部侧面进行注射,通过转动助推器旋钮格数引起蚊虫腹部变化情况来确定注射剂量,统计蚊虫成活率。
1.3 数据处理
用SPSS 13.0 进行显著性分析,比较不同处理间的差异性,显著水平α=0.05。
2 结果
2.1 蚊虫不同麻醉方式效果
对蚊虫进行微量注射时,一般对于活动性强的蚊虫,进行适当的麻醉后(采用乙醚、CO2或冰)再注射,可以避免由于虫体扭动而使注射的dsRNA流出体外(田宏刚等,2013)。本实验选取冰冻和CO2来进行麻醉,实验过程中当冰冻时间为3.0 min时,蚊虫并不能全部达到麻醉状态,4.0 min时可以明显看出蚊虫处于麻醉状态,放置冰上1 h后,成活率达98.97%,由图1中A可以看出随着冰冻时间的增加对蚊虫造成的伤害越来越大,成活率成逐渐下降趋势。
对蚊虫充CO2气体来进行麻醉时,可以看出当充气时间为0.5 min时蚊虫就能达到麻醉状态,并且通气持续时间达到1.0、2.0、4.0 min后,蚊虫成活率均为100%,随着时间增加到10 min时,CO2对蚊虫造成严重伤害其成活率降为36.50%。
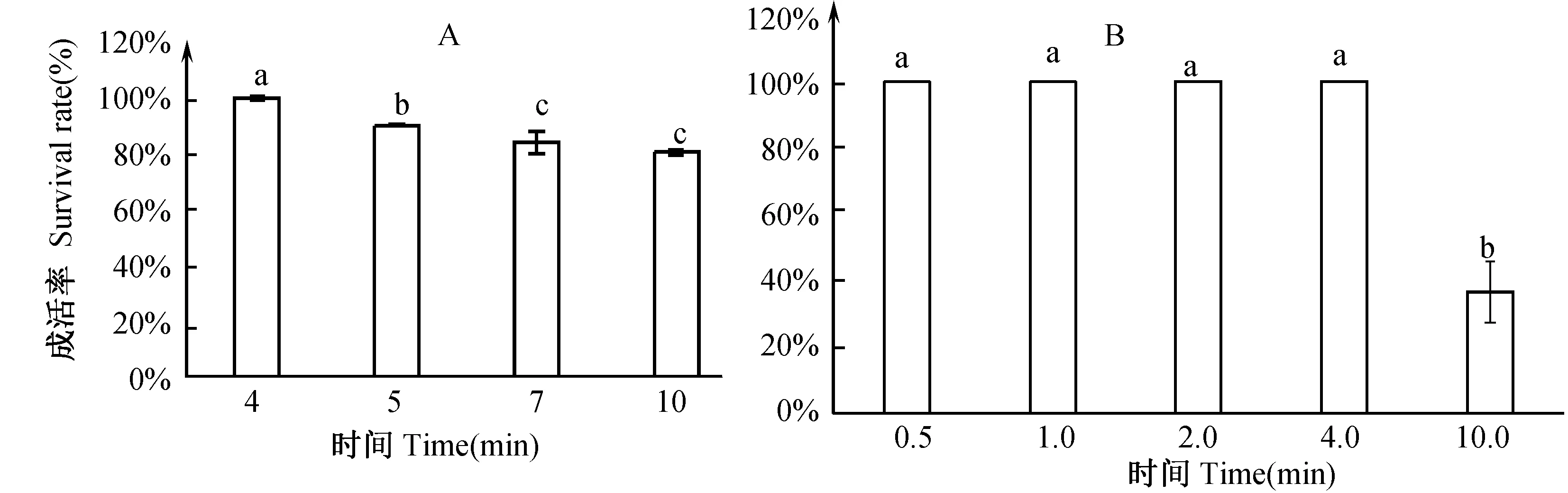
图1 不同麻醉方式处理后蚊虫成活率Fig.1 The survival rate of mosquitoes treated with different methodsA.冰冻;B.CO2处理. 标有不同字母表示具有显著性差异(P<0.05)A. The survival rate of mosquitoes freezed with different durations;B. The survival rate of mosquitoes treated with CO2 with different durations.The survival rates with different letters are significantly different (P<0.05).
2.2 注射剂量及部位
蚊虫注射量的大小主要参照Luna等(2007)公布的视频(图2 A-B为视频截图)。当转动微量注射仪旋转扭格约0.75格即注射量为0.7~0.8 μL时可以明显观察到蚊虫腹部由图2中 C涨大到D,并在肉眼下也能明显观察到蚊虫腹部胀大。
选择从蚊虫的胸部进行注射,分别从蚊虫胸部腹面与侧面注射两组。从表1中可以看出正对蚊虫胸部腹面注射成活率仅为67.81%,明显低于从胸部侧面注射成活率(93.85%),由此可见对胸部腹面注射对蚊虫造成伤害明显要比从侧面进行注射大。

图2 注射前后蚊虫腹部变化情况Fig.2 Changes of mosquito abdomen before and after injectionA-B.Luna等(2007)公布的蚊虫注射视频截图,A: 注射前; B: 注射dsRNA后. C-D.本实验注射前后; C: 注射前; D: 注射0.7~0.8 μL dsRNA后。A-B:Published video screenshots with microinjected mosquito from Luna et al.(2007)and Garver(2007). A: The mosquito before injecting; B: The mosquito after injected dsRNA;C-D: Before and after injection in our experiment; C: The mosquito before injecting; D: The mosquito after injected 0.7~0.8 μL dsRNA.
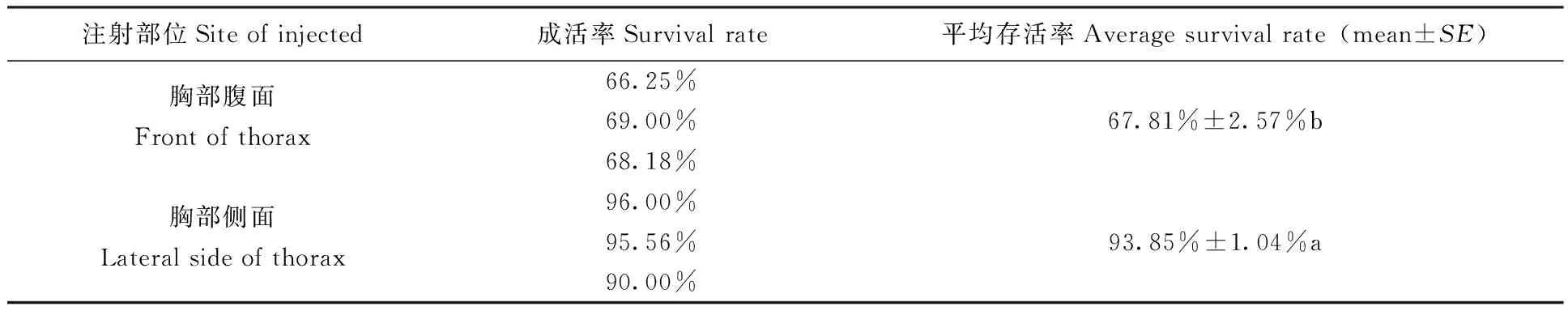
表1 不同部位注射后蚊虫成活率Tab.1 Survival rate of mosquitoes at different mode of the injection
3 讨论
本研究结果发现利用CO2麻醉效果要比冰冻麻醉效果更佳,用CO2处理0.5~4.0 min,然后置于冰上1 h后蚊虫能够全部复苏,不会对蚊虫造成伤害;而在冰冻麻醉蚊虫时,从冰冻5 min后开始蚊虫回暖,将引起蚊虫死亡,死亡率达10.37%。当冰冻时间为4 min且放置于冰上持续1 h后死亡率较低(1.03%)能达到通CO2气体0.5~4 min的麻醉效果,随着冷冻时间的增加蚊虫死亡率也逐渐增加,这与以往研究结果不同。梁国栋(1991)等发现将蚊虫置冰箱冷冻室5 min左右,使其冻麻倒入一玻璃平皿,平皿下部放一冰盘以维持蚊虫的冻麻状态。室温下以冰块维持冻麻2 h的蚊虫回暖后,可全部正常活动,不会因长时间冻麻而死亡。我们推测因选取的蚊虫不同造成的差异。本研究实验对象致倦库蚊主要分布在北纬32~34℃以南的地区(邢丹,2013),耐寒能力比较弱,从中可以看出利用冰冻麻醉蚊虫时可以根据蚊虫种类的不同适当增加或减少冰冻时间。
注射前对蚊虫进行中断糖水饲养4 h,使蚊虫处于空腹状态,不仅有利于观察注射后腹部变化,还能尽可能减少蚊虫产生降解dsRNA的酶类。对蚊虫注射量主要参照Luna等(2007)等公布的视频,进行注射时主要以肉眼能明显观察到腹部变化情况为准,实验中当注射量为0.7~0.8 μL能明显看到蚊虫腹部胀大。早在1994年就有报道平均每只白纹伊蚊一次吸血量为1.3750~1.4820 mg,其吸血量大约为体重的59.6%~67.5%(张云智,1994),说明蚊虫腹部可以容纳0.7~0.8 μL液体。
田宏刚等(2013)提出对昆虫进行微量注射选择从昆虫头部向尾部方向注射,因为昆虫的血液流动在背血管以外是从头向尾,这样可以最大程度的避免dsRNA由于体液的流动而被排出体外。从闫亮珍等(2011)公布的致倦库蚊胸部切片可以看出,致倦库蚊胸部主要分布有大量的肌肉组织,适合进行注射。胸部侧面的气孔肉眼下无法观察到,从侧面注射会不会影响蚊虫成活率,为此我们进行了蚊虫胸部腹面与侧面注射实验,结果正对胸部腹面成活率明显低于侧面,侧面注射可能对蚊虫的伤害要更小。我们推测正对胸部进行注射会对分布在上面胸神经节造成伤害(闫亮珍等,2011),从而增加蚊虫死亡率。
本实验构建的显微注射技术主要用于后续蚊虫气味受体基因功能研究,而有研究证明黑腹果蝇的受体Gr21a和Gr63a,共同表达时能对CO2表现出敏感性,在冈比亚按蚊中与之同源的受体GPRGR22 和GPRGR24也分布在感知CO2的下颚须中(Jones,2007),为了不不影响对气味受体研究结果的准确性,后续实验中主要采用与CO2麻醉效果一样的冰冻4 min来对蚊虫进行麻醉。本研究成功构建蚊虫显微注射方法,为后续蚊虫基因功能研究提供技术支持及理论依据。

