mTOR、eIF4E在原发性肝细胞癌组织中的表达及意义
雷华文 马秀现 宋黎明 孙玉岭
(1.郑州大学第一附属医院肝胆胰外科 河南郑州 450052;2.郑州大学附属郑州中心医院 肝胆胰外科 河南郑州 450007)
原发性肝细胞癌的发病和死亡均具有明显的地域分布特征,河南省作为人口大省,原发性肝细胞癌的发病率一直位于我国前列。目前,临床上对于肝癌的常用治疗方法主要是手术切除、介入手术治疗及放化疗,但治疗效果均欠佳。细胞内大量蛋白质的合成为肿瘤细胞分裂增殖所必不可少的条件[1]。近年发现,在肿瘤细胞分裂、增殖的过程中,哺乳动物雷帕霉素靶向基因(mammalian target of rapamycin,mTOR)及异常激活的真核细胞翻译起始因子4E(eukaryotic translation initiation factor 4E,eIF4E)的调控作用均至关重要。因此,探索原发性肝细胞癌mTOR、eIF4E 的表达以及其侵袭和转移的相关机制,对于找到有助于原发性肝癌早期诊断的生物学指标以及探寻新的治疗途径有着非常重要的意义。
1 材料与方法
1.1 研究对象 选取2012年6月至2013年7月在郑州大学第一附属医院接受手术治疗的45例肝细胞癌患者,术前均行CT 或MRI 检查,均为第1 次手术治疗,术前均未接受任何形式的放疗和化疗,病理学检查均证实为原发性肝细胞癌。其中男31例,年龄29~68 岁,平均(48.36±2.13)岁;女14例,年龄32~73岁,平均(51.41±3.17)岁。手术完成后,所有标本均先给予0.9%氯化钠溶液冲洗以去除血污,然后修剪除去坏死组织,再用10%福尔马林保存固定,最后在1 周内完成石蜡包埋,连续切片。Edmondson 病理分级:高分化11例,中分化17例,低分化17例。TNM 分期:Ⅰ+Ⅱ期32例,Ⅲ+Ⅳ期13例。
1.2 检测方法 将标本分为3 组。肝细胞癌(HCC)组:HCC 肿瘤组织标本45例;癌旁肝组织组:距离肿瘤边缘1~2 cm 的肝脏组织30例;远癌肝组织组:距离肿瘤边缘组织>5 cm 肝组织30例。全部标本组织固定、常规脱蜡、脱水、透明、封片、石蜡包埋。免疫组化采用SP 法,mTOR 兔多克隆抗体和eIF4E 兔多克隆抗体购自美国Santa Cruz 公司,免疫组化SP 试剂盒购自北京中杉生物工程公司,DAB 显色试剂盒购自北京中杉生物工程公司。操作均按说明进行,每组采用已知的mTOR 与eIF4E 的阳性片(乳腺癌)作为阳性对照,分别以PBS、同源正常IgG 兔的血清替代一抗作为阴性对照。
1.3 结果分析 高倍镜下,细胞内mTOR 和elF4E 均大量定位于细胞质,elF4E 少量定位于细胞核,阳性信号为细胞胞浆染色为淡黄色、棕黄色或棕褐色。高倍镜下观察mTOR 和eIF4E 免疫组化结果。实验结果图像采用Biosens Digital Imaging System v1.6 图像分析系统进行定量分析。mTOR 和eIF4E 免疫组化结果的染色标记强度用平均灰度值(average aensity)表示,染色标记越强,平均灰度值越大,比较各实验组阳性表达区域平均灰度值的差异,同时分析在同一组织内mTOR和eIF4E 表达的相关性。
1.4 统计学分析 所有实验数据均采用SPSS 17.0 软件进行分析,灰度值用(±s)表示,癌组织、癌旁组织、远癌组织3 组灰度值比较采用单因素方差分析法,两两比较采用Bonferroni 统计学方法,两组变量间的统计学相关性分析采用Pearson 线性相关分析,检验标准α=0.05。
2 结果
2.1 mTOR、eIF4E 染色情况 在肝细胞癌组织、癌旁组织及远癌肝组织组中,mTOR 的阳性信号呈棕黄色或黄色,且主要定位于细胞质内,见图1、2、3。eIF4E 阳性信号呈棕黄色或黄色,大部分eIF4E 蛋白以弥漫性分布或散在颗粒状分布存在于胞浆中,只有少部分分布于胞核中,见图4、5、6。

图1 mTOR 在肝癌肝组织中的表达(SP×400)

图2 mTOR 在肝癌肝组织中的表达(SP×400)
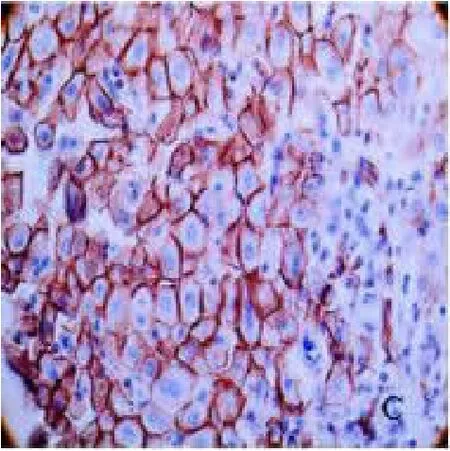
图3 mTOR 在癌旁肝组织中的表达(SP×400)

图4 eIF4E 在远癌肝组织中的表达(SP×400)
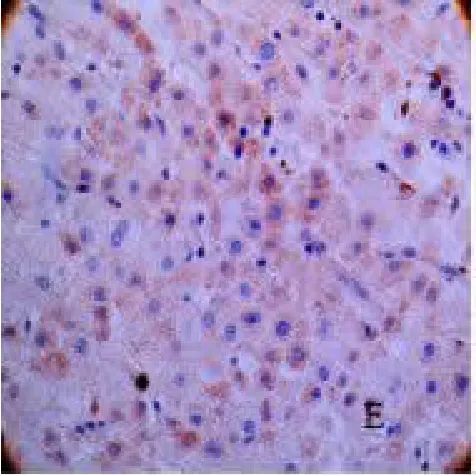
图5 eIF4E 在癌旁肝组织中的表达(SP×400)

图6 eIF4E 在癌旁肝组织中的表达(SP×400)
2.2 mTOR、eIF4E 表达情况 癌、癌旁、远癌组织中mTOR、eIF4E 的表达强度差异有统计学意义(FmTOR=261.985、FeIF4E=155.601,P 均<0.001)。进一步两两比较,癌与癌旁组、癌与远癌组、癌旁与远癌组差异均有统计学意义(P 均<0.001),见表1、2、3。
2.3 mTOR 和eIF4E 表达的相关性 定量分析得到的3 组数据分别行两因子相关性分析,其中癌组织rs=0.315,P=0.006;癌旁组织rs=0.445,P =0.003;远癌组织rs=0.392,P =0.014。在癌组织、癌旁组织及远癌组织中两种因子的相关分析,P 均<0.05,rs均为正数,在3 组组织中mTOR 和eIF4E 表达均存在相关性,且呈正相关。
表1 mTOR、eIF4E 在癌、癌旁、远癌组织中的灰度值比较(±s,%)

表1 mTOR、eIF4E 在癌、癌旁、远癌组织中的灰度值比较(±s,%)
组别 n mTOR eIF4E癌组45 159.64±22.51 147.03±25.13癌旁组 30 66.41±4.62 91.32±9.58远癌组 30 22.35±5.87 21.75±6.03 F 261.985 155.601 P <0.001 <0.001

表2 mTOR 在各组中表达的Bonferroni 检验结果

表3 eIF4 在各组中表达的Bonferroni 检验结果
3 讨论
在细胞分裂、生长及增殖过程中,mTOR 的调控作用至关重要。mTOR 是细胞开启蛋白质翻译过程的闸门,并且提供必需物质保证细胞由G0 /G1 期正常进入S 期,所以其是细胞内分解代谢和合成代谢过程中的控制台。其活性作用主要受PI3K/AKT 和AMPK 两条途径调节,mTOR 激酶的活性受到FATC 与FAT 结构在分子内部协同作用的调节,而这则是必须由FATC 与FAT 相结合作为基础的[2],而在细胞多种不同信号的共同刺激下,细胞内对mTOR 的调节主要是通过PI3K/AKT 及AMPK 通路途径发挥作用的。一般情况下,体内分泌的生长因子可以通过激活PI3K 途径来实现对mTOR 的激活。AKT 通过两种方式激活mTOR:一种是直接磷酸化激活mTOR;另一种是通过磷酸化TSC1/TSC2 二聚体,并抑制其活性,来实现对mTOR 途径的调节[3-4]。当AMP 的数量增多,而ATP的数量下降时,AMPK 通路活性被激活,被激活后的AMPK 可以通过磷酸化途径激活TSC1/TSC2 二聚体,进而抑制mTOR 活性的表达。
eIF4E 之所以能够参与mRNA 翻译的启动,完全是因为其可以特异性地结合mRNA5’端帽结构[5],其对ATP 具有依赖性。mTOR 活化后可磷酸化的两个下游分子,翻译抑制分子eIF4E 结合蛋白(4EBPS)和核糖体蛋白p70S6K,4EBPS 磷酸化后失活,因而降低eIF4E 的结合能力,使eIF4E 与之分离,启动蛋白质的翻译。而与此相关的文献报道表明,mTOR 和eIF4E 在浸润性导管癌中表达增加可能与乳腺癌的发生和转移相关联[6]。mTOR 的抑制剂最近被发现对各种非霍奇金淋巴瘤(NHLS)具有确切的治疗效果,如雷帕霉素和依维莫司,已被用作癌症的治疗而取得一定的成功,在此过程中进一步证实抑制eIF4E 的活性是抑制mTOR 的关键效应物[7-8]。国内亦有研究表明,mTOR 信号通路在肾癌的发生发展过程中同样具有重要作用[9]。随着研究的进展,分子靶向治疗有望取得更大进展。
本实验结果显示,mTOR 和eIF4E 在原发性肝癌组织中高表达,说明细胞蛋白质合成抑制减弱,且二者升高呈现正相关,在肝癌发展的过程中可能具有一定的协同作用。mTOR 的异常激活致使下游底物4EBPS蛋白磷酸化失活,释放与其结合的eIF4E,加快细胞蛋白质合成,从而促进细胞的生长和恶性转化[10]。mTOR 和eIF4E 在原发性肝癌的发生发展过程中具有重要作用,如今对于mTOR 与eIF4E 的信号传导过程已有较深的认识,如何阻断传导过程可能成为将来肝细胞癌药物治疗的新方向。
[1] Sehgal S N.Sirolimus:its discovery,biological properties,and mechanism of action[J].Transplant Proc,2003,35(3 Suppl):7S-14S.
[2] 黄嘉佳,林桐榆.mTOR 通路及其抑制剂抗肿瘤的研究进展[J].癌症,2007,(12):1397-1403.
[3] Marzec M,Kasprzycka M,Liu X,et al.Oncogenic tyrosine kinase NPM/ALK induces activation of the rapamycin-sensitive mTOR signaling pathway[J].Oncogene,2007,26(38):5606-5614.
[4] Pelletier C L,Maqqi L B Jr,Brady S N,et al.TSC1 sets the rate of ribosome export and protein synthesis through nucleophosmin translation[J].Cancer Res,2007,67(4):1609-1617.
[5] 刘丽萍,于卉影,马东初.eIF4E 的研究进展[J].细胞与分子免疫学杂志,2005,(S1):118-121.
[6] Hu A,Sun M,Yan D,et al.Clinical significance of mTOR and eIF4E expression in invasive ductal carcinoma[J].Tumori,2014,100(5):541-546.
[7] Kuo S H,Hsu C H,Chen L T,et al.Lack of compensatory pAKT activation and eIF4E phosphorylation of lymphoma cells towards mTOR inhibitor,RAD001[J].Eur J Cancer,2011,47(8):1244-1257.
[8] Satheesha S,Cookson V J,Coleman L J,et al.Response to mTOR inhibition:activity of eIF4E predicts sensitivity in cell lines and acquired changes in eIF4E regulation in breast cancer[J].Mol Cancer,2011,10:19.
[9] 邢建武,于硕鹏.抑制剂PI-103 对786-O 细胞株PI3K/Akt/mTOR信号通路的影响[J].河南医学研究,2013,22(5):649-651.
[10] Schalm S S,Fingar D C,Sabatini D M,et al.TOS motif-mediated raptor binding regulates 4E- BP1 multisite phosphor and function[J].Curr Biol,2003,13(10):797.

