腹腔镜胃间质瘤切除术的外科技巧及应用价值
赵建国,王震侠,阿斯楞
(内蒙古医科大学附属医院,内蒙古 呼和浩特,010050)
胃肠间质瘤(gastrointestinal stromal tumor,GIST)对传统放化疗不敏感,外科手术仍是有望达到根治GIST 的有效手段,随着腹腔镜技术的发展,利用腹腔镜技术施行GIST 切除术已越来越多。本研究报道了52 例腹腔镜GIST 切除术,以探讨腹腔镜技术在GIST 外科治疗中的应用价值。
1 资料与方法
1.1 临床资料收集2005 年1 月至2013 年12 月共52 例患者,其中男33 例,女19 例;35 ~72 岁,平均(57.6±3.5)岁;均行胃镜、CT 及超声内镜检查。肿瘤直径1.6 ~14.3 cm,平均(4.82±0.9)cm,其中4 例小于2 cm,32 例2~5 cm,14 例5 ~10 cm,2 例大于10 cm。肿瘤位于贲门胃底部8 例,胃体部40 例,胃窦部4 例。2 例因肿瘤出血保守治疗无效行急诊手术。
1.2 手术方法手术由同一组手术人员完成。均气管插管全麻,患者取头低脚高、两腿分开仰卧位。术者常规立于患者两腿之间与左侧(按实际需要变换位置)。脐下做弧形小切口,建立气腹;穿刺观察孔Trocar,置入30 度腹腔镜,常规探查,明确肿瘤位置、大小及有无转移等情况。再分别于左、右腋前线肋缘下约2 cm 处穿刺12 mm、5 mm Trocar;其中左侧12 mm Trocar 为主操作孔,右侧5 mm Trocar 为牵引孔,最后于左锁骨中线平脐穿刺5 mm Trocar 作为牵引孔(图1)。根据肿瘤位置决定手术切除的方式。
1.2.1 肿瘤位于胃体部 如肿瘤位于胃体大弯侧前壁,牵引肿瘤,用Endo-GIA 距肿瘤至少2 cm 以上切断胃壁,如肿瘤较小,则用1 枚Endo-GIA 直接切除部分胃即可;如肿瘤较大,则用至少2 枚Endo-GIA 楔形切除部分胃。如肿瘤位于胃体大弯后壁,则先切开胃结肠韧带进入小网膜囊,游离后将胃大弯向上掀起,用Endo-GIA 楔形切除部分胃;如肿瘤位于胃底部,则向上全程切开脾胃韧带,游离整个胃底(图2)。再使用Endo-GIA 距肿瘤边缘2 cm 以上完整切除肿瘤(图3、图4)。肿瘤较大时,需行胃底楔形切除术。如肿瘤位于胃小弯侧,游离肝胃韧带,将胃翻向下后方也按前述方法切除。
1.2.2 肿瘤位于贲门部 行胃近端切除术,先切开胃结肠韧带,向上切开脾胃韧带,游离整个胃底;再沿肝下缘游离小网膜,打开左右膈肌三角,裸化腹段食管,解剖贲门,切断迷走神经前干左支、右干后支,距肿瘤下缘2 cm 以上用Endo-GIA 切断胃壁,再取上腹正中约5 cm 切口,将近端胃切除后,以管状吻合器行食管胃吻合。
1.2.3 肿瘤位于胃窦部 行远端胃切除术,同样游离远端胃后,距肿瘤上缘2 cm 以上用Endo-GIA 切断胃壁,上腹正中取约4 cm 切口,用荷包钳距肿瘤约3 cm 处断胃,移除病灶后,由此切口将胃提出切口外,使用管状吻合器在腔外行毕Ⅰ式吻合。
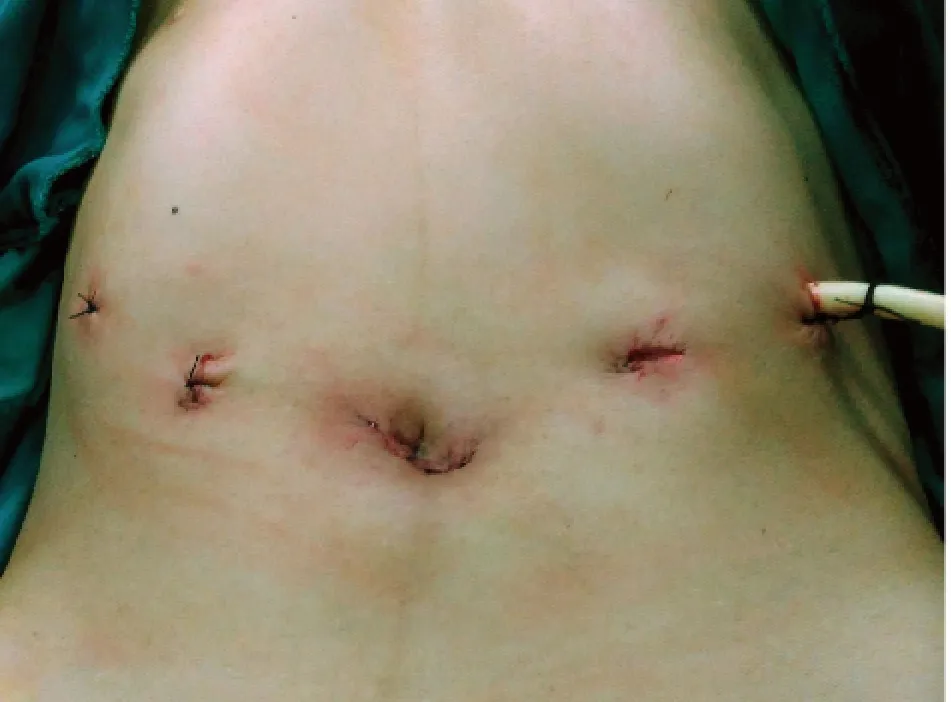
图1 操作孔与牵引孔位置
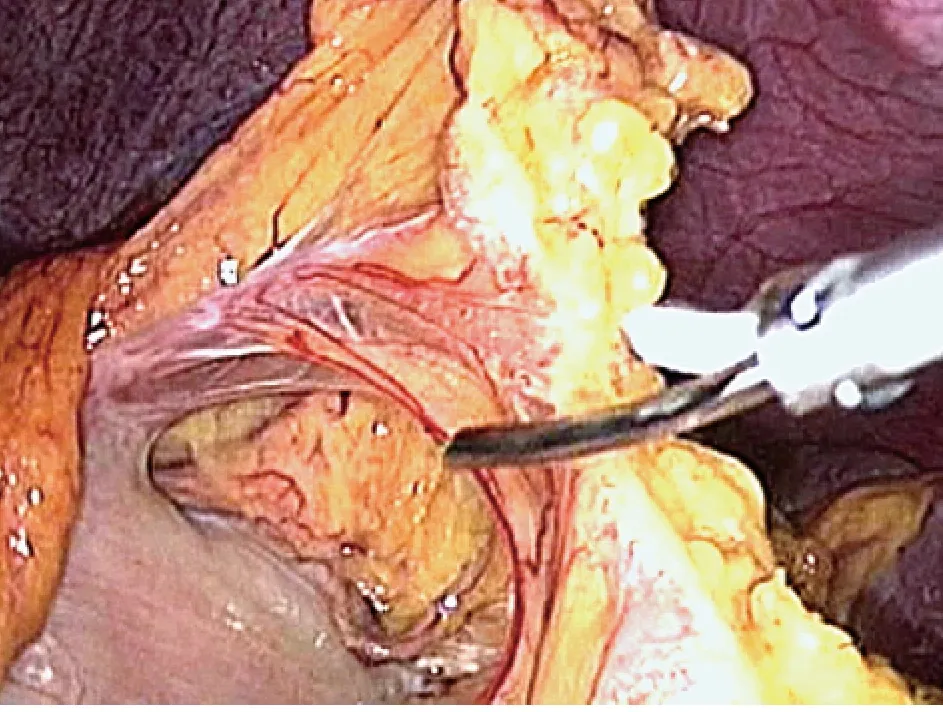
图2 切开胃结肠韧带与脾胃韧带
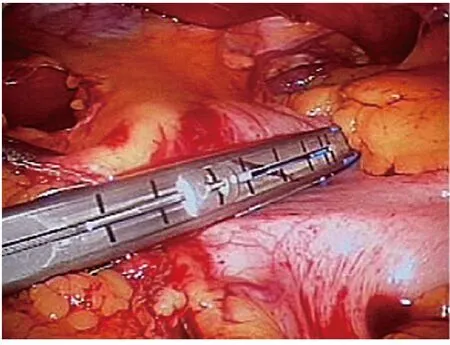
图3 使用Endo-GIA 切除肿瘤

图4 切除肿瘤后胃壁闭合残端
2 结 果
腹腔镜手术均成功完成,其中43 例行胃楔形部分切除术,6 例行近端胃切除术,3 例行远端胃切除。手术时间平均(150.0±16.5)min。术后1 例出现腹腔出血,再次手术痊愈;无吻合口漏发生。术后3~7 d 拔除胃管,术后住院7 ~10 d,无死亡病例。术后随访3 ~32 个月,无复发、转移。肿瘤均无破裂,病理检查提示切缘均为阴性。术后免疫组化提示34 例患者CD117 表达阳性,40 例CD34 表达阳性。根据Fletcher 关于复发风险的分类[1],即基于肿瘤大小及核分裂数量的间质瘤危险分级标准,10 例为极低风险,19 例低风险,15 例中度复发风险,8 例高度复发风险。15 例中度复发风险、8 例高度复发风险病例采用伊马替尼治疗。
3 讨 论
GIST 为常见的间质肿瘤,总发病率为10 ~20/100 万[2]。在整个胃肠道均可发生,最常发生于胃(50%~60%),其次为小肠(20%~30%)、结直肠(10%)、食管(5%),其余分布在腹腔的其他位置[3]。免疫组化特点表现为高表达CD117 与CD34,85%~95%为阳性表达,仅约15%阴性表达。此外,GIST 也阳性表达Vimentin、Actin、S100 蛋白[4]。
就GIST 的生物学特性而言,除小于1 cm 的肿瘤,任何肿瘤都被视为潜在恶性[5]。治疗目标是达到外科根治切除,目前利用腹腔镜技术行GIST 切除已被作为治疗无转移GIST 的金标准[5-6]。外科手术应遵循肿瘤的完整切除、避免肿瘤破碎及肉眼可见切缘阴性的原则[7]。一般不要求淋巴结清扫,因为淋巴结转移极其罕见。有研究将胃间质瘤手术进行淋巴结清扫及未进行淋巴结清扫的病例分别分组,进行随访比较,结果发现两组生存率差异无统计学意义[8]。腹腔镜GIST 切除不仅可取得开腹手术相同的效果,而且在术后疼痛、手术创伤及住院时间方面均具有优势[9]。以往建议腹腔镜切除GIST 直径最好在2 cm 以下,现在认为肿瘤大小并不影响腹腔镜手术的开展实施[10]。
手术方式应根据肿瘤位置灵活个体化选择,而且不同位置的肿瘤也决定了手术操作的难易程度。一般而言,胃体部肿瘤手术操作相对容易,小弯侧及贲门胃底部肿瘤手术难度相对较大。对肿瘤的准确定位很重要,如肿瘤较小不易发现,可联合胃镜定位。位于胃体大弯侧肿瘤手术切除相对容易,前壁的肿瘤直接用Endo-GIA 切除即可,如肿瘤位于后壁,则需打开胃结肠韧带暴露。肿瘤位于胃底时,应切断胃短血管,彻底游离胃底,切除时应注意既要保证肿瘤切缘,又要保证与贲门保持一定距离,避免术后贲门入口狭窄。笔者认为,肿瘤位于胃小弯侧时,手术切除稍有难度,在充分游离肝胃韧带后,建议切开胃结肠韧带,将胃向上提起,由胃后方进行肿瘤切除。如肿瘤位于胃底贲门太大时,必要时可于助手侧再增加一个牵引孔,助手将胃大弯侧展开,向上提起,沿胃后向上彻底游离至贲门后,这样利于下一步胃短血管的处理,也尽可能遵循了肿瘤的“非接触原则”。操作时应避免直接抓持肿瘤,笔者建议抓持肿瘤周边约1 cm 处,肿瘤太大难以抓持时,可考虑用缝线悬吊,但不主张全层缝合。笔者建议采用标本袋取出标本,避免腹腔污染及肿瘤切口种植。笔者体会,此手术对团队的协作要求较高,最好搭配相对固定的手术组成员。一方面术者应具备熟练的腔镜下操作技术,另一方面助手的角色也很重要,需要及时领会术者的操作意图。
2004 年欧洲肿瘤医学会提出了治疗GIST 的共识。利用CD117、CD34、S-100、desmin、SMA 进行免疫组化染色定位标准程序。外科治疗应保证肿瘤切缘阴性,对伊马替尼治疗反应的最优标准不仅应包括肿瘤的大小与疾病的稳定,而且应包括在CT 或代谢活动方面肿瘤密度的减少。以伊马替尼为基础的辅助治疗很大程度上改变了本病的治疗途径。对于行肿瘤R0 或R1 切除后中等或高危复发风险的患者,伊马替尼被作为常规辅助治疗,研究显示其能增加患者无病生存期[11]。美国FDA 与欧洲药物机构已同意伊马替尼作为R0 切除后患者的辅助治疗,可增加转移肿瘤患者的长期存活,而且可使局部进展期肿瘤减小降期,从而允许外科手术切除。本组病例中中度及高度复发风险患者均行伊马替尼治疗。
因此,应用腹腔镜技术治疗GIST 具有明显优势,随着临床外科医师的不断探索,腹腔镜技术在胃间质瘤外科手术治疗方面将体现更重要的临床应用价值,具有广阔的发展空间。
[1] Fletcher CD,Berman JJ,Corless C,et al.Diagnosis of gastrointestinal stromal tumors:A consensus approach[J].Hum Pathol,2002,33(5):459-465.
[2] Sexton JA,Pierce RA,Halpin VJ,et al.Laparoscopic gastric resection for gastrointestinal stromal tumors[J].Surg Endosc,2008,22(12):2583-2587.
[3] Valle M,Federici O,Carboni F,et al.Gastrointestinal stromal tumors of the stomach:the role of laparoscopic resection.Singlecentre experience of 38 cases[J].Surg Endosc,2014,28(3):1040-1047.
[4] Debiec-Rychter M,Wasag B,Stul M,et al.Gastrointestinal stromal tumours(GISTs)negative for KIT(CD117 antigen)immunoreactivity[J].J Pathol,2004,202(4):430-438.
[5] De Vogelaere K,Hoorens A,Haentjens P,et al.Laparoscopic versus open resection of gastrointestinal stromal tumors of the stomach[J].Surg Endosc,2013,27(5):1546-1554.
[6] Melstrom LG,Phillips JD,Bentrem DJ,et al.Laparoscopic versus open resection of gastric gastrointestinal stromal tumors[J].Am J Clin Oncol,2012,35(5):451-454.
[7] Al Rasheedi S,Mosnier H.Laparoscopic resection of gastric stromal tumor[J].J Visc Surg,2010,147(6):e359-363.
[8] Joensuu H,Fletcher C,Dimitrijevic S,et al.Management of malignant gastrointestinal stromal tumours[J].Lancet Oncol,2002,3(11):655-664.
[9] Tabrizian P,Sweeney RE,Uhr JH,et al.Laparoscopic resection of gastric and small bowel gastrointestinal stromal tumors:10-year experience at a single center[J].J Am Coll Surg,2014,218(3):367-373.
[10] De Vogelaere K,Van Loo I,Peters O,et al.Laparoscopic resection of gastric gastrointestinal stromal tumors(GIST)is safe and effective,irrespective of tumor size[J].Surg Endosc,2012,26(8):2339-2345.
[11] Dematteo RP,Ballman KV,Antonescu CR,et al.Adjuvant imatinib mesylate after resection of localised,primary gastrointestinal stromal tumour:a randomised,double-blind,placebo-controlled trial[J].Lancet,2009,373(9669):1097-1104.

