连续施用发酵猪粪对土壤中四环素抗性基因数量的影响
彭 双,王一明,林先贵*(1.中国科学院南京土壤研究所,土壤与农业可持续发展国家重点实验室,江苏 南京 210008;2.中国科学院南京土壤研究所-香港浸会大学土壤与环境联合开放实验室,江苏 南京 210008)
连续施用发酵猪粪对土壤中四环素抗性基因数量的影响
彭 双1,2,王一明1,2,林先贵1,2*(1.中国科学院南京土壤研究所,土壤与农业可持续发展国家重点实验室,江苏 南京 210008;2.中国科学院南京土壤研究所-香港浸会大学土壤与环境联合开放实验室,江苏 南京 210008)
为了研究连续施用发酵猪粪之后,土壤中抗性基因的数量以及发酵猪粪的施用量对土壤抗性基因的影响,采用实时荧光定量PCR方法,对稻麦轮作模式下连续6年施用4.5t/hm2和9.0t/hm2发酵猪粪的土壤进行了四环素抗性基因(TRGs)的检测和定量分析.在施用发酵猪粪的土壤中能够检测到9种TRGs.施用发酵猪粪显著增加了土壤中tetG、tetL、tetB(P)、tetO、tetW的绝对数量,其中tetB(P)、tetW、tetO的绝对数量受到了施肥用量的影响;而tetZ、tetC和tetS的绝对数量则没有受到施肥的影响.上述8种TRGs在同一施肥处理的0~5cm、5~10cm以及10~20cm土壤中的相对丰度分布均无显著差异.发酵猪粪的施用也显著增加了tetG、tetL、tetB(P)和tetO的相对丰度,但是仅有tetO的相对丰度受到了施肥用量的显著影响.本研究表明,在稻麦轮作模式下,农田土壤中的TRGs数量会受到发酵猪粪中残留TRGs的影响,连续施用该粪肥会显著增加土壤中tetG、tetL、tetB(P)和tetO的绝对数量和相对丰度.因此,需要优化畜禽粪堆肥发酵工艺,以减少抗性基因在粪肥中的残留.
四环素抗性基因;粪肥农用;基因污染;耐药性
近年来,由于滥用抗生素而导致大量耐药性致病菌的出现引起了人们对抗生素及抗生素抗性基因(ARGs)扩散的广泛关注.ARGs在环境中的持久性残留,以及在不同环境介质中的传播、扩散可能比抗生素本身的环境危害更大[1].越来越多的证据表明水产养殖、动物饲养、农业施肥以及生活污水处理等人类活动促进了抗生素抗性在环境中的传播[2].畜禽粪便中含有高水平的抗生素[3-4]、抗生素抗性微生物[5-7]、重金属(与抗性基因之间有协同选择作用)[8-9]和抗性基因[3,6-8],其资源化利用过程中对环境造成的影响是目前越来越受关注的问题.
土壤是人类病原菌抗性基因的主要来源[10],也是畜禽粪便消纳的主要场所.因此,畜禽粪污染或者施用到土壤后对土壤抗性菌和抗性基因的影响也是当前抗性扩散研究的热点之一.一些研究者从不同的角度研究了畜禽粪肥施用对土壤抗性的影响.如Sengeløv等[11]发现土壤细菌的四环素抗性水平可以在短期内因猪粪浆的施加而上升,而且可以随着猪粪浆施用量的增加而增加. Byrne-Bailey等[12]的研究结果表明施用猪粪会显著增加土壤中可培养微生物对四环素和磺胺类抗生素的抗性水平,施用猪粪浆是影响土壤中四环素及磺胺类抗性基因丰度的重要因素[13].
为了减少新鲜畜禽粪便中的有害物质对环境的污染,工厂化堆肥发酵有机肥具有很大的应用前景.研究表明,堆肥能够显著降低粪肥中残留抗生素的浓度[14-16],并且能够降低其中的抗性基因含量[17-19],是减少粪肥污染的一种方式[20-21].目前,畜禽粪便发酵有机肥的施用越来越广泛,但是关于畜禽发酵有机肥中残留抗性基因的在土壤中的留存和污染能力;连续施用有机肥之后,农田土壤中抗性基因的丰度;以及有机肥的施用量对土壤抗性基因的影响却鲜有研究.
四环素类抗生素是目前使用最为广泛的一种抗生素,自1953年发现第一个四环素抗性基因(TRGs)以来,陆续发现的TRGs已达40多种[22].跟多数抗性基因类似,TRGs一般通过5种方式起作用:编码抗生素外排泵、编码核糖体保护蛋白、编码抗生素钝化/降解酶、降低药物的渗透性和靶向修饰.其中前2种是TRGs最主要的作用方式.目前,超过22种TRGs已经在不同的环境样品中被检测到[23].但是已有的研究多集中于养殖场周边污染土壤以及新鲜或简单沤制/储存的粪便施用后的土壤,缺乏对于连续施用发酵粪肥后土壤中TRGs的定位观测和研究.此外,稻麦轮作是江苏省主要的农作模式,而有关该模式下水稻土壤中TRGs的研究仅有零星报道.因此,本研究以中国科学院常熟农业生态实验站长期定位施用发酵猪粪试验地为平台,靶标在不同环境中被多次报道的23种TRGs,以期揭示在稻麦轮作模式下水稻土壤中的TRGs数量,以及连续施用不同重量的发酵猪粪对土壤TRGs的影响,为有机肥的生态施用提供依据,并为进一步研究稻麦轮作模式下粪肥施用对土壤TRGs的影响提供参考.
1 材料与方法
1.1 供试发酵猪粪及施肥处理
供试的发酵猪粪(CM)来自江苏常熟的某规模化养猪场附近的有机肥厂,该有机肥厂以养猪场猪粪为原料,经过工厂化条垛式堆肥发酵制成商品有机肥(即发酵猪粪),该厂年产量3000~5000t.自2006年开始,在中国科学院常熟农业生态实验站的8块试验田(30m2)分别进行施肥处理,该试验田自实验站成立(1987年)以来无粪肥施用历史.采用稻麦轮作的耕作方式,在稻麦插秧/播种前施肥,其中4块试验田每季施用的发酵猪粪量为4.5t(干重)/hm2(记为LC),其余4块施用9.0t(干重)/hm2的发酵猪粪(记为HC),并以实验站内不施肥的4块空地作为对照(记为CK).本实验区土壤类型俗称为乌栅土,中国土壤系统分类为潜育水耕人为土.发酵猪粪的基本性质为pH 6.69、有机质含量42.77%、全氮1.43%、全磷(P2O5)3.67%、全钾(K2O)1.52%.土壤的基本性质为pH 7.48、有机质含量41.8g/kg、全氮1.9g/kg、全磷(P2O5) 2.7g/kg、全钾(K2O) 21.4g/kg.
1.2 土样的采集和保存
在2011年稻季末(施肥第6年),用直径2cm的土钻在各个试验田(HC、LC、CK)分别打6个孔,采集0~20cm土层的土壤样品,将所取土样分0~5cm、5~10cm以及10~20cm三层收集,挑出残留的植物根系和石块并混合均匀,4℃条件下带回实验室,-40℃冷冻保存待测.
1.3 发酵猪粪TRGs的检测和鉴定
取-40℃保存的2011年插秧前施用的发酵猪粪样品,提取总DNA,提取方法参照FastDNA®SPIN Kit for Faces (MP Biomedicals, Santa Ana,CA)试剂盒,用核酸蛋白质分析仪NanoDrop ND-1000 (NanoDrop Technologies, Wilmington,DE)测定DNA浓度,-20℃保存待测.
用PCR方法对发酵猪粪中的TRGs进行检测,tet(B(P)、M、O、Q、S、T、W)和otrA所用的引物和PCR程序参考Aminov等[24],tet(A、B、C、D、E、H、J、Y、Z、30)参考Aminov等[25],tet(G、X、K)参考Ng等[26],tetU和tetL分别参考Perreten等[27]和You等[28].25μL的PCR体系中包括12.5μL的Premix EX TaqTMmixture (TaKaRa),2pmol的上下游引物,和大约150ng的模版DNA. 用2% (w/v)的琼脂糖凝胶在1× TAE的电泳缓冲液中分析PCR产物,重复3次,以无菌蒸馏水为阴性对照.
将发酵猪粪中检测到的TRGs PCR产物纯化,并连接到pEASY-T3 (TransGen Biotech,Beijing)载体上,转化感受态细胞(详细克隆步骤参见试剂盒说明书),通过蓝白斑筛选随机挑取6~8个转化子,用M13引物验证阳性,并将阳性转化子保存于含有0.1g/L氨苄青霉素的LB培养液中(将培养液与灭菌的80%甘油混合后在-20℃冷冻保存).取3个阳性转化子送交华大基因测序.将测得的序列提交到NCBI GenBank比对,确定所得的序列为目标基因序列.
1.4 土壤DNA的提取和TRGs的检测
取0.5g保存的土样提取土壤DNA,提取方法参照FastDNA®SPIN Kit for soil试剂盒,测定DNA浓度,-20℃保存.检测土壤中的TRGs,检测方法同1.3,以1.3中的阳性转化子质粒为阳性对照,无菌水为阴性对照.
1.5 TRGs的定量PCR(qPCR)分析
用E.Z.N.A.®Plasmid Mini Kit I(OMEGA,USA)试剂盒提取1.3中保存的阳性转化子质粒,并测定质粒的浓度以及纯度,参考Zhang等[29]计算质粒拷贝数.将质粒进行10倍的梯度稀释,用来制作qPCR标准曲线.用SYBR®Premix Ex TaqTMKit (TaKaRa)进行样品分析,20μL反应体系中含有10μL SYBR®Premix Ex TaqTM,0.5μM引物,1.0μL模版DNA(2~9ng DNA),以无菌水作为空白对照.每个样品3个重复,琼脂糖凝胶检测扩增的条带为目的条带并且熔解曲线仅有1个峰.扩增效率范围为95.4%~102%,R2值为0.990~1.000.根据土壤的质量和含水量计算TRGs的绝对数量(copy/g干土).同时对细菌16S rRNA基因进行定量,并计算TRGs与16S rRNA基因的比值(相对丰度),16S rRNA基因的定量方法参考Biddle等[30].
1.6 试验数据分析
所得数据用Microsoft Excel 2010和SPSS 13.0进行统计分析,并使用Duncan检验进行显著性分析(P<0.05),图由软件Origin 8.6绘制.
2 结果与讨论
2.1 土壤中TRGs的检测
因为HC处理施用的发酵猪粪量较高,推测该处理的土壤中可通过PCR方法检测到的TRGs种类比LC处理多,因此本研究仅检测了HC处理土壤中的TRGs.共检测到9种TRGs(表1),其中4种为编码核糖体保护蛋白的基因(tetB(P)、tetO、tetS、tetW),4种为编码外排泵的基因(tetG、tetL、tetZ、tetC),1种(tetX)为编码钝化酶的基因.9种TRGs中只有tetO完全是由发酵猪粪带入土壤,在不施肥土壤中没有检测到该基因.
在发酵猪粪中有12种TRGs被检测到,其中5种为编码核糖体保护蛋白的基因,7种为编码外排泵的基因.在发酵猪粪中存在tetM、tetB、tetD 和tetY,并被带到了土壤中,但是通过PCR方法并没有在土壤中检测到这4种TRGs,可能原因是经过土壤的稀释作用、携带抗性基因细菌的死亡或者稻麦轮作环境的影响之后,这4种TRGs消解、不存在或者少量存在于土壤中.在土壤中检测到的9种基因中,除了tetZ,其他的8种基因均曾在养猪场附近的土壤中检测到[26],而且Zhu等[31]也在施用堆肥的田间土壤中检测到了tetO、tetW、tetC、tetG和tetL,说明这些基因广泛存在于受人类农业活动影响的土壤中.

表1 发酵猪粪、施用9.0t/hm2发酵猪粪的土壤以及不施肥土壤中检测到的TRGsTable 1 TRGs detected in the composted swine manure,the soil treated with 9.0t/hm2composted swine manure and soil without fertilizers
2.2 土壤中TRGs的绝对数量
经过连续6年的施肥处理,土壤中tetZ、tetC 和tetS的绝对数量与不施肥的土壤相比无显著差异,表明这3种基因的绝对数量没有受到施肥的显著影响.而tetG、tetL、tetB(P)、tetW和tetO的绝对数量显著提高(图1),其中tetW、tetO和tetB(P)均属于编码核糖体保护蛋白的基因,tetL 和tetG属于编码外排泵的基因,说明发酵猪粪中携带的编码核糖体保护蛋白和编码外排泵的TRGs均能在施肥土壤中存留下来.在施肥土壤中tetG的数量最多,其次是tetL和tetB(P). Zhu等[31]研究表明施用堆肥的土壤中tetG、tetL、tetA 和tetW的拷贝数最多,表明tetG和tetL在施用堆肥的土壤中大量存在.在不施肥的土壤中没有检测到tetO,而在施用发酵猪粪的土壤中tetO的数量超过了106copies/g.此外,0~5cm和5~10cm土层中的tetW、tetO、tetB(P)以及5~10cm土层的tetL受到了施肥用量的显著影响,施肥量越高,这3种基因的绝对数量越高.而10~20cm土层中的tetW、tetO、tetB(P),0~5cm、10~20cm土层中的tetL,以及3个土层中的tetG绝对数量均不受施肥用量的影响;该结果表明在耕作层土壤中,上层土壤中的TRGs绝对数量受施肥用量的影响比下层土壤高,尤其是5~10cm土层最为明显.
2.3 土壤中TRGs的相对丰度
为了降低土壤DNA提取效率和细菌数量背景值造成的影响,用TRGs的绝对数量与16S rRNA绝对数量的比值(即相对丰度)来分析携带TRGs的细菌在总细菌群落中所占的平均比例(图2).由表2可以看出:LC和HC处理的土壤中细菌16S rRNA的绝对数量显著高于CK(大于10倍),说明发酵猪粪的施用显著提高了土壤中细菌的数量;但是LC和HC处理土壤中tetZ、tetC 和tetS的绝对数量与CK无显著差异(图1);因此在施肥土壤中,由于细菌群落数量扩大所造成的稀释作用,使得携带tetZ、tetC和tetS的相对丰度显著低于不施肥土壤.
在10~20cm土层中,tetW的数量变化与以上3种TRGs一样,而在0~5cm和5~10cm土层中,HC处理中tetW的绝对数量显著高于CK,而tetW的相对丰度与CK无显著差异,说明连续施用发酵猪粪之后,0~5cm和5~10cm土层中的tetW绝对数量增加的幅度与细菌16S rRNA基因数量增加的幅度一致,这种增加可能是由于发酵猪粪提供的养分使土著抗性细菌繁殖引起,也有可能是发酵猪粪中携带的抗性细菌及抗性基因在土壤中的存活和繁殖引起,或者两者的共同作用引起.
与CK相比,HC和LC处理中tetG、tetL、tetB(P)和tetO的绝对数量和相对丰度均显著增加,说明施用发酵猪粪显著提高了细菌种群中携带该类TRGs的平均数量.除tetO (0~5cm和5~10cm)的相对丰度受到了施肥量的影响外,其余7个基因以及10~20cm土层中的tetO的相对丰度均不受施肥重量的影响,可能是由于本研究设置的施肥量不足以引起土壤中的这7种TRGs产生显著变化;或者是由于LC处理设置的施肥量已经使土壤中的这7种TRGs数量达到了最高阈值或平衡.Fahrenfeld等[32]提出土壤ARG的积累公式:ARG累积=ARG加入+ARG增加-ARG衰退±ARG径流-ARG渗透(其中ARG增加是指由于宿主的繁殖增长、抗生素的选择作用或ARG水平转移引起的ARG增加),可能是由于该公式中的一个或多个因素影响了土壤中TRGs的数量,使得施用不同用量发酵猪粪的土壤中,除tetO外的7个TRGs均无显著差异. tetO一般位于革兰氏阳性细菌的质粒上,且多存在于好氧细菌中[33],对猪粪进行好氧发酵处理可能有利于tetO的残留.
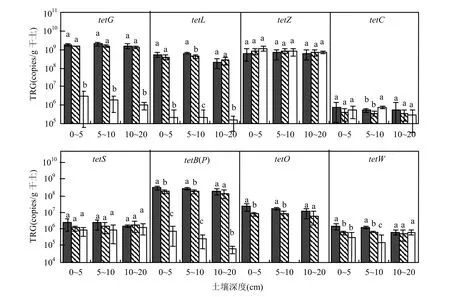
图1 施用发酵猪粪6年的土壤中8种TRGs的绝对数量Fig.1 The absolute abundance of the 8 TRGs in the soils treated with 4.5t/hm2and 9.0t/hm2composted swine manure and the soil without fertilizers
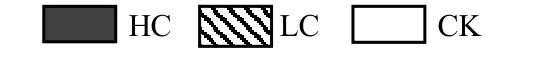

表2 土壤和发酵猪粪中16S rRNA的绝对数量Table 2 The abundance of bacteria in the soils treated with 4.5t/hm2and 9.0t/hm2composted swine manure, the soil without fertilizers and the composted swine manure
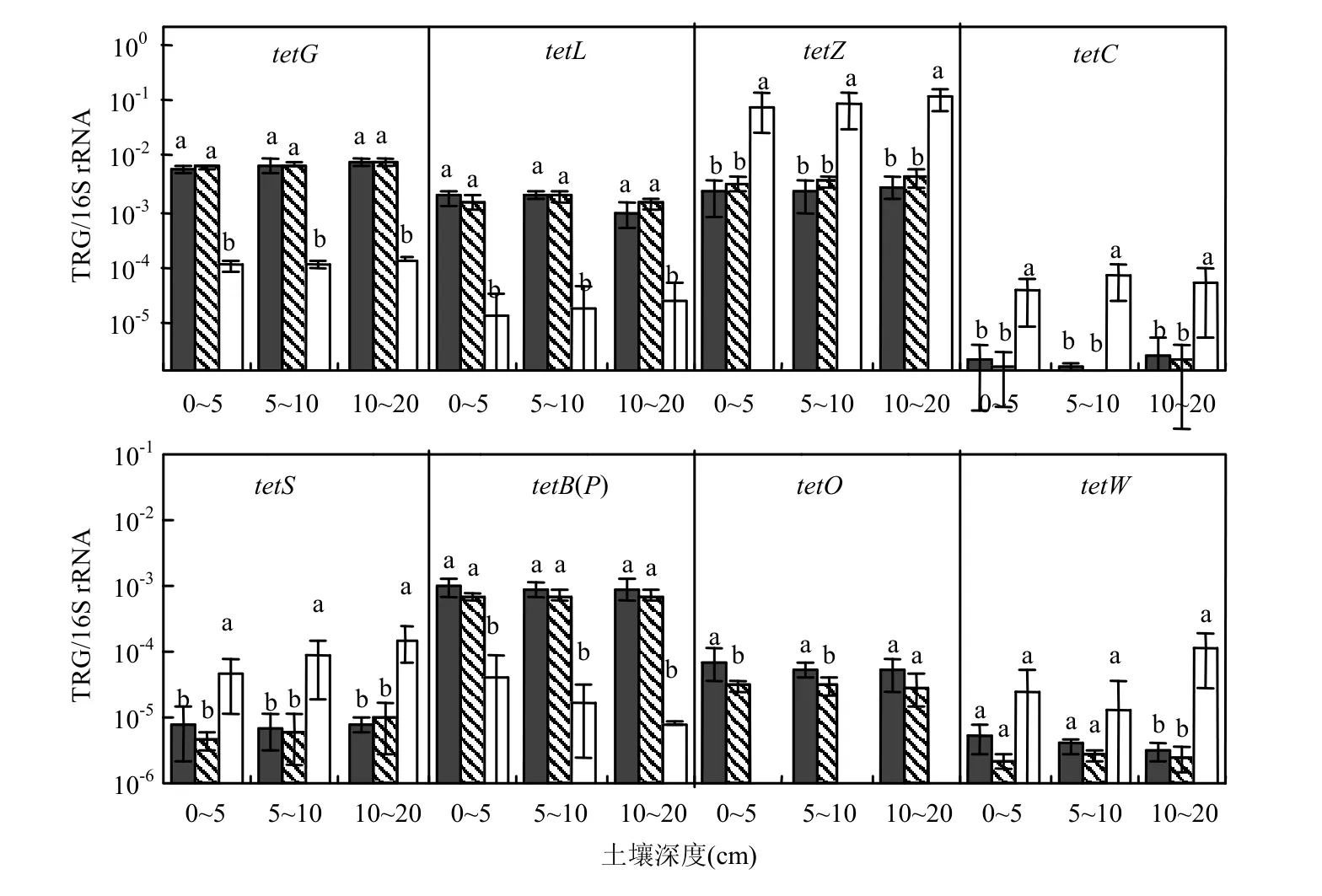
图2 施用发酵猪粪6年后土壤中TRG的相对丰度Fig.2 The relative abundance of 8 TRGs in the soils treated with 4.5t/hm2and 9.0t/hm2composted swine manure as compared with the soil without fertilizers
在耕作层的3个土壤深度之间,同处理中的各TRGs相对丰度并无显著差异,可能是因为本研究采集的是稻季末土壤,在水稻种植期淹水过程中,由于水分和养分的渗透扩散作用使携带同种TRGs的细菌在各处理耕作层土壤中均匀分布.
2.3 施用发酵猪粪对土壤TRGs的影响
发酵猪粪中的TRGs数量见表3,在分析的8 种TRGs中,tetG是土壤中数量最多的基因,而在发酵猪粪中数量最多的基因是tetL,其次是tetG 和tetZ,这3种基因的数量均超过了109copies/g(相对丰度>1%).表明本研究小型有机肥厂生产的供试发酵猪粪中残留了多种TRGs,而这些残留的TRGs影响了土壤中TRGs的组成和丰度.由于本研究只取了施肥6年中最近一次所施用的发酵猪粪进行分析,可能以前所施用的发酵猪粪中携带的TRGs种类或者数量与本次有所不同;但是,从图1和图2的结果可以看出,连续施用该发酵猪粪对土壤TRGs造成了显著影响.因此,对于此类有机肥厂,仍需要改变发酵方法或优化发酵工艺来降低其中携带的抗性基因以削减可能造成的污染风险.
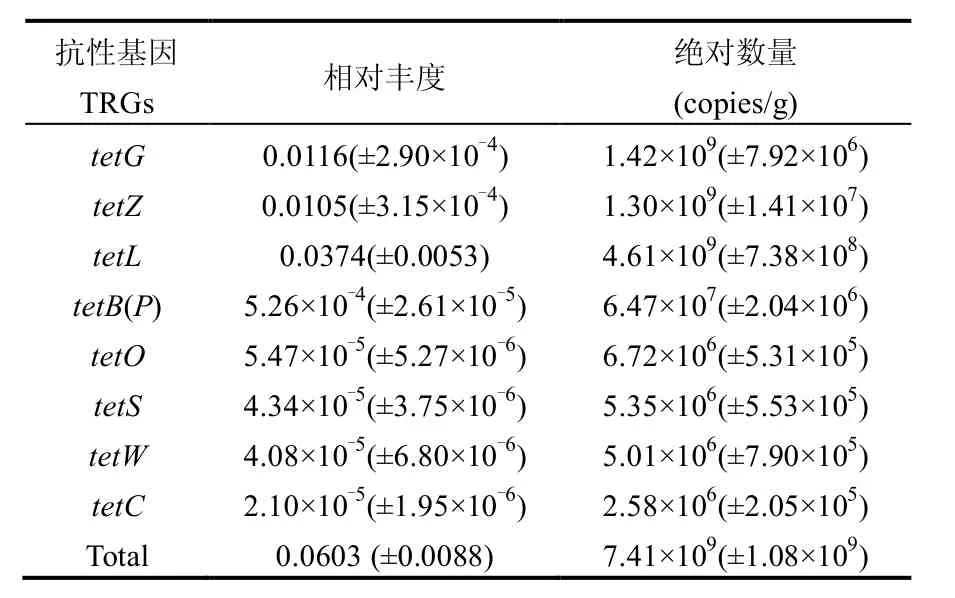
表3 发酵猪粪中TRGs的绝对数量和相对丰度Table 3 Relative abundance and absolute abundance of TRGs in the composted swine manure
粪肥主要通过以下3种方式影响土壤中的抗性基因:粪肥中残留的抗生素对土著抗性细菌的选择诱导作用,粪肥中抗性细菌的残存和渗入,以及可在细菌群落中水平转移的ARGs移动元件的汇集.已有研究表明向土壤中添加含有抗生素的水或者含有抗生素的稀释有机质并不能诱导土壤抗性细菌的增加,而且几乎不会改变微生物群落的组成[2].因此推测发酵猪粪中残留的抗生素不足以引起TRGs的显著增加,发酵猪粪中的养分及其携带的抗性细菌和抗性基因可能是引起土壤TRGs数量增加的主要因素.
Ghosh等[34]发现以农学上可接受的频率向农田施用经过处理的动物粪肥,不会引起土壤中抗性细菌的大量增加,而直接施用大量新鲜粪肥却可以.虽然施用含有高水平抗性细菌的粪肥会短期内增加土壤微生物的抗性水平,但是在粪肥施用的6个月之内,土壤细菌的抗性水平会回到施肥前的水平[11],说明粪肥驱动的抗性细菌可以在土壤中存活有限的一段时间,但是在这期间,土壤中的ARGs可能会水平转移到土壤土著细菌中[34].Schmitt等[13]检测了猪粪和施用猪粪前后的土壤中的四环素类抗性基因,结果发现施用粪肥后的土壤中含有的一部分抗性基因是原来土壤所没有的,是猪粪中特有的,证明这部分抗性基因是由于施用猪粪而带入的.由于研究方法的不同,粪肥施用对土壤可培养抗性细菌数量的影响与其对土壤抗性基因的影响并不是一致的.
本研究表明,在稻麦轮作模式下,连续施用含有残留TRGs的猪粪发酵有机肥会使土壤中某些TRGs的数量增加.由于抗性基因种类繁多,难以在研究中将所有已知种类的抗性基因全部包括,而且不同的抗性基因之间或许存在互补作用,某一类基因相对丰度的降低也可能伴随着另外一种基因相对丰度的增加同时发生;此外,不同的抗性基因有着不同的结局,例如本研究中的tetZ 和tetO所呈现的研究结果完全不同,这可能不仅仅取决于抗生素的选择作用,更取决于土壤中宿主细菌数量的消长以及基因发生水平转移的趋势.因此,创新研究ARGs的方法,深入了解不同ARG在环境中的特性及其污染风险,才能更好的指导农业及畜牧业生产活动,减少人类活动对环境ARGs的影响.
3 结论
3.1 本研究通过qPCR方法分析了连续施用携带TRGs的发酵猪粪对土壤TRGs数量的影响,在所分析的8种TRGs中,tetG、tetL、tetB(P)和tetO的绝对数量和相对丰度均明显增加,而tetZ、tetC、tetS和tetW受到的影响相对较小.
3.2 tetO是分析的8种TRGs中受施肥用量影响较大的基因,其在0~5cm及5~10cm土层土壤中的数量与施肥的用量显著正相关.
3.3 连续施用携带高量TRGs残留的发酵猪粪会显著增加土壤中TRGs的数量,发酵不彻底的猪粪与新鲜猪粪一样具有污染环境的风险.
[1]徐冰洁,罗 义,周启星,等.抗生素抗性基因在环境中的来源、传播扩散及生态风险 [J]. 环境化学, 2010,29(2):169-178
[2]Negreanu Y, Pasternak Z, Jurkevitch E, et al. Impact of treated wastewater irrigation on antibiotic resistance in agricultural soils [J]. Environ. Sci. Technol., 2012,46(9):4800-4808.
[3]Chee-Sanford J C, Mackie R I, Koike S, et al. Fate and transport of antibiotic residues and antibiotic resistance genes following land application of manure waste [J]. J. Environ. Qual., 2009,38(3):1086-1108.
[4]Alvarez J A, Otero L, Lema J M, et al. The effect and fate of antibiotics during the anaerobic digestion of pig manure [J]. Bioresour. Technol., 2010,101(22):8581-8586.
[5]Resende J A, Silva V L, de Oliveira T L, et al. Prevalence and persistence of potentially pathogenic and antibiotic resistant bacteria during anaerobic digestion treatment of cattle manure [J]. Bioresour. Technol., 2014,153:284-291.
[6]Hsu J T, Chen C Y, Young C W, et al. Prevalence of sulfonamide-resistant bacteria, resistance genes and integronassociated horizontal gene transfer in natural water bodies and soils adjacent to a swine feedlot in northern Taiwan [J]. J. Hazard Mater, 2014,277:34-43.
[7]Pakpour S, Jabaji S, Chenier M R. Frequency of antibiotic resistance in a swine facility 2.5 years after a ban on antibiotics [J]. Microb. Ecol., 2012,63(1):41-50.
[8]Ji X, Shen Q, Liu F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai; China [J]. J. Hazard Mater, 2012,235-236:178-185.
[9]Zhang F, Li Y, Yang M, et al. Content of heavy metals in animalfeeds and manures from farms of different scales in northeast China [J]. Int. J. Environ. Res. Public Health, 2012,9(8):2658-2668.
[10]Forsberg K J, Reyes A, Wang B, et al. The shared antibiotic resistome of soil bacteria and human pathogens [J]. Science,2012,337(6098):1107-1111.
[11]Sengeløv G, Agersø Y, Halling-Sørensen B, et al. Bacterial antibiotic resistance levels in Danish farmland as a result of treatment with pig manure slurry [J]. Environ. Int., 2003,28(7): 587-595.
[12]Byrne-Bailey K G, Gaze W H, Kay P, et al. Prevalence of sulfonamide resistance genes in bacterial isolates from manured agricultural soils and pig slurry in the United Kingdom [J]. Antimicrob. Agents Chemother., 2009,53(2):696-702.
[13]Schmitt H, Stoob K, Hamscher G, et al. Tetracyclines and tetracycline resistance in agricultural soils: microcosm and field studies [J]. Microb. Ecol., 2006,51(3):267-276.
[14]Dolliver H, Gupta S, Noll S. Antibiotic degradation during manure composting [J]. J Environ. Qual., 2008,37(3):1245-1253.
[15]Wu X, Wei Y, Zheng J, et al. The behavior of tetracyclines and their degradation products during swine manure composting [J]. Bioresour. Technol., 2011,102(10):5924-5931.
[16]Selvam A, Zhao Z, Li Y, et al. Degradation of tetracycline and sulfadiazine during continuous thermophilic composting of pig manure and sawdust [J]. Environmental Technology, 2013,34(16): 2433-2441.
[17]Hu Z, Liu Y, Chen G, et al. Characterization of organic matter degradation during composting of manure-straw mixtures spiked with tetracyclines [J]. Bioresour. Technol., 2011,102(15):7329-7334.
[18]Wu X, Wei Y, Zheng J, et al. The behavior of tetracyclines and their degradation products during swine manure composting [J]. Bioresour. Technol., 2011,102(10):5924-5931.
[19]Selvam A, Zhao Z, Wong J W. Composting of swine manure spiked with sulfadiazine, chlortetracycline and ciprofloxacin [J]. Bioresour. Technol., 2012,126:412-417.
[20]Selvam A, Xu D, Zhao Z, et al. Fate of tetracycline, sulfonamide and fluoroquinolone resistance genes and the changes in bacterial diversity during composting of swine manure [J]. Bioresour. Technol., 2012,126:383-390.
[21]Yu Z, Michel F C, Hansen G, et al. Development and application of real-time PCR assays for quantification of genes encoding tetracycline resistance [J]. Appl. Environ. Microbiol., 2005,71(11): 6926-6933.
[22]Thaker M, Spanogiannopoulos P, Wright G D. The tetracycline resistome [J]. Cell Mol. Life Sci., 2010,67(3):419-431.
[23]Zhang X X, Zhang T, Fang H H P. Antibiotic resistance genes in water environment [J]. Appl. Microbiol. Biotechnol., 2009,82(3): 397-414.
[24]Aminov R I, Garrigues-Jeanjean N, Mackie R I. Molecular ecology of tetracycline resistance: development and validation of primers for detection of tetracycline resistance genes encoding ribosomal protection proteins [J]. Appl. Environ. Microbiol., 2001,67(1):22-32.
[25]Aminov R I, Chee-Sanford J C, Garrigues N, et al. Development,validation, and application of PCR primers for detection of tetracycline efflux genes of gram-negative bacteria [J]. Appl. Environ. Microbiol., 2002,68(4):1786-1793.
[26]Ng L K, Martin I, Alfa M, et al. Multiplex PCR for the detection of tetracycline resistant genes [J]. Molecular and Cellular Probes,2001,15:209-215.
[27]Perreten V, Vorlet-Fawer L, Slickers P, et al. Microarray-based detection of 90 antibiotic resistance genes of gram-positive bacteria [J]. J. Clin. Microbiol., 2005,43(5):2291-2302.
[28]You Y, Hilpert M, Ward M J. Detection of a common and persistent tet(L)-carrying plasmid in chicken-waste-impacted farm soil [J]. Appl. Environ. Microbiol., 2012,78(9):3203-3213.
[29]Zhang T, Zhang M, Zhang X, et al. Tetracycline resistance genes and tetracycline resistant lactose-fermenting Enterobacteriaceae in activated sludge of sewage treatment plants [J]. Environ. Sci. Technol., 2009.43(10):3455-3460.
[30]Biddle J F, Fitz-Gibbon S, Schuster S C, et al. Metagenomic signatures of the Peru Margin subseafloor biosphere show a genetically distinct environment [J]. Proc. Natl. Acad. Sci. U S A,2008,105(30):10583-10588.
[31]Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms [J]. Proc. Natl. Acad. Sci. U S A, 2013,110(9):3435-3440.
[32]Fahrenfeld N, Knowlton K, Krometis L A, et al. Effect of manure application on abundance of antibiotic resistance genes and their attenuation rates in soil: field-scale mass balance approach [J]. Environ. Sci. Technol., 2014,48(5):2643-2650.
[33]Chopra I, Roberts M. Tetracycline antibiotics: mode of action,applications, molecular biology, and epidemiology of bacterial resistance [J]. Microbiology and Molecular Biology Reviews,2001,65(2):232-260.
[34]Ghosh S, LaPara T M. The effects of subtherapeutic antibiotic use in farm animals on the proliferation and persistence of antibiotic resistance among soil bacteria [J]. ISME J., 2007,1(3):191-203.
Abundance of the tetracycline resistance genes in a paddy soil after continuous application of composted swine manure for 6 years.
PENG Shuang1,2,3, WANG Yi-ming1,2, LIN Xian-gui1,2*(1.State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China;2.Joint Open Laboratory of Soil and the Environment, Institute of Soil Science, Chinese Academy of Sciences and Hong Kong Baptist University, Nanjing 210008, China). China Environmental Science, 2015,35(4):1173~1180
In the present study, the occurrence and abundance of tetracycline resistance genes (TRGs) were investigated in a paddy soil after continuous application of composted swine manure (9.0t/hm2and 4.5t/hm2) for 6years. Nine classes of TRGs (tetW, tetB(P), tetO, tetS, tetC, tetG, tetZ, tetL, and tetX) was detected in the soil applied with composted swine manure, among which the absolute abundance of tetG, tetL, tetB(P), tetO, tetW were significantly increased, and there were significantly more copies of tetB(P), tetW, tetO in the soil treated with 9.0t/hm2composted swine manure than with 4.5t/hm2, while the absolute abundance of tetZ, tetC and tetS was not influenced. There was no significant difference in the relative abundance of detected TRGs distributed with a depth of 0~5cm, 5~10cm, and 10~20cm in the same treatment. The relative abundance of tetG, tetL, tetB(P) and tetO was significantly increased in the soils treated with composted swine manure, but only tetO was influenced by the application weight of the manure. The results suggested that the residual TRGs in the composted swine manure shed further influence on the TRGs pool in soils with rice-wheat crop rotation, absolute and relative abundance of tetG, tetL, tetB(P) and tetO being significantly increased after continuous application of composted swine manure. Therefore, optimization of composting strategies is urgently needed to efficiently reduce the content of antibiotic resistance genes in the composted swine manure.
tetracycline resistance genes;manure;gene contamination;antibiotic resistance
X53,R944.6
A
1000-6923(2015)04-1173-08
彭 双(1986-),女,河南信阳人,博士后,主要从事土壤微生物研究.发表论文5篇.
2014-08-12
国家自然科学基金(21377137,20607024);中国科学院战略性先导科技专项(XDA05020800);国家“十二五”科技支撑计划项目(2012BAD05B04)
* 责任作者, 研究员, xglin@issas.ac.cn
——以曲周为例

