不同方法对甜菜叶片基因组DNA提取效果比较与适用性探讨
王希,陈丽*,赵春雷,李彦丽,丁广洲,贾海伦,徐杰,廖鹏
不同方法对甜菜叶片基因组DNA提取效果比较与适用性探讨
王希1,2,3,4,陈丽1,2,3,4*,赵春雷1,2,3,4,李彦丽1,2,3,4,丁广洲1,2,3,4,贾海伦1,2,3,4,徐杰5,廖鹏5
(1.中国农业科学院甜菜研究所,黑龙江哈尔滨150080;2.黑龙江大学农作物研究院,黑龙江哈尔滨150080;3.黑龙江省普通高等学校甜菜遗传育种重点实验室,黑龙江哈尔滨150080;4.中国农业科学院北方糖料作物资源与利用重点开放实验室,黑龙江哈尔滨150080;5.黑龙江大学研究生学院,黑龙江哈尔滨150080)
对比了7种不同原理的提取方法对甜菜叶片基因组DNA的提取效果袁从得率尧纯度尧耗时等多方面分析DNA提取效果袁为不同研究目的确定了最适的提取方法遥最终确定了SDS法是最适合自甜菜叶片中低成本大量提取DNA的方法袁CTAB也基本能满足要求袁吸附柱法是最适合高通量提取优质DNA的方法袁碱裂解法是最适合样品迅速检测的方法袁必要时可改用ROSE法遥柠檬酸钠法产物质量不高且操作不够简便袁尿素法产物纯度过低且耗时过长袁在应用上未见优势。
甜菜;基因组DNA;提取方法
基因组DNA是大部分分子生物学、基因工程、分子遗传学研究的试验材料,其提取方法既是重要的基础性技术,又是影响后续实验结果的关键因素之一。由于DNA分子在生物体内的分布及含量不同,对于不同物种、不同组织,需要选择不同的提取方法;不同方法在得率、纯度、效率、难度、成本等方面会有差异,也需要根据不同的研究目的进行选择。甜菜的分子生物学研究尚处于起步阶段,有针对性地探讨适合甜菜叶片组织的DNA提取方法,并针对不同用途建立最适宜的方法,有助于保证实验结果可靠性和提高工作效率,对甜菜分子生物学研究的发展具有重要的价值。
经典的基因组DNA提取方法借助表面活性剂SDS裂解细胞,并按后期DNA的纯化方式分成蛋白酶K-苯酚法、甲酰胺法、缠绕法等,另有不使用表面活性剂,仅通过物理方法(如煮沸)破坏细胞,得到DNA的粗提物的提取方法[1]。如今,研究人员在这些方法的基础上,通过调整裂解液成分与DNA纯化方式,已形成了SDS法、CTAB法、尿素法、柠檬酸钠法等几种方法[2-3],并根据各自研究物种的特征,对提取细节进行了适当的调整[4-8];另有众多公司应用复合的表面活性剂与高盐溶液,并与硅胶膜吸附柱相结合,研制出了商品化的吸附柱法;还有人开发或是改进了一些适用于DNA快速提取的方法,包括碱裂解法[9]、一步式提取法(rapid one-step extraction ROSE)[10-11]等方法,以满足特定的研究需要。也有研究者对甜菜的基因组DNA提取方法进行过初步的探讨,但研究主要集中在对方法的改良上,且采用的方法集中于CTAB法[12-17]。
为方便不同用途的甜菜研究,本文分别用碱裂解法、SDS法、尿素法、柠檬酸钠法、吸附柱法、CTAB法、ROSE法7种不同的方法对甜菜叶片基因组DNA进行了提取,从得率、纯度、杂质对后续实验影响程度、操作耗时等多方面分析DNA提取效果,对这7种方法进行对比,为不同研究目的筛选最适宜的提取方法。
1 材料与方法
1.1试验材料
植物材料为课题组所保存的甜菜品系YZ19,取幼苗期(叶片数不超过10片)的幼嫩叶片。
1.2基因组DNA提取方法
CTAB法、SDS法、尿素法、柠檬酸钠法具体操作参考伍艳芳等的方法[4],碱裂解法提取基因组DNA具体操作参考李筱婷与吴则东的方法[9,12],ROSE法参考Steiner和李文凤的方法[10-11],吸附柱法使用Axygen公司的试剂盒(AP-MN-MS-GDNA-50G),方法见说明书。为排除RNA残留对电泳迁移率的干扰,在提取过程中进行RNA酶消化。具体的叶片用量与产物的最终体积见表1。
1.3检测
产物完整性检测:通过琼脂糖凝胶电泳检测DNA完整性,具体方法见《分子克隆实验指南》[1]。
得率与纯度检测:利用紫外分光光度计检测DNA样品在230nm,260nm,280nm波长下的吸光值(opticaldensity,OD),样品稀释倍数1000倍。用OD260计算DNA得率,分别用OD260/OD280及OD260/OD230值反映蛋白质与小分子杂质残留程度。得率(μg/mg)=OD260×50(μg/μL)×产物溶解体积(μL)÷起始组织质量(mg)。
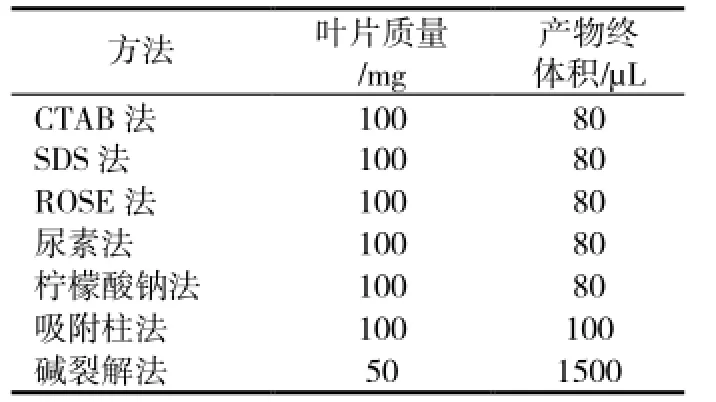
表1 各方法叶片用量与产物最终体积
1.4杂质残留对后续研究影响的分析
用限制性内切酶进行短时间酶切,并以产物为模板进行聚合酶链式反应(polymerase chain reaction,PCR),检测所得DNA中残留杂质对后续的分子生物学实验是否有不良影响,间接地检测各种杂质的残留情况。酶切使用EcoR玉,PCR引物选择特异性中等的引物。
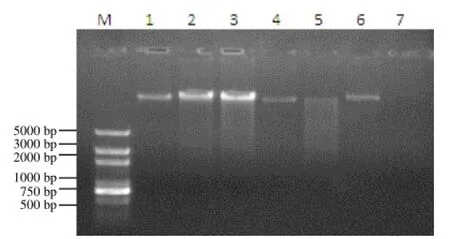
图1 不同方法所得DNA的电泳结果
2 结果与分析
2.1DNA提取结果与完整性分析
将各方法提取产物平行进行琼脂糖凝胶电泳检测,结果如图1。琼脂糖凝胶电泳可反映DNA产物的完整性,并可粗略地反映DNA的产量。基因组DNA在电泳结果中应呈现>10kb的单一条带,若在条带下方有弥散状条带,表明产物有降解或者断裂。由图1可见,吸附柱法所得产物为比较清晰的条带,表明产物的完整性比较好;SDS法、CTAB法、ROSE法、柠檬酸钠法的弥散条带亮度远低于DNA主带,表明产物有轻微的降解;尿素法产物降解比较严重,主带几乎已不可见;碱裂解法产物浓度低,电泳后无可见的DNA条带,表明产物中DNA浓度低于本次琼脂糖凝胶电泳中最低的条带浓度。
2.2产物得率及纯度分析
利用紫外分光光度计检测并计算DNA产物的得率及杂质残留程度,结果如表2。
在紫外吸收值可检测的6种方法中,吸附柱法得率最高,尿素法得率最低。在所有7种方法中,得率最低的是碱裂解法,由于其产物浓度很低,无法检测紫外吸收值,只能根据电泳时无明显的DNA条带的现象,推断电泳样品浓度低于同次电泳时的最低条带浓度,即尿素法的条带浓度,再根据溶解体积,推断其得率低于0.7μg/mg。

表2 不同方法的DNA得率与杂质残留程度分析
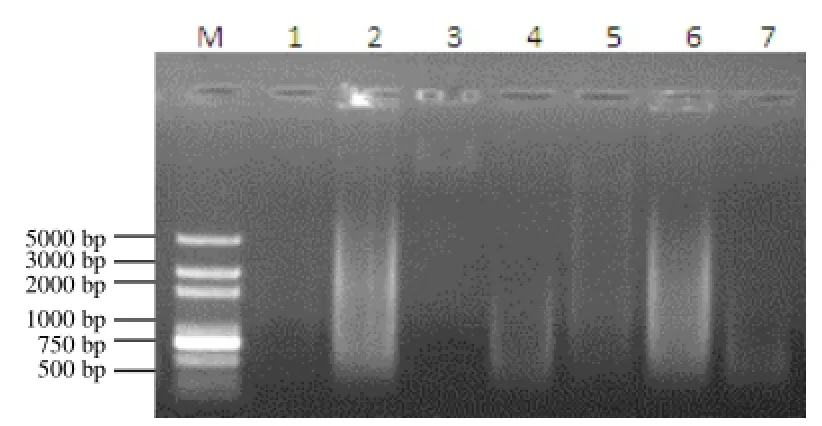
图2 不同方法所得DNA的酶切结果

图3 不同方法所得DNA的PCR结果
据紫外吸收值推断除碱裂解法之外的6种方法的杂质残留情况。DNA的吸收峰在260nm左右,大部分蛋白质的吸收峰在280nm左右,酚类物质与盐分的吸收峰在230nm左右,因此OD260/OD280可反映蛋白质残留情况,OD260/OD230可反映酚和盐类等小分子残留情况。在紫外吸收值可检测的6种方法中,ROSE法、尿素法和柠檬酸钠法的OD260/OD280显著低于另外3种方法,表明其产物中蛋白质残留较多;CTAB法和尿素法的OD260/OD230显著低于另外4种方法,表明产物中小分子残留较多。
2.3杂质残留对后续实验的影响
在DNA产物中,若蛋白质杂质残余过多,容易影响酶切效率;若酚类、多糖、无机盐等杂质残余过多,容易影响PCR重复性和特异性。因此,采用短时间酶切与PCR这2种方法分析残留杂质对后续实验的影响。酶切结果见图2,PCR结果见图3。
由图2可见,尿素法所得产物的酶切效率很低,几乎看不到消化后的弥散状条带,表明残留杂质比较严重地抵制了限制性内切酶的活性。CTAB法、吸附柱法和SDS法的酶切产物条带呈正常的大面积弥散状,表明这3种方法所得产物纯度比较高,未对酶活性产生明显的干扰。柠檬酸钠法和ROSE法的产物片段较小,表明产物被过度消化,有可能是杂质中残留着降解DNA的酶类。
由图3可见,吸附柱法所得产物的PCR结果重复性和特异性最好,表明产物中几乎不含有影响PCR结果的杂质。ROSE法、柠檬酸钠法、碱裂解法的产物PCR特异性也较高,但重复性较差,3种方法各有至少1份产物的PCR效率很低,表明其中可能含有影响Taq酶活性的杂质,从而影响PCR扩增效率。其中,对碱裂解法来说,泳道b3无可见产物的原因也可能是PCR体系中模板量过少,即此份DNA产物的产量与浓度过低,导致PCR无可见产物。SDS法与CTAB法所得产物的PCR重复性很好,特异性中等,隐约有非特异性条带,但基本不影响主带的判断,表明其中可能残留有少量小分子物质,从而影响PCR的特异性。尿素法产物的特异性与重复性均较差。
各方法提取效果汇总于表3。由表3可见,吸附柱法提取效果最好,得率和纯度都足够高。CTAB法与SDS法的综合效果也都比较好,残留杂质对后续实验的干扰很小。碱裂解法与ROSE法得率虽低,但耗时很短,在工作效率方面有优势。尿素法产物质量低于其它方法,且会影响后续实验。柠檬酸钠法的产物质量检测结果中等,但杂质对后续实验有不良影响。

表3 不同方法提取效果对比
3 讨论
衡量基因组DNA的质量主要需要考虑两个方面,一是完整性,一是纯度。由于机械剪切力的存在,在提取过程中,操作步骤越多,基因组的完整性越低,各步的具体操作方法也会影响DNA产物的完整性。此外,降解DNA的酶大部分来自细胞内部,少部分来自操作过程中引入的污染,如果去除蛋白质的步骤效率不够高,或者是在去蛋白之前的步骤较多,这些酶就有可能在操作过程中陆续降解DNA,导致产物的完整性下降。当需要进行印迹杂交等对完整性要求较高的实验时,需要重点注意产物的完整性。
纯度方面,基因组DNA中残留的主要杂质为蛋白质,其次是酚类物质,还可能有可溶性多糖、盐离子等。甜菜的叶片中叶绿素和金属离子含量均比较高,因此在选择方法时需要考虑这些杂质的去除效果。DNA的纯度高可保证后续实验的成功率,并延长DNA样品的保存时间,但过多的去杂质操作又会影响DNA完整性,并延长提取时间,因此根据不同的研究需要,应适当调整DNA纯度的评价标准。若用于长期保存,则产物纯度应尽量高;若要兼顾工作效率,则将杂质残留控制在不影响后续实验的程度即可。
除这两点之外,产物得率、提取所需时间、操作通量、操作难度、实验成本等方面也是需要考虑的因素。当需要从少数样品中提取较大量DNA时,可以优先考虑DNA得率、完整性与纯度,获得质量较好的DNA;当需要对大量样品进行粗略的定性分析时,则优先考虑通量、速度与成本;当需要对大量样品进行多种分析或比较精细的分析时,对DNA质量要求较高,工作量又较大,则需要将以上因素综合考虑。
根据本研究结果,吸附柱法得率与纯度最高,耗时中等,但成本较高,当实验结果要求比较高或难度比较大时,应采用此方法,以避免DNA质量对实验结果的干扰。对同时要求优质与高效的实验,或是在PCR时需要使用随机引物、多重引物等质量较低的引物时,也可使用吸附柱法以保证实验效率与结果可靠性。CTAB法与SDS法得率也比较高,质量较好,且成本较低,但耗时略长,适合大部分对操作通量要求不高的常规研究,如用优质引物进行少量样品的PCR检测,以基因组为材料的基因或启动子克隆等。其中SDS法的提取效果略优于CTAB法。碱裂解法与ROSE法都是为快速、高通量、低成本地进行PCR检测而设计的方法,二者产物的PCR效果类似;而碱裂解法耗时更短,操作更简便,因此,当引物质量较好、且需要对大量样品进行快速的PCR检测时,可首选碱裂解法。碱裂解法的缺点是无法事先检测产物质量,只能直接进行PCR检测;而ROSE法产物浓度更高,可进行电泳、紫外吸光值测定等分析,因此当碱裂解法的PCR结果重复性过差时,可改用ROSE法,以排除DNA提取失败引起的假阴性。尿素法与柠檬酸钠法得率与产物纯度均不高,后续实验受到干扰,且提取耗时较长,不适合甜菜叶片的基因组DNA提取。
[1]J.Sambrook,D.W.R.(黄培堂译).分子克隆实验指南(第三版)[M].北京:科学出版社,2002.
[2]袁云香,李海娟.水稻基因组DNA提取方法的研究进展[J].湖北农业科学,2010,49(4):968-971.
[3]吕亚慈.植物DNA提取方法研究进展[J].考试周刊,2011(57):176-177.
[4]伍艳芳,徐海宁,肖复明,等.陈山红心杉基因组DNA提取方法的比较与分析[J].江西农业大学学报,2012,34(3):517-521.
[5]罗应怡,李良波,卢家仕,等.4种提取牛大力基因组DNA方法的比较研究[J].湖南农业科学,2013(5):4-6.
[6]王月月,范龙,张洁,王冬梅.大豆不同生长时期基因组DNA提取方法的优化[J].中国农学通报,2013,29(36):319-325.
[7]白雪嵩,赵昶灵,陈中坚,翁晨,王文亚.5种提取三七基因组DNA方法的比较[J].江苏农业科学,2014,42(5):54-56.
[8]马文东.水稻基因组DNA提取方法的研究[J].黑龙江农业科学,2014(1):7-11.
[9]李筱婷,陈卓君,许文涛,等.一种适于PCR扩增的植物基因组快速提取新方法[J].农业生物技术学报,2010,18(2):394-399.
[10]C.J.P.J.J.Steiner,R.G.Fjellstrom and L.F.Elliott.A rapid one-tube genomic DNA extraction process for PCR and RAPD analyses[J].Nucleic Acids Research,1995,23(13):2569-2570.
[11]李文凤,李师默,牛永春,吴立人.用于SCAR检测的基因组DNA简易提取法[J].生物技术通报,2001(3):36-37.
[12]吴则东,王华忠,倪洪涛.不同碱裂解法快速提取甜菜大群体DNA的研究[J].中国糖料,2013(3):32-34.
[13]吴则东,王茂芊,胡珅,等.一种适用于PCR扩增的甜菜干种子DNA快速提取方法的研究[J].中国农学通报,2013,29(30):69-72.
[14]吴则东,王华忠,王茂芊.甜菜干种子DNA提取的不同方法比较[J].中国糖料,2014(1):21-23.
[15]王华忠.甜菜全DNA提取方法及RFLP分析技术[J].中国糖料,1997(4):45-48.
[16]张福顺,王凤山,李红侠,郭爱华,张文彬.甜菜DNA提取新方法初探[J].中国糖料,2001(1):20-21.
[17]吴则东,韩英,王华忠.快速大量提取甜菜DNA的新方法[J].中国糖料,2007(2):15-16+19.
Comparison of Different Leaf Genomic DNA Extraction Methods for Their Efficacies and Applicability in Sugarbeet(Beta valgaris L.)
WANG Xi1,2,3,4,CHEN Li1,2,3,4*,ZHAO Chun-lei1,2,3,4,LI Yan-li1,2,3,4,DING Guang-zhou1,2,3,4,JIA Hai-lun1,2,3,4, XU Jie5and LIAO Peng5
(1.Sugarbeet Research Institute of Chinese Academy of Agricultural Sciences,Harbin 150080;2.Academy of Crop Sciences, Heilongjiang University,Harbin 150080;3.Key Laboratory of Sugarbeet Genetics&Breeding,Colleges and Universities of Heilongjiang Province,Harbin 150080;4.Key Laboratory of North Sugar Crop Resource and Utilization,Chinese Academy of Agricultural Sciences,Harbin 150080;5.Graduate School of Heilongjiang University,Harbin 150080)
In this study,seven different methods with different working principles were used to extract genomic from sugarbeet(B.vulgaris L.)leaves,and were compared for multiple features including yield,purity,timeconsuming,cost and so on.Suitable methods were selected for different kind of studies.SDS method is the best method for many studies because of its low cost,high yield and acceptable purity.Absorbing column method prepares DNA with the highest quality and cost less time,so it's suitable for higher demanded studies.Alkali lysis method is the fastest method for PCR test.ROSE method can be used instead of alkali lysis method if needed.Carbamide method and sodium citrate method are not suitable for genomic DNA extraction from sugarbeet leaves.
sugarbeet(Beta valgaris L.);genomic DNA;extracting method
S566.301;Q78
院A
1007-2624(2015)05-0003-04
10.13570/j.cnki.scc.2015.05.002
2015-08-07
现代农业产业技术体系建设专项资金(CARS-210101);黑龙江省教育厅科学技术研究面上项目(12531488);黑龙江大学青年科学基金项目(QL201124)。
王希(1984-),女,博士,助理研究员,研究方向:甜菜遗传育种。E-mail:lagow@163.com
陈丽(1959-),女,研究员,研究方向:甜菜遗传育种。E-mail:caaschenli@163.com

