免疫磁珠捕获富集结合HPLC-Q-TOF/MS技术分析复杂水样中的蓖麻毒素
梁龙辉,刘石磊,于惠兰,高 川,周世坤
(防化研究院 国民核化生灾害防护国家重点实验室,北京 102205)
蓖麻毒素(Ricin)是从天然植物蓖麻的种子中提取的一种Ⅱ型核糖体失活蛋白,由1条具有酶催化活性的A链和1条具有半乳糖残基结合位点的B链通过1个二硫键连接而成,分子量为62~64 kDa[1]。蓖麻毒素的A链称为效应链,是一种蛋白酶,具有失活核糖体功能,通过作用于真核细胞核糖体60S亚单位的28 SrRNA,并水解A4324位点的腺嘌呤,导致抗RNA酶的活性不可逆丧失,从而抑制蛋白质合成导致细胞死亡;B链称为靶向链,其表面含有两个半乳糖结合位点,能与细胞膜上糖蛋白或糖脂结合,从而介导A链进入细胞发生毒性作用[2]。蓖麻毒素是自然界中毒性最高的植物毒素之一,其毒性约为有机磷神经性毒剂VX的385倍,氰化物的6 000倍,成人吸入蓖麻毒素的半致死染毒剂量(LD50)为5~10 μg/kg,口服LD50为1~20 mg/kg[3]。蓖麻植物种植广泛,蓖麻毒素易于制备和获取,加之缺乏有效的解毒措施,所以长期以来蓖麻毒素受到世界各国的高度关注。在禁止化学武器公约中,蓖麻毒素是唯一被列入禁控化学品清单的蛋白类毒素。由于很多国家的单一小规模设施都具有蓖麻毒素的生产能力。蓖麻毒素还被用于一些暗杀行动及恐怖事件[4]中,如1978年的马尔科夫杀人伞案件,2013年的白宫蓖麻毒素恐吓信件等。因此,建立准确、灵敏、快速的蓖麻毒素检测方法,在化武履约、公共安全等领域的需求非常迫切。
目前,最常用、最灵敏的蓖麻毒素分析方法是免疫分析法,如酶联免疫吸附分析(ELISA)法[5-7]、抗体生物传感器法[8]等。免疫分析法虽灵敏度高、操作简便,但当抗体与其它具有相似作用位点的蛋白发生非特异性结合时,易出现假阳性结果。例如同样从蓖麻植物中提取出的蓖麻凝集素(RCA120,分子量120 kDa),也由A,B两条链组成,与蓖麻毒素A,B链的氨基酸序列同源性分别高达94%和84%[9],但其毒性远小于蓖麻毒素。另一种Ⅱ型核糖体失活蛋白相思子毒素(Abrin),可从植物相思的种子中提取得到,与蓖麻毒素具有相似的结构与毒性作用机理。目前的免疫分析法很难准确区分这3种蛋白,不能满足当前准确鉴定的需求。为实现蛋白、多肽等生物大分子的准确、灵敏鉴定,近年来,电喷雾电离(ESI)和基质辅助激光解析电离(MALDI)等软电离技术得到了越来越多的关注和发展,形成了生物质谱技术,可通过对蛋白分子量的准确测定以及酶解后肽质量指纹谱(PMF)数据分析等手段分析鉴定大分子蛋白[10-11]。MALDI- TOF/MS[12],LC - ESI/MS[13-15]等质谱技术用于蓖麻毒素分析,尽管取得了快速、准确的分析鉴定结果,但这些方法大多针对天然提取蓖麻毒素纯样或生物样品基质,很少有针对应用最广泛的水样基质所建立的分析方法。
本研究选择生活自来水、海水和OPCW考试用水3种具有代表性的水样基质,利用结合有蓖麻毒素抗体的免疫磁珠进行免疫捕获样品前处理,对基质中的蓖麻毒素进行富集和纯化,结合高效液相色谱-四极杆/飞行时间质谱(HPLC-Q-TOF/MS)建立了复杂水样基质中蓖麻毒素的分析方法。
1 实验部分
1.1 仪器与试剂
6520高效液相色谱-四极杆飞行时间质谱系统,1200快速高效液相色谱系统(美国Agilent公司);Mass Hunter B.04数据处理系统(美国Agilent公司);Eppendorf 5424高速离心机(德国Eppendorf公司);12道磁力架(美国Promega公司);500 μL 10 kD超滤管(美国Millipore公司)。
乙腈(色谱纯,美国Honey Well公司);甲酸、三氟乙酸(TFA)(色谱纯,美国Sigma Aldrich公司);天然蓖麻子(河北康德瑞琪公司);蓖麻毒素标准品由本实验室从天然蓖麻子中提取纯化制备[16],于-20℃冷冻保存;蓖麻毒素单克隆抗体6A6、HRP-标记的ricin单克隆抗体7G7以及包被抗体6A6的免疫磁珠由中科院生物物理所制备[17];N-四甲基联苯胺(TMB,华美生物技术有限公司);磷酸二氢钠、磷酸氢二钠(美国Arcos公司);牛血清白蛋白(BSA,北京欣经科生物技术公司)。
OPCW考试水样为国际禁化武组织(OPCW)第33次官方水平考试样品,含有大量盐类以及化武公约相关附表化合物;海水取自大连黄花港;自来水取自本单位生活区。
1.2 色谱-质谱条件
色谱条件:Agilent Proshell 300SB-C8色谱柱(150 mm×4.6 mm,5 μm);柱温30℃;流动相A为0.1%的甲酸水溶液,B为乙腈(含0.1%甲酸);洗脱梯度:0~2 min,5%B,2~8 min,5%~70%B,8~16 min,70%B,16~18 min,70%~5%B,总分析时间18 min;流速0.25 mL/min;柱温30℃;进样量 2 μL。
质谱条件:离子源ESI,正离子模式;扫描范围为m/z 150~2 400;扫描频率1.3 spectra/s;毛细管电压(Vcap)3.5 kV;雾化气压力35 psi;干燥气温度350℃;干燥气流速8 L/min;碎裂电压150 V;聚焦电压(Skimmer)65 V;仪器在高分辨率(4 GHz)、高质量范围下(<m/z 3 200)操作;使用嘌呤(m/z 121.05)和六(1H,1H,3H-全氟丙氧基)磷氮(m/z 922.01)作为基准物质进行质量校准,质量误差低于5 ppm。
1.3 ELISA法考察免疫磁珠捕获方法的回收率
按照文献[17]用ELISA法绘制免疫磁珠捕获检测蓖麻毒素的标准曲线,并考察方法的回收率与精密度。向每个离心管中加入1 mL抗体稀释液(1%BSA)和10 μL连接蓖麻毒素抗体6A6的Fe3O4磁性纳米颗粒。除1号管作为空白外,将浓度分别为2,5,10,25,50,100 μg/mL的蓖麻毒素加入各离心管中,37℃孵育30 min后,放入带有磁铁的离心管架中进行磁吸附,再用PBST(含0.1%Tween-20的20 mmol/L PBS缓冲液)洗涤3次。各管中分别加入200 μL稀释3 000倍的HRP-7G7,37℃孵育15 min后,用PBST洗涤3次。每管加入200 μL 10 g/L的TMB显色剂,室温下放置15 min,再加入50 μL 2 mol/L的H2SO4溶液,使反应终止。用移液枪吸取各管中的液体50 μL分别加入96孔酶标板的各孔中,在Bio-Rad550型酶标仪上测定A450nm值,用试剂空白孔调零。
1.4 复杂水样的免疫磁珠捕获富集
取20 μL 1 mg/mL的免疫磁珠添加到500 μL不同浓度蓖麻毒素的自来水、海水及OPCW考试水样中,混合均匀后于37℃下孵育反应1 h。用磁力架沉淀吸附免疫磁珠,弃去上清液后,用1 mL的PBST分两次洗涤除去与磁珠非特异性结合的化合物,然后用500 μL超纯水分两次洗涤除去体系中剩余的PBST。最后用35 μL 0.1%的三氟乙酸(TFA)对结合在磁珠上的蓖麻毒素进行洗脱,将洗脱液转入新的离心管中,用10 kD超滤管在13 500 r/min下进行超滤,用20 mmol/L的PBS缓冲液溶剂置换3次,得到约100 μL上层保留液,用HPLC-Q-TOF/MS分析。将结果与未经免疫捕获富集的样品进行比对,考察磁珠免疫捕获后的方法学指标。
2 结果与讨论
2.1 色谱-质谱条件的优化
2.1.1 色谱柱的选择 由于本文主要研究水样基质中的蓖麻毒素,样品组分相对单一,故选用5 μm粒径的色谱柱,另外,由于样品中蓖麻毒素的分子量远大于4 000 Da,故选择色谱柱孔径为300。结合蓖麻毒素的性质及高效液相色谱的性能,比较了Proshell 300SB-C8(4.6 mm ×150 mm,5 μm),Zorbax 300SB -C18(4.6 mm ×150 mm,5 μm)以及Eclipse plus-C18(4.6 mm ×100 mm,5 μm)3种色谱柱对蓖麻毒素样品的保留与检测灵敏度。实验结果表明:虽然100 mm柱长的色谱柱用时更短,但不能保证大分子样品在色谱柱上有很好的保留。在柱长、柱径、粒径及孔径相同的情况下,用C8柱分析得到的峰形比C18柱更好。因此,最终选用Proshell 300 SB-C8(4.6 mm ×150 mm,5 μm)色谱柱分离目标物。
2.1.2 洗脱梯度的优化 以水(0.1%甲酸)-乙腈(0.1%甲酸)为流动相,研究了不同梯度条件下(见表1)的洗脱效果。实验结果表明,乙腈含量高,目标化合物的信噪比高,检测灵敏度高。但是对于复杂基质样品,若乙腈含量过高,可能会使混合物分离不完全,峰形变差。采用表1中的梯度4,在分析时间较短的情况下,能够保证蓖麻毒素与背景干扰物有很好的分离且灵敏度最高。

表1 复杂水样基质中蓖麻毒素的梯度洗脱条件Table 1 The elution gradient of ricin in complex water samples
2.1.3 质谱条件的优化 采用高分辨ESI+模式,在m/z 150~2 400范围进行全扫描,由于目标化合物的分子量大,需要通过软件的去卷积计算以得到分子量的准确测定值,因此对仪器的灵敏度、准确度都有较高要求。为减少质谱信号中的噪音,提高目标物的响应,考察了质谱的不同扫描频率(1.1,1.3,1.5 spectra/s)、干燥气流量(5,8,10 L/min)、喷雾压力(20,30,40 psi)、干燥气温度(250,300,350℃)、毛细管电压(3.2,3.5 kV)以及碎裂电压(120,150,180 V)对分析结果的影响,确定最佳MS条件如“1.2”所示。
利用优化得到的仪器采集参数,对蓖麻毒素纯品进行分析,蓖麻毒素属于大分子蛋白化合物,在HPLC-Q-TOF/MS中生成一系列 [M+nH]n+多电荷离子(n为质子化数,即电荷数),利用去卷积软件计算得到蓖麻毒素纯品的分子量(见图1)。4次重复实验测得蓖麻毒素的分子量分别为:62 884.21,62 884.99,62 885.48,62 885.21 Da,其平均值为62 884.97 Da,数据重现性良好。
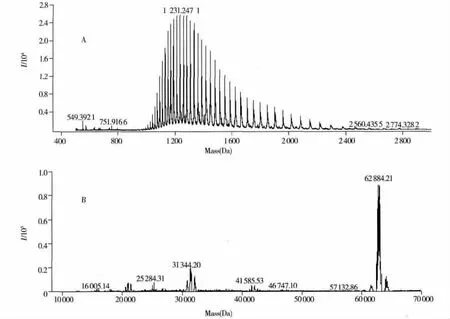
图1 HPLC-Q-TOF/MS分析蓖麻毒素得到的质谱图(A)以及去卷积计算结果(B)Fig.1 HPLC-Q-TOF/MS spectrum of ricin(A)and its deconvolution result(B)
2.2 HPLC-Q-TOF/MS直接分析不同基质水样
由于环境水样中含有盐类、醇类、脂类等背景干扰物,因此对目标物的分析会造成一定干扰。本实验采用Agilent 1200/6520 HPLC-Q-TOF/MS系统结合蛋白分析专用色谱柱Agilent-proshell 300SB-C8,采用优化的色谱-质谱条件,能够将样品中的蓖麻毒素与背景干扰物基本分离,从而可直接用于复杂水样的分析。但不同样品的背景复杂程度不同,分离效果不同,其检测灵敏度也各不相同。用HPLCQ-TOF/MS直接对不同浓度的自来水、海水以及OPCW考试水样中的蓖麻毒素进行分析,以3倍信噪比(S/N)时样品的浓度为检出限(LOD),结果见表2。

表2 HPLC-Q-TOF MS直接分析不同基质水样中蓖麻毒素的保留时间、检出限及测得分子量Table 2 Retention times,LODs and determined masses of ricin directly analyzed by HPLC-Q-TOF MS in different water matrices
图2为不同水样中的1.00 ng/μL蓖麻毒素经HPLC-Q-TOF/MS分析后的总离子流色谱图,谱图中积分的部分为蓖麻毒素的色谱峰。结果表明,OPCW考试用水的背景最复杂,基质中大量聚乙二醇、醇胺、磷酸酯、无机盐类干扰物对蓖麻毒素的分析造成了严重干扰,使得蓖麻毒素的保留时间和分子量与标样相比存在较大偏差,峰面积大大降低,仅能检测浓度高于1.00 ng/μL的样品。因此,虽然HPLC-Q-TOF/MS可以直接筛查不同基质水样中的蓖麻毒素,但对于复杂背景干扰的基质样品,分析灵敏度和准确性均较差,必须对复杂样品中的目标蛋白进行有效的纯化与富集后才能得到理想的分析结果。
图2 HPLC-Q-TOF MS直接分析不同基质水样中蓖麻毒素(1.00 ng/μL)的总离子流色谱图Fig.2 TIC chromatograms of ricin(1.00 ng/μL)in different water matrices directly analyzed by HPLC-Q-TOF MS
2.3 复杂基质中蓖麻毒素的免疫磁珠富集与纯化
2.3.1 抗体效价的测定 利用间接ELISA[18]方法考察了不同抗体的效价,通过实验得到ELISA最低响应信号对应抗体的质量浓度,计算包被的蓖麻毒素浓度与抗体浓度的比值,从而得到抗体的效价。结果表明,抗体3G7的效价太低,仅为1∶50,不能用于实验分析;而抗体6A6和7G7的效价分别达1∶2 800和1∶5 000,能够满足免疫分析的实验需求,所以选择抗体6A6和7G7进行实验。
2.3.2 免疫捕获富集方法的线性方程、回收率与精密度 分别配制浓度为0,0.01,0.10,1.00,2.00,5.00,10.0,25.0,50.0,100 μg/mL的蓖麻毒素,用ELISA-光度法绘制免疫磁珠捕获检测蓖麻毒素的标准曲线,以蓖麻毒素浓度的对数为X轴,对应A450nm值为Y轴,进行线性回归计算。结果显示,蓖麻毒素浓度在5.00~100 μg/mL范围内,其对数与发光强度A450nm呈线性关系,回归方程为Y=0.634X -0.347,r2为0.974。
在5.00~100 μg/mL线性范围内配制加标浓度为15.0和30.0 μg/mL的蓖麻毒素样品,采用免疫捕获方法测定相应浓度样品的A450nm值,每个样品重复测定3次,以工作曲线计算对应样品的浓度,并计算其回收率与相对标准偏差(RSD)。结果显示,样品在15.0,30.0 μg/mL加标浓度下的回收率分别为88.8%和82.1%,RSD分别为5.9%和4.2%。
2.3.3 免疫捕获结合HPLC-Q-TOF/MS对复杂水样的分析 将免疫捕获富集技术与HPLC-QTOF/MS相结合用于复杂水样的测定。图2C及图3分别为OPCW考试水样在免疫磁珠富集前后的HPLC-Q-TOF/MS总离子流色谱图。从图中可以看出,免疫磁珠富集前(图2C),由于受到大量背景化合物的干扰,蓖麻毒素不能在色谱柱上很好地保留,保留时间明显靠前,质谱响应较差。而经免疫磁珠富集后,有效除去了OPCW考试水样基质中的背景干扰物,使样品的保留时间更接近标样,且显著提高了质谱响应信号与检测灵敏度。

图3 OPCW考试水样中蓖麻毒素(1.00 ng/μL)经免疫磁珠富集后的HPLC-Q-TOF/MS总离子流图Fig.3 TIC chromatogram of OPCW test water(1.00 ng/μL)analyzed by HPLC -Q -TOF/MS after immunocapture enrichment
2.4 蓖麻毒素染毒样品的分析
采用本文建立的免疫捕获样品前处理方法和优化的液相色谱-质谱条件对自来水、海水及OPCW考试水等基质中不同浓度蓖麻毒素的加标样品进行筛查分析,每个样品重复测定3次,通过保留时间比对以及分子量测定确证了阳性样品中的蓖麻毒素,并考察了不同基质样品的检出限,实验结果见表3。由表3可见,经过免疫捕获,自来水和PBS基质中蓖麻毒素的检出限达2.5 ng/mL,对于更加复杂的海水和OPCW考试水样,检出限分别达10,50 ng/mL,灵敏度比免疫捕获之前提高了约20倍。

表3 蓖麻毒素染毒样品分析的保留时间、检出限及测得分子量Table 3 Retention times,LODs and determined masses of ricin contaminated samples
3 结论
基于免疫磁珠捕获富集技术,结合高效液相色谱-四极杆/飞行时间质谱分析,建立了复杂水样中蓖麻毒素的检测方法。该方法快速、简便、准确,可用于突发情况下可疑样品中蓖麻毒素的快速筛查与确证,但由于方法检测的是蓖麻毒素全蛋白,缺乏可靠内标物,还不能进行准确的定量分析。本文所建立的免疫磁珠富集方法,为真实染毒样品的酶解-二级质谱鉴定提供了思路。在今后的工作中,本课题组将进一步对磁珠免疫捕获后的蓖麻毒素样品进行酶解,在酶解产物中筛选出蓖麻毒素序列特异性肽段,建立基于蓖麻毒素标识性肽段的准确定量的HPLC-MS/MS(MRM)方法,以形成初步完备的复杂样品中蓖麻毒素的定性、定量质谱分析技术体系。
[1]Stirpe F,Barbieri L,Battelli M G,Soria M,Lappi D A.Biotechnology(N Y),1992,10(4):405-412.
[2]Schep L J,Temple W A,Butt G A,Beasley M D.Environ.Int.,2009,35(8):1267 -l271.
[3]Lord J M,Roberts L M,Robertus J D.FASEB J.,1994,8:201-208.
[4]Papaloucas M,Papaloucas C,Stergioulas A.J.Biol.Sci.,2008,11:2370 -2371.
[5]Godal A,Olsnes S,Pihl A.J.Toxicol.Environ.Health,1981,8(3):409 -417.
[6]Sturm M B,Schramm V L.Anal.Chem.,2009,81(8):2847 -2853.
[7]Yang Y Y,Mu D H,Tong Z Y,Mu X H,Hao L Q.J.Instrum.Anal.(杨运云,牟德海,童朝阳,穆晞惠,郝兰群.分析测试学报),2007,26(4):533-536.
[8]Ligler F S,Taitt C R,Shriver-Lake L C,Sapsford K E,Shubin Y,Golden J P.Anal.Bioanal.Chem.,2003,377(3):469-477.
[9]Araki T,Funatsu G.Biochim.Biophys.Acta,1987,911(2):191 -200.
[10]Kanamori-Kataoka M,Kato H,Uzawa H,Ohta S,Takei Y,Furuno M,Seto Y.J.Mass.Spectrom.,2011,46(8):821-829.
[11]Ma X X,Tang J J,Li C Z,Qin L,Chen J,Li H,Guo L,Xie J W.Anal.Bioanal.Chem.,2014,406(21):5147-5155.
[12]Duriez E,Fenaille F,Tabet J C,Lamourette P,Hilaire D,Becher F,Ezan E.J.Proteome.Res.,2008,7(9):4154-4163.
[13]McGrath S C,Schieltz D M,McWilliams L G,Pirkle J L,Barr J R.Anal.Chem.,2011,83(8):2897-2905.
[14]stin A,Bergstrm T,Fredriksson S,Nilsson C.Anal.Chem.,2007,79(16):6271 -6278.
[15]Becher F,Duriez E,Volland H,Tabet J C,Ezan E.Anal.Chem.,2007,79(2):659-665.
[16]Fredriksson S,Hulst A G,Artursson E,de Jong A L,Nilsson C,van Baar B L M.Anal.Chem.,2005,77(6):1545-1555.
[17]Zhuang J,Cheng T,Gao L Z,Luo Y T,Ren Q,Lu D,Tang F Q,Ren X L,Yang D L,Feng J,Zhu J D,Yan X Y.Toxicon,2010,55(1):145-152.
[18]Shyu H F,Chiao D J,Liu H W,Tang S S.Hybridoma and Hybridomics,2002,21(1):69 -73.

