全氟丙酸与人血清白蛋白结合作用机制的计算模拟与光谱法研究
易忠胜,王海洋,伍智蔚,张爱茜
(1.桂林理工大学 化学与生物工程学院,广西 桂林 541004;2.中国科学院生态环境研究中心 环境化学与生态毒理学国家重点实验室,北京 100085)
全氟化合物(PFCs)凭借其优良的热稳定性、化学稳定性、表面活性及疏水、疏油性能,被大量应用于纺织、化工、电子、制药、航空、电镀行业等领域[1-2]。由于全氟化合物含有具极高化学键能(键能约为110 kJ/mol)的C—F共价键,因此这类化合物普遍具有很高的稳定性,能够经受很强的热、光照、化学作用、微生物作用以及高等脊椎动物的代谢作用而不降解,在环境中能持久存在,并能够富集于生物体内[3],是一类普遍存在于环境中的污染物质,目前在全球几乎所有的环境介质中均可检出,甚至在人体的血液中也有检出[4]。毒理学研究表明全氟化合物具有多脏器毒性,对人体健康存在潜在威胁[5]。
人血清白蛋白(Human serum albumin,HSA)是人体血浆中含量最丰富的蛋白质,体液中的HSA不仅是维持血浆渗透压的主要成分,且其内源荧光参与多种内源性物质(如脂肪酸、胆色素、氨基酸、激素)、外源性物质(如金属离子、药物小分子等)的存储和转运[6];同时,有机小分子进入人体后,通过血浆的储存和运输到达受体部位,进而与HSA发生相互作用,限制其进一步运输[7],从而对人体代谢产生影响[8]。利用光谱法研究有机小分子与HSA相互作用具有方便、快速的特点[9],因而,HSA通常用作研究小分子与大分子相互作用的模型蛋白。
环境中的PFCs主要有全氟羧酸类和全氟磺酸类两种[5]。其中全氟丙酸是一种含氟精细化工产品,作为含氟农药、医药和聚合物合成的重要中间体,应用广泛,其化学和生物性质稳定,在自然环境中不易被降解,容易在生物体内富集,威胁人体健康[10]。目前PFCs对人类的毒性效应仅限于人群的流行性病学研究[11],但PFCs与HSA相互作用的机理仍不甚清楚。本文以全氟丙酸(IPC-PFFA-3)为例,通过计算模拟和实验分析两个方面探究其与HSA相互作用的机制(结构见图1),以期为研究全氟化合物与HSA的毒理作用提供有用信息。
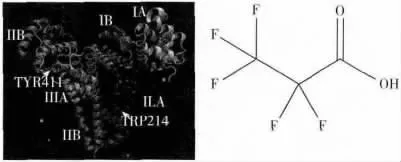
图1 人血清白蛋白的二级结构及全氟丙酸的分子结构图Fig.1 Second structure of human serum albumin(HSA)and molecular structure of pentafluoropropionic acid
1 实验部分
1.1 仪器与试剂
RF-5301PC荧光光度计(日本岛津公司);EL204电子分析天平(梅特勒-托利多仪器(上海)有限公司);PHS-3C精密pH计(上海雷磁仪器厂)。
pH 7.4的0.1 mol·L-1三氨基甲烷-盐酸缓冲溶液(Tris-HCl);HSA(美国Sigma公司)用Tris-HCl缓冲溶液配制成浓度为1.0×10-5mol·L-1的储备液;全氟丙酸(IPC-PFFA-3,瑞士AD公司)用Tris-HCl缓冲溶液配制成浓度为1.0×10-3mol·L-1的储备液;将配好的全氟丙酸稀释10倍,摇匀,置于4℃冰箱中备用。实验所用试剂均为分析纯,水为二次蒸馏水。
1.2 计算模拟
本文所有的计算工作均在DELL服务器、RedHat Linux 5.0系统上完成。使用Sybyl x1.1软件进行分子对接,GROMACS4.5.5软件进行分子动力学模拟,VMD软件进行分子图形展示和结果分析。所用的HSA晶体结构(代码为1N5U)从Brookhaven蛋白质数据库(http://www.rcsb.org/pdb)获得,该晶体在同类蛋白质中具有E-value小同源性高的特点。
1.3 光谱法
在10 mL比色管中准确移入1 mL 1.0×10-5mol·L-1HSA溶液和2 mL pH 7.4的Tris-HCl缓冲溶液,用移液枪依次加入1.0×10-4mol·L-1IPC-PFFA-3溶液,用水定容至刻度,摇匀,在设定温度(291,298,310 K)下恒温10 min,测定体系的激发波长为280 nm、激发光栅和发射光栅的狭缝宽度为3.0 nm/5.0 nm处的荧光光谱,并检测Δλ=15 nm以及Δλ=60 nm时的同步荧光光谱,以华法林和布洛芬作为荧光探针测定体系的竞争实验荧光光谱。
2 结果与讨论
2.1 IPC-PFFA-3与HSA复合物构象变化
2.1.1 分子动力学模拟研究 分子动力学模拟可以研究复合物小分子在水溶液中的稳定性及其动力学性质。模拟时间为10 ns时,HSA-IPC-PFFA-3复合物与HSA的相对初始结构偏差(RMSD)随时间的变化情况见图2A,其中HSA-IPC-PFFA-3体系的RMSD值低于HSA体系的值且波动较小,这说明IPC-PFFA-3与HSA的结合使HSA体系趋于稳定,两者结合也更为牢固[12]。从图2B可以看出,HSA-IPC-PFFA-3体系的均方根波动(RMSF)与HSA体系的RMSF变化趋势相似,大小有微弱变化,这反映了动力学模拟过程中IPC-PFFA-3的结构域未发生较大的位置变化,但蛋白质残基的柔性发生改变。从10 ns的回转半径(Rg)随时间的变化情况(图2C)可以看出,每个系统的Rg值在2 ns后达到相对稳定,表示动力学模拟在2 ns后很快达到平衡。而HSA-IPC-PFFA-3体系的Rg值高于HSA体系,表明IPC-PFFA-3使HSA的紧密度发生变化,结构变得膨胀、松散,导致其空腔增大,进而引起HSA的构象变化[13]。
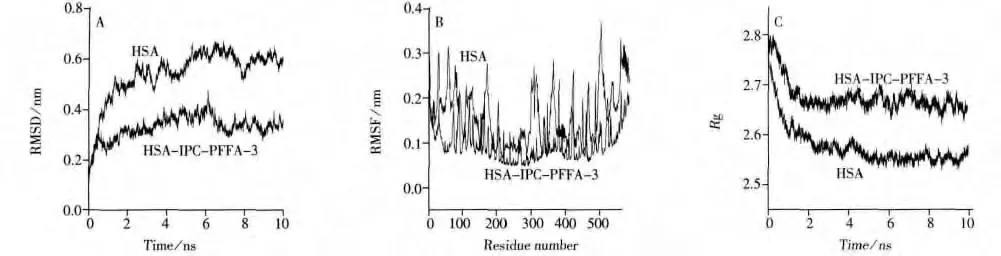
图2 IPC-PFFA-3与HSA分子动力学模拟Fig.2 Molecular dynamics of IPC-PFFA-3 and HSA
2.1.2 IPC-PFFA-3与HSA的同步荧光光谱 HSA中氨基酸残基的最大荧光波长与其所处环境的极性有关,所以可通过观察HSA的同步荧光光谱来分析蛋白质的构象变化[14]。当Δλ=15 nm时只表现出酪氨酸残基(Tyr)的荧光特征,当Δλ=60 nm时只表现出色氨酸残基(Trp)的荧光特性[15]。
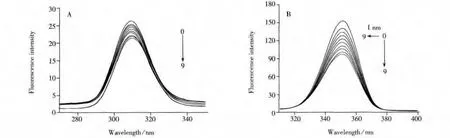
图3 IPC-PFFA-3与HSA相互作用的同步荧光光谱Fig.3 Synchronous fluorescence spectra of HSA obtained in the absence and presence of increasing IPC-PFFA-3
从IPC-PFFA-3与HSA体系的同步荧光光谱图可以看到,Trp和Tyr的荧光强度均随着IPC-PFFA-3浓度的增加而下降,说明IPC-PFFA-3对HSA荧光有猝灭作用。Tyr(Δλ=15 nm)荧光峰的最大发射波长始终保持在351 nm处(见图3A),而 Trp(Δλ=60 nm)荧光峰的最大发射波长随IPC-PFFA-3浓度的增加发生微弱的红移(见图3B),波长由351 nm移至352 nm,说明IPC-PFFA-3的加入使HSA中Trp附近的微环境极性增加,减小了疏水性,进而影响了HSA的构象,但对于Tyr附近的微环境无影响。
2.2 IPC-PFFA-3与HSA的相互作用
2.2.1 IPC-PFFA-3与HSA的分子对接 利用分子对接可从理论上模拟预测IPC-PFFA-3与HSA相互作用的结合情况,并可以显示两者之间的作用力类型。研究发现药物分子与HSA的结合位点位于ⅡA和ⅢA,即位点Ⅰ(华法林位点)和位点Ⅱ(布洛芬位点)[16]。计算过程利用CH4,C‖O与N—H为分子探针,自动探测结合位点,将优化后的IPC-PFFA-3小分子与蛋白质HSA的位点Ⅰ和Ⅱ处分别进行分子对接。结果表明位点Ⅱ的Total_Score函数得分较高(SiteⅠ:2.640 3,SiteⅡ:3.565 1),说明位点Ⅱ对接得到的复合物更稳定。此结果与后文的竞争实验结果相吻合,由此可以推断IPC-PFFA-3与HSA的结合部位主要为位点Ⅱ。Total_Score函数主要考虑了氢键作用、疏水作用、极性作用和溶剂化等因素。通过结合自由能计算,结果表明位点Ⅱ(ΔG=-21.867 5 kJ·mol-1)与IPC-PFFA-3的结合能力比位点Ⅰ(ΔG=-15.689 4 kJ·mol-1)更强。图4A,B分别显示了IPCPFFA-3与HSA在SiteⅠ与SiteⅡ的对接作用,图4C显示了IPC-PFFA-3周围5范围内的氨基酸残基(ARG348,ARG485,LEU453,LEU457,LEU387,LEU345,PRO486,PRO384,UNK1,VAL344,SER342,GLU450,MET446,ILE388,ALA449)。从图4D可以看到IPC-PFFA-3与HSA对接后在SiteⅡ与ARG485,SER342和ARG348以7个氢键稳定结合,而位点Ⅰ中IPC-PFFA-3与HSA并未存在氢键作用。由此可以推断IPC-PFFA-3与HSA的位点Ⅱ结合更稳定。
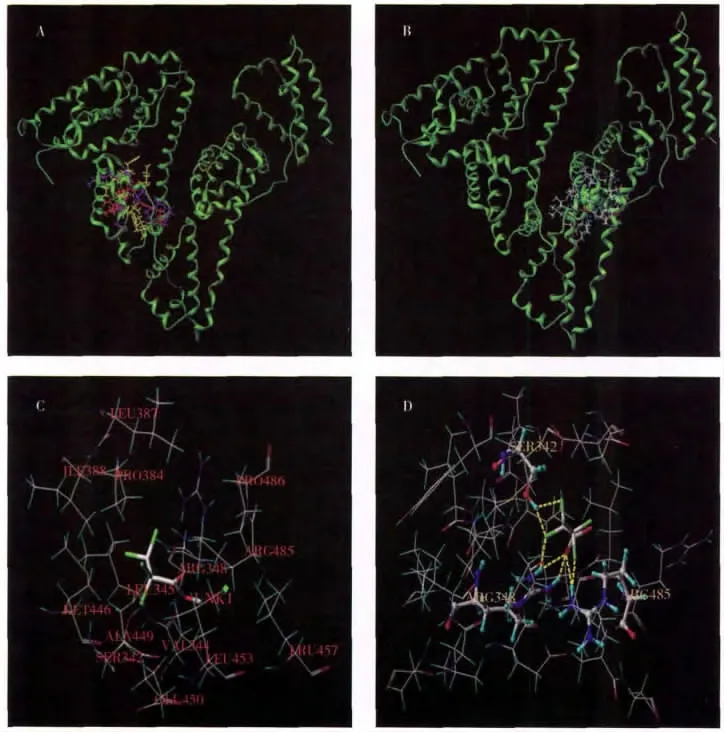
图4 IPC-PFFA-3与HSA的分子对接图Fig.4 Molecular docking and detailed view of the interactions of IPC-PFFA-3 and HSA
2.2.2 IPC-PFFAs-3对HSA的荧光猝灭作用 蛋白质中因含有酪氨酸、色氨酸和苯丙氨酸残基,而具有较强的内源性荧光,当IPC-PFFA-3与HSA结合时可使蛋白质的组成结构发生改变,进而改变蛋白质的内源荧光强度。因此,在模拟人体生理条件下,对一系列含有相同浓度HSA和不同浓度IPC-PFFA-3的溶液进行荧光强度测试。如图5所示,在298 K下,HSA在352 nm处有1个强荧光峰,随着IPC-PFFA-3浓度的增加,HSA的荧光发射光谱峰形不变,荧光位置出现轻微红移(为4 nm),荧光强度依次降低,说明IPC-PFFA-3进入HSA的疏水腔内发生相互作用形成复合物,引起了HSA构象的变化,最终导致HSA的荧光发生猝灭。
2.2.3 IPC-PFFA-3对HSA的荧光猝灭机理及猝灭常数 荧光猝灭过程可分为静态猝灭和动态猝灭。动态猝灭是由猝灭化合物分子和具有荧光性质的化合物发生相互作用而产生。静态猝灭是指猝灭剂分子与能发荧光的分子之间借助分子间力,彼此结合对蛋白质的二级结构产生影响而导致荧光体荧光强度猝灭。动态猝灭过程遵循Stern-Volmer方程[17]:

式中:F0和F分别表示加入猝灭物质前后的荧光值,[Q]为猝灭物质的浓度,KSV为动态猝灭常数;Kq为双分子猝灭过程速率常数;τ0为未加入猝灭物质时荧光物质本身的平均寿命(约为108s)[18]。由F0/F与[Q]的线性方程,可以得到猝灭物质分子对荧光物质分子的猝灭常数。

图5 IPC-PFFA-3与HSA的荧光猝灭图Fig.5 Fluorescence quench titration of HSA with increasing IPC-PFFA-3 concentrations
在温度分别为291,298,310 K时,考察了依次加入10 μL 1 ×10-7mol·L-1IPC - PFFA -3 后HSA(1×10-6mol·L-1)荧光强度的变化情况。由表1可知,随着温度的升高,KSV减小,Kq大于各类猝灭剂对蛋白质大分子的最大分散碰撞常数(2×1010L·mol-1·s-1),表明IPC-PFFA-3对HSA的猝灭可能是猝灭剂IPC-PFFA-3与荧光物质分子HSA在基态时发生了配合反应,IPC-PFFA-3进入了HSA的空腔内,对蛋白质的二级结构和生理活性产生了影响,从而导致荧光的静态猝灭[19]。
2.2.4 IPC-PFFA-3与HSA的表观结合常数及结合位点数 当小分子与大分子结合时,其结合常数与结合位点数由下式求出[20]:
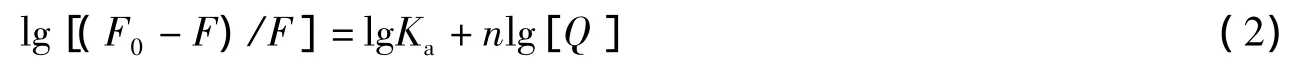
式中n为结合位点数,Ka为表观结合常数。由lg[(F0-F)/F]与lg[Q]的线性方程,可以得出直线的斜率为结合位点数,截距为lgKa。依据公式(2)得到不同温度下IPC-PFFA-3对HSA荧光猝灭的双对数曲线,由该直线的斜率和截距即可求出化合物IPC-PFFA-3与HSA的结合位点数n及表观结合常数Ka(见表1)。

表1 不同温度下IPC-PFFA-3与HSA的荧光猝灭常数Ksv、表观结合常数Ka、猝灭速率常数(Kq)、结合位点数n和相关系数RTable 1 Apparent quenching constants(Ksv),binding constants(Ka),quenching rate constant(Kq),binding sites(n)and correlation coefficient(R)of IPC-PFFA-3-HSA interaction at different temperatures
由表1可知,IPC-PFFA-3对HSA荧光猝灭的双对数曲线在不同温度下均具有良好的线性关系(R≥0.994 6)。它们相互作用的表观结合常数均在105L·mol-1数量级以上。表观结合常数随着温度的增加而减小,从而验证了IPC-PFFA-3对HSA的荧光猝灭机制是静态猝灭。结合位点数n≈1,说明在IPC-PFFA-3与HSA作用时可能有1个结合位点。IPC-PFFA-3进入血液后通过人血清白蛋白具有运输、转载的特性,将IPC-PFFA-3运输到人体器官的各个部位,进而产生代谢。而IPC-PFFA-3是一种毒性的小分子,其通过与人血清白蛋白稳定结合而被运输,进而对人体代谢有一定的影响。
2.2.5 IPC-PFFA-3与HSA的竞争结合位点 研究表明,华法林(Warfarin)和布洛芬(Ibuprofen)与HSA的结合位点分别为SiteⅠ和SiteⅡ[21-22],具有特异性结合的特点。为了探明PFCs在HSA上的结合位置,本文以Warfarin和Ibuprofen分别作为HSA结合位点(SiteⅠ和SiteⅡ)的分子探针,利用竞争实验的方法,以确定PFCs在HSA上的结合位置。通过竞争结合实验,结合修正后的Stern-Volmer方程:
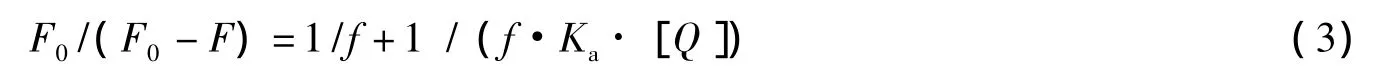
以F0/(F0-F)对1/[Q]作图,依据直线的斜率和截距可求出表观结合常数Ka。通过比较加入Warfarin(或Ibuprofen)前后的Ka值可以推断IPC-PFFAs-3在HSA上的结合位置。
利用公式(3)计算两者的结合常数Ka值。结果表明未加探针之前IPC-PFFA-3的Ka为1.40×106L·mol-1,加入布洛芬后,Ka变化较明显(Ka=0.59×105L·mol-1);而加入华法林后,Ka的变化几乎可以忽略,探针与IPC-PFFA-3结合在各自的作用部位上,由此说明IPC-PFFA-3在HSA上的作用部位均为SiteⅡ,即HSA的亚域ⅢA,与分子对接结果相吻合。
2.2.6 IPC-PFFA-3与HSA的作用力类型 有机物小分子和生物大分子如蛋白质等之间的作用类型主要有静电引力、范德华力、疏水作用力和氢键等。不同的有机物小分子和蛋白质之间结合的作用力类型不同[23]。计算不同温度下(291,298,310 K),IPC-PFFA-3与HSA相互作用时的体系热力学参数结果,见表2。该体系ΔG<0,说明IPC-PFFA-3与HSA的相互作用是自发进行的,而ΔH<0,ΔS<0则表明二者作用力类型为氢键[24],与分子对接结果相吻合。

表2 不同温度下IPC-PFFA-3与HSA相互作用的热力学常数Table 2 Thermodynamic parameters of IPC-PFFA-3-HSA interaction at different temperatures
3 结论
本文采用分子对接和动力学模拟对IPC-PFFA-3与HSA的相互作用进行理论推测,并通过光谱法进行验证,对二者的结果进行对照。结果表明,全氟丙酸小分子与HSA相互作用的方式为荧光猝灭作用,猝灭方式为静态猝灭。热力学常数的计算与分子对接结果得出二者间的主要作用力为氢键作用力。同步荧光光谱和动力学模拟的结果表明二者间的结合十分稳定,并使HSA的构象发生了改变,毒理作用体现在HSA二级结构的改变,回旋半径的变大足以说明HSA体系变得膨胀,其二级结构的改变正是由于小分子进入HSA后对其产生的毒副作用所致,而结合力体现在相对初始结构偏差RMSD值的改变,RMSD波动变小说明这两者的结合趋于稳定。竞争实验和分子对接、动力学模拟的结果则证明全氟丙酸与HSA的结合位点位于SiteⅡ,说明IPC-PFFA-3对HSA的二级结构产生影响进而改变HSA的二级结构。实验的结果与理论推测相互验证,提高了实验分析的准确度,为今后进一步探究全氟化合物的毒性机理奠定基础。
[1]Sun L S,Lu G H,Ye Q X,Liu J C.Sichuan Environ.(孙丽莎,陆光华,叶秋霞,刘建超.四川环境),2012,31(2):119-123.
[2]Qi Y J,Zhou Z,Shi Y L,Meng Z F.Environ.Sci.(齐彦杰,周珍,史亚利,孟昭福.环境科学),2013,1:244-250.
[3]Kashino I,Okada E,Sasaki S,Miyashita C,Ikeno T,Araki A.Prenatal Exposure to 11 Perfluorinated Compounds(PFCs)and Infant Weight in the Hokkaido Study on Environmental and Children's Health;Proceedings of the Environment and Health,Bridging South,North,East and West Conference of ISEE,ISES and ISIAQ,F,2013 .
[4]Shi Y L,Pan Y Y,Wang J M,Cai Y Q.Prog.Chem.(史亚利,潘媛媛,王杰明,蔡亚岐.化学进展),2009,(Suppl 1):369-376.
[5]Fang X M,Wang J S,Dai J Y.Adv.Earth Sci.(方雪梅,王建设,戴家银.地球科学进展),2010,25(5):543-551.
[6]Wang N,Liu Z Y,Hu X L,Bu F Q,Zhao X Z.Chem.J.Chin.Univ.(王宁,刘忠英,胡秀丽,卜凤泉,赵学忠.高等学校化学学报),2011,2:241-245.
[7]Fu L.J.Mol.Sci.(傅丽.分子科学学报),2010,1:46-49.
[8]Liu C H,Li Y Q,Qi Y X.J.Instrum.Anal.(刘彩红,李玉琴,齐永秀.分析测试学报),2010,9:918-922.
[9]Li F,Rong X G.Chin.J.Spectrosc.Lab.(李凤,荣先国.光谱实验室),2011,28(1):256-258.
[10]Vasiliev E S,Knyazev V D,Karpov G V,Morozov I I.J.Phys.Chem.Anal.,2014,118(23):4013 -4018.
[11]Bonefeld-Jorgensen E C,Long M,Bossi R,Ayotte P,Asmund G,Krüger T,Ghisari M,Mulvad G,Kern P,Nzulumiki P,Dewailly E.Environ.Health,2011,10(1):88-103.
[12]Yamada H,Fukuda M,Miyakawa T,Morikawa R,Takasu M.JPS Conference Proceedings,2014,1:016016.
[13]Kamaraj B,Purohit R.Cell Biochem.Biophys.,2014,68(1):97 -109.
[14]Liu H,Xie M X,Kang J.Acta Chim.Sin.(刘媛,谢孟峡,康娟.化学学报),2003,61(8):1305-1310.
[15]Wang Y J,Zhang Y Q,Li Y X,Li Y F,Zhang H R.J.Instrum.Anal.(王迎进,张艳青,李亚雄,李艳芳,张海容.分析测试学报),2013,32(2):239-243.
[16]Yeggoni D P,Gokara M,Manidhar D M,Racharnallu A,Nakka S,Reddy C S,Subramanyam R.Mol.Pharm.,2014,11(4):1117-1131.
[17]Meti M D,Nandibewoor S T,Chimatadar S A.Monatshefte fur Chemie,2014,145(9):1519-1527.
[18]Jiang C Q,Gao M X,He J X.Anal.Chim.Acta,2002,452(2):185-189.
[19]Xie B,Wang B J,Qin Z H.Chin.J.Spectrosc.Lab.(谢兵,万邦江,秦宗会.光谱实验室)2011,28(2):764-769.
[20]Hu Y J,Liu Y,Wang H B,Xiao X H,Qu S S.J.Pharm.Biomed.Anal.,2004,36(4):915 -919.
[21]Dorraji M S,Azar V P,Rasoulifard M.Eur.J.Phammacol.,2014,64:9 -17.
[22]Manivel P,Anandakumar S,Ilanchelian M.Luminescence,2014,28:427-434.
[23]Meti M D,Byadagi K S,Nandibewoor S T,Nandibewoor S D,Joshi U A,More S A,Chimatadar S A.Mol.Biol.Reports,2014,41(4):2377-2387.
[24]Li J F,Li J Z,Jiao Y,Dong C.Spectrochim.Acta A,2014,118:48-54.

